11C蛋氨酸PET/CT與MRI對腦膠質瘤術前診斷價值的比較研究
王 如,錢立庭,汪世存,展鳳麟,潘 博,張紅雁,馬 軍
(安徽醫科大學附屬省立醫院,安徽 合肥 230001)
腦膠質瘤是最常見的顱內腫瘤,發病率約占顱內腫瘤的40%~50%[1]。MRI是目前顱內腫瘤患者術前首選的檢查方法,其顯像原理為在解剖層面上顯示腫瘤。PET/CT將PET和CT兩種影像技術結合,使PET的功能顯像與CT的結構顯像融于一體,既可對病灶定位,又可定性。本研究以11C標記的蛋氨酸(Methionine,MET)為示蹤劑的PET/CT及MRI對臨床疑診膠質瘤患者進行術前檢查,以明確11CMET PET/CT對膠質瘤的術前診斷價值。
1 材料與方法
1.1 一般臨床資料
選取2010年10月—2011年6月入住我院神經外科的11例經MRI檢查后疑診為膠質瘤的患者接受11C-MET PET/CT檢查。11例患者均為初發,且未經任何治療。11例患者中男6例,女5例,年齡27~81歲,中位年齡45歲。腫瘤位于顳葉2例,額葉5例,頂葉、島葉、島葉+額葉、額葉+顳葉各1例。
1.2 研究方法
1.2.1 MRI檢查
綜合多種文獻報道及本院MRI科室多年的診斷經驗,將MRI診斷膠質瘤的標準界定如下:①低分級膠質瘤:通常表現為等或長T1長T2信號,邊界清楚或不清,囊變、壞死及出血少見,瘤周水腫輕或無,可有占位效應,增強掃描一般無強化。②高分級膠質瘤:常表現為邊界不清、信號不均勻的長T1長T2信號,外形不規則,瘤內易形成囊變、壞死、出血,瘤周水腫顯著,增強掃描明顯不均勻強化,甚至可見厚壁環形強化[2-3]。
1.2.2 PET/CT檢查
PET/CT儀為Biograph HR 16機型(Siemens,Germany),其空間分辨率3.8 mm,層厚8 mm。檢查前患者不需禁食,平臥在掃描床上,封閉視聽,靜脈注射MET 10~20 mCi,約20 min后進行掃描,掃描歷時10 min左右。采集時選擇11C半衰期進行衰減校正,通過衰減校正后重建PET影像(3 mm層厚)。PET/CT檢查時KPS評分50~90,中位數90。MET濃聚灶經2位有多年PET診斷經驗的核醫學科醫師目測確認。在病灶內最濃處勾畫圓形感興趣區,同時以同樣大小的圓圈選定對側灰質區多個感興趣區,計算平均值。若PET未發現異常,在MRI異常區域相應PET影像區域選定圓形感興趣區。標準攝取值(Standard uptake value,SUV)=(像素值/像素體積)/(注射的放射性核素活度/體積)×校正因子。同時作者對所有病例的T/N值(腦腫瘤組織最大SUV與對側鏡像位置正常腦組織SUV的比值)進行了整理,以期從中發現此值與膠質瘤良惡性之間的相關性,文獻報道以T/N值=1.5為閾值鑒別低級別與高級別膠質瘤的負荷率高達85.7%[4],因此本文采用了此數值。
1.3 數據處理方法
用四格表確定11C-MET PET/CT及MRI在術前診斷腦膠質瘤的敏感性、特異性和準確性。敏感性=真陽性/(真陽性+假陰性)×100%,特異性=真陰性/(真陰性+假陽性)×100%,準確性=(真陽性+真陰性)/(真陽性+假陽性+真陰性+假陰性)×100%。
2 結果
2.1 PET/CT檢查情況
11例患者中,9例顯示放射性攝取增高,T/N值均≥1.2;2例放射性攝取減低,T/N值分別為0.83、0.94。T/N值平均范圍為0.83~5.6,中位數為1.8。其中有3例患者的T/N比值分別為1.8、2.2、2.2,按照上述T/N值=1.5的分界標準,作者將這3例患者歸類為高級別膠質瘤。
2.2 術后病理及分級情況
術后共有10例患者確診為膠質瘤(9例為PET/ CT檢查放射性攝取增高者,T/N值≥1.2;1例為攝取減低者,T/N值=0.94),其中 6例星形細胞瘤(WHOⅡ級5例、Ⅲ級1例)、1例混合型少突-星形細胞瘤(WHOⅡ級)、1例少突膠質細胞瘤(WHOⅡ級)、2例膠質母細胞瘤(WHOⅣ級)。另外1例為膠質細胞增生(T/N值=0.83)。上述3例T/N值分別為1.8、2.2、2.2的患者病理均為WHOⅡ級。與PET/CT及MRI檢查結果相比較,11C-MET PET/CT與MRI對膠質瘤術前診斷的敏感性、特異性及準確性分別為100%、100%、100%和100%、0、91%。依據T/N值=1.5的分界標準,11C-MET PET/CT在術前判斷膠質瘤惡性程度的準確性為73%(8/11)(圖1,2)。
3 討論
傳統的CT、MRI等都是解剖學顯像方法,不能反映腫瘤的細胞代謝水平,且MRI存在著圖像失真問題,對腦膠質瘤術前診斷有一定局限性。近年來隨著正電子放射性藥物和PET/CT技術的發展,腫瘤研究發展到活體病理和生化改變的分子影像階段,PET/CT在膠質瘤中的應用價值日益受到重視。Pirotte等[5]選取66例幕上高分級膠質瘤患者在術前行PET/CT及MRI檢查,發現PET檢測出的腫瘤體積大于MRI,且通過手術將PET顯示的示蹤劑濃聚區完全切除可觀察到患者的生存率延長,而將MRI檢出的病灶完全切除則未見到此種改變。由此可見PET/CT在顯示膠質瘤范圍方面的優越性,這點對確定膠質瘤放療靶區有重要意義。在PET/CT顯像中,18F-FDG是最常用的顯像劑,但由于正常腦組織中也濃聚大量18F-FDG,惡性程度相對較低的膠質瘤放射性濃聚程度較低,而在部分良性病變如腦梗塞、炎癥等時也可能會濃聚,高本底的18F-FDG的圖像上就難以與正常腦組織區分,從而出現假陰性或假陽性結果。
11C-MET是目前用于腦腫瘤PET顯像最多的氨基酸類顯像劑,它能反映體內氨基酸的轉運、代謝和蛋白質合成情況。與18F-FDG相比,11C-MET PET/CT具有兩大優勢:腫瘤的間變壞死區對11CMET的攝取較18F-FDG明顯下降;11C-MET的腦本底低,與腫瘤對比明顯,因此11C-MET對腦膠質瘤的檢出率高。Hatakeyama等[6]對41例新確診的膠質瘤患者行11C-MET PET/CT顯像后發現有36例患者表現為高11C-MET攝取,診斷敏感度為87.8%,同時惡性膠質瘤100%被檢出。Yamaoto等[7]選取15例膠質瘤患者(其中WHOⅡ級5例、Ⅲ級3例、Ⅳ級7例)分別行18F-FDG及11C-MET PET顯像,發現所有患者的11C-MET攝取均增高,診斷敏感度為100%,而18F-FDG的診斷敏感度僅為40%。本研究中11例患者,9例放射性攝取增高者均經病理證實為膠質瘤,充分說明了11C-MET PET/CT診斷膠質瘤的優越性,而另外2例攝取稍減低者,經病理證實1例為膠質瘤,1例為膠質細胞增生。作者初步推測,如果11C-MET PET/CT顯像陽性則罹患膠質瘤的概率很高,但顯像陰性卻不能排除患膠質瘤的可能性。Branu等[8]的研究支持了作者的觀點。
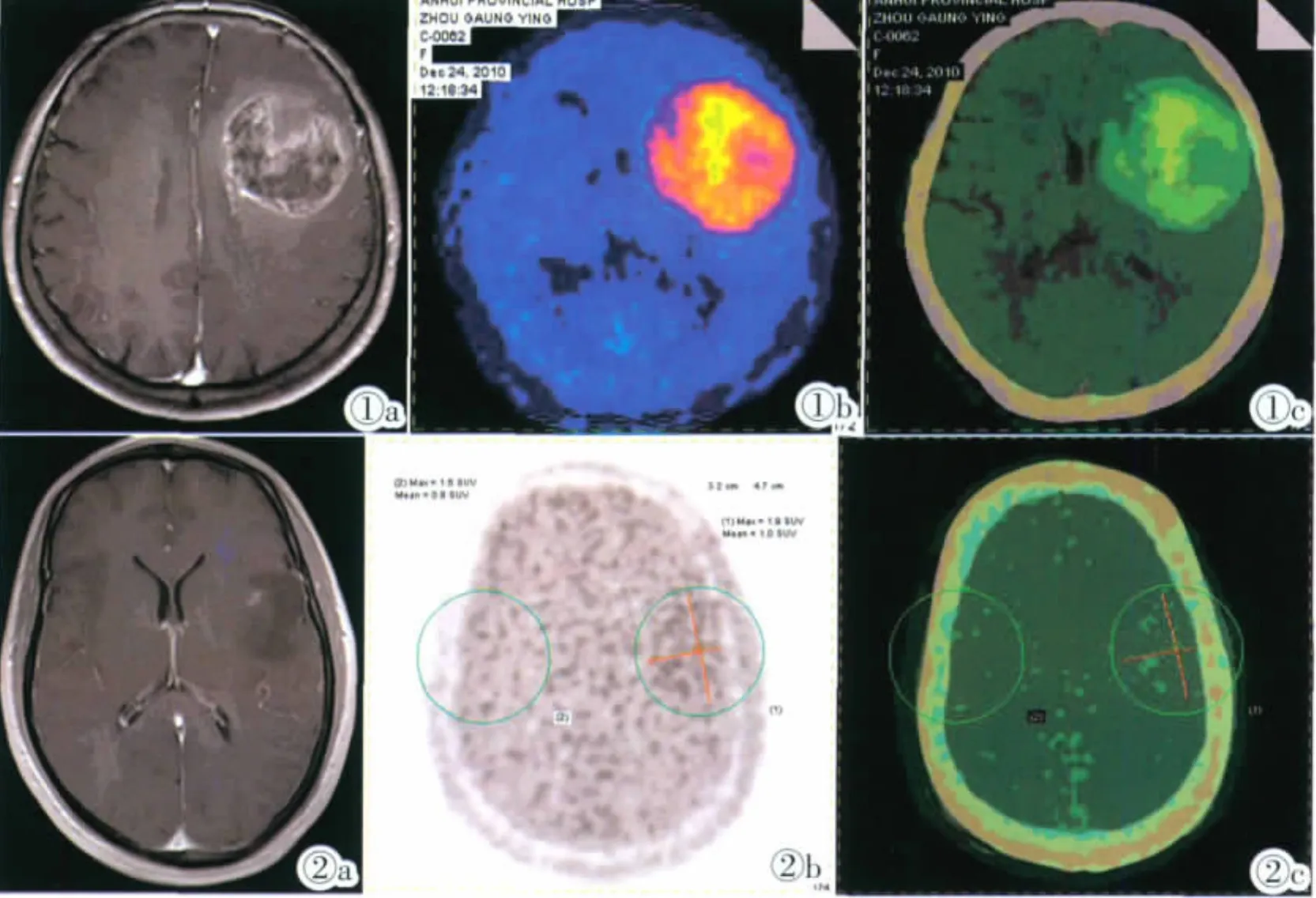
圖1 女,71歲,系“右手乏力伴言語不暢2周”入院。頭顱MRI:左側額顳葉類圓形長T1長T2信號,信號不均,其內可見小片狀更長T1長T2信號,病灶周圍見環形水腫帶,增強后病灶明顯不均勻強化。PET/CT:左額顳葉團塊狀稍高密度影,11C-MET放射性攝取異常增高,SUV最大值5.8,對側正常位置SUV最大值2.0,考慮高級別膠質瘤可能。術后病理:膠質母細胞瘤(WHOⅣ級)。 圖2 男,36歲,系“頭痛伴抽搐1次”入院。頭顱MRI:增強后左側島葉及左額葉皮層及皮層下區可見一大小約4.5 cm×3.2 cm不均勻強化區,病灶內部可見較散在斑片狀強化。PET/CT:左側額顳葉彌漫性輕度放射性攝取增高,11C-MET代謝輕度增高,病變處SUV最大值1.9,對側SUV最大值1.6。術后病理:星形細胞瘤(WHOⅡ級)。Figure 1. Female,71 years old,was admitted because of right-hand weakness with poor expression for two weeks.Brain MRI showed a round lesion of long T1and long T2signal in the left frontal and temporal lobe.The signal was uneven with small pieces of a longer T1and long T2signal inside and ring-like edema around.The lesion enhanced significantly and heterogeneously after enhancement.PET/CT showed a slightly high density lesion in the left fronto-temporal lobe,with abnormal increased uptake of11C-MET.Its SUVmax was 5.8,and that from the contralateral area was 2.0,indicating the possibility of high-grade gliomas.Pathology:glioblastoma cell tumor(WHO Ⅳ grade). Figure 2. Male,36 years old,was admitted for headache associated with convulsions.MRI showed a lesion with a size of about 4.5 cm×3.2 cm in the cortical and subcortical zone of left insular and frontal lobes.The lesion showed heterogeneous patchy enhancement.PET/CT showed diffuse mild increased radiotracer uptake in the left frontal temporal lobe.Metabolism of11C-MET slightly elevated,with SUVmax value of 1.9,and that from the contralateral area of 1.6.Pathology:astrocytoma(WHOⅡ grade).
不僅如此,11C-MET PET/CT在低級別腦腫瘤的檢出及鑒別診斷病變的良惡性方面也具有重要意義。Narayanan等[9]選取17例疑診星形細胞瘤(WHOⅡ級9例、Ⅲ級8例)的患者進行18F-FDG和11CMET PET/CT顯像。在所有WHOⅡ級患者中,18FFDG攝取未見明顯增高,而11C-MET攝取卻顯著增高;在WHOⅢ級患者中,18F-FDG和11C-MET的攝取均增高,以11C-MET增高更明顯。作者認為11CMET的攝取增高反映了腫瘤組織的蛋白質合成增加,較18F-FDG更具特異性。Cai等[10]認為高級別、低級別腫瘤及非腫瘤病變對18F-FDG和11C-MET的攝取程度均不同,但從統計學角度而言,僅11C-MET在低級別腫瘤和非腫瘤病變中的攝取差異有意義,因此11C-MET在區分低級別腫瘤與非腫瘤性病變方面更有價值。值得指出的是,盡管11C-MET PET/ CT顯像能較好地區分高級別與低級別膠質瘤,但在某些相鄰病理級別膠質瘤的區分上仍存在較大困難,Nariai等[11]選取194例患者行11C-MET PET/CT顯像,應用T/N值對圖像進行分析,發現在低級別與高級別膠質瘤組之間存在顯著差異,但在WHOⅠ級與Ⅱ級之間及WHOⅢ級與Ⅳ級之間卻未發現統計學差異。本研究以T/N值=1.5為閾值鑒別低級別與高級別膠質瘤,準確性僅為73%,出現這種現象可能是因為注射藥物的質量、開始檢查及采集時間、患者的年齡、體重等均會影響示蹤劑在腦內的分布、轉運、清除及信息的采集和表達,從而導致SUV值變化較大,影響結果的判讀,加強PET的質控技術可能會減少這種差異的產生。且本研究所選病例較少,無法對T/N值與分級間關系進行相關性分析,若增加樣本量,可能會得出更有意義的結論。
盡管如此,仍有大約20%的低級別腦腫瘤不能被檢測到,同時一些非腫瘤病變如梗死、血腫及炎性組織等卻可能顯示高攝取[12]。本研究中的11例患者盡管全被診斷及鑒別出,可能與選取病例較典型及病例數不夠多有關,增加樣本量勢必會得出更具說服力的結論。多種顯像劑的聯合應用、多種成像技術的相輔相成可能是目前提高膠質瘤診斷準確性的最佳途徑,如將PET與MRI融合進行顯像,Boss等[13]認為PET/MRI的空間分辨率要高于PET/CT,在顯示較小的解剖結構時更具優勢。可以推測,PET/MRI作為一項嶄新的技術,將具有廣闊的應用前景,同時臨床仍需開發其它顯像劑以更靈敏特異地診斷腦部腫瘤及定性。
[1]王春琳,盧亦成,陳菊祥,等.胼胝體膠質瘤的預后影響因素:附60例分析[J].中華神經醫學雜志,2009,8(8):820-824.
[2]劉曉雷,趙瑞華,靳二虎.腦內低級別膠質瘤惡變為膠質母細胞瘤MRI表現一例報告[J].臨床和實驗醫學雜志,2007,6(10):46-47. [3]李軍,杜龍庭,朱襄民,等.毛細胞星形細胞瘤的MR診斷分析[J].實用醫學雜志,2009,25(2):304.
[4]Torii K,Tsuyugchi N,Kawabe J,et al.Correlation of amino-acid uptake using methionine PET and histological classification in various glioma[J].Ann Nucl Med,2005,19(8):677-683.
[5]Pirotte BJ,Levivier M,Goldman S,et al.Positron emission tomography-guided volumetric resection of supratentorial high-grade gliomas:a survival analysis in 66 consecutive patients[J].Neurosurgery,2009,64(3):471-481.
[6]Hatakeyama T,Kawai N,Nishiyama,et al.11C-methionine(MET) and18F-fluorothymidine(FLT)PET in patients with newly diagnosed glioma[J].Eur J Nucl Med Mol Imaging,2008,35(11): 2009-2017.
[7]Yamamoto Y,Nishiyama Y,Kimura N,et al.11C-acetate PET in the evaluation of brain glioma:comparison with11C-methionine and18F-FDG-PET[J].Mol Imaging Biol,2008,10(5):281-287.
[8]Braun V,Dempf S,Weller R,et al.Cranial neuronavigation with direct integration of (11)C methionine positron emission tomography(PET)data—results of a pilot study in 32 surgical cases[J]. Acta Neurochirurgica,2002,144(8):777-782.
[9]Narayanan TK,Said S,Mukherjee J,et al.A comparative study on the uptake and incorporation ofradiolabeled methionine, choline and fluorodeoxyglucose in human astrocytoma[J].Mol Imaging Biol,2002,4(2):147-156.
[10]Cai L,Gao S,Li DC,et al.Value of18F-FDG and11C-MET PET-CT in differentiation of brain ring like-enhanced neoplastic and non-neoplastic lesions on MRI imaging[J].Zhonghua Zhong Liu Za Zhi,2009,31(2):134-138.
[11]Nariai T,Tanaka Y,Wakimoto H,et al.Usefulness of L-[methyl-11C]methionine-positron emission tomography as a biological monitoring tool in the treatment of glioma[J].J Neurosurg,2005,103(3):498-507.
[12]Herholz K,Heiss WD.Positron emission tomography in clinical neurology[J].Mol Imaging Biol,2004,6(4):239-269.
[13]Boss A,Steqqer L,Bisdas S,et al.Feasibility of simultaneous PET/MR imaging in the head and upper neck area[J].Eur Radiol,2011,21(7):1439-1446.

