下調miR-126對大鼠降血壓作用的實驗研究
汪 劍,袁斌斌,布艾加爾·哈斯木
(南京醫科大學附屬南京明基醫院心內科,江蘇南京,210019)
原發性高血壓的是一種常見病[1],其發病與遺傳基因、腎素-血管緊張素-醛固酮系統、血管內皮功能紊亂等有關,但確切的病因尚未知。miRNA是一種長度約為22個核苷酸的內源性非編碼、單鏈小RNA,在動物種系發生中具有保守序列,在基因表達調控上發揮重要作用[2]。miR2 NA具有組織特異性,在所有的 miRNA中, miR126是內皮特異性的miRNA,它能促進血管生成,維持血管的完整性等[3]。有研究表明,在高血壓的患者中血清炎性因子的表達明顯上調[4]。同時在高血壓的患者中 miR-126高表達,而在正常人群中低表達[5]。本研究擬想通過RNAi技術來下調miR126起到治療高血壓的作用。通過構建慢病毒-下調miR-126載體,轉染至大鼠中,通過每周測量收縮壓(SBP)、舒張(DBP)、平均動脈壓(MAP)、心率(HR)等,并且測定血清NO等含量,來研究miR-126是否有治療高血壓的作用。
1 材料與方法
1.1 慢病毒載體的構建(lenti-miR-126-KD)
采用人類免疫缺陷病毒-1(HIV-1)的慢病毒載體。其載體有2種真核表達啟動子,啟動子為CMV和 U6。在 U6啟動子后的AgeI和EcoRI為限制性內切酶的識別位點。NEB Buffer 1為緩沖液,所有限制酶反應在37℃下進行2 h。克隆設計的原理圖:Mo-mir-126 ripe rank:> rno-miR-126 MIMAT0000832 UCGUACCGU2 GAGUAA UAAUGCG。下調設計的原理圖:利用U6啟動子來表達靶基因片段,如下: MS2117-1 CCGGCGCATTATTACTCACGGT ACGATTTTTTG MS2117-2 AATTCAAAAAATCGTACCGTGA GTAATAATGCG
1.2 動物和分組
根據需求應用PBS緩沖液將慢病毒載體稀釋為350μL,從大鼠的尾靜脈射入。24只8周齡自發性高血壓雄鼠隨機分成以下4組(每組6只):①高劑量組(HD):每只大鼠注射LentimiR-126-KD 1×108;②低劑量組(LD):每只大鼠注射Lenti-miR-126-KD 1×05;③空載組(Scramblemir):每只大鼠注射Lenti-Scram2 blemir 5×107;④對照組:每只大鼠僅注射PBS。
1.3 方法
1.3.1 血壓、心率和體重:應用 Softron BP-98A大鼠尾中動脈非侵入性的血壓儀,在大鼠清醒狀態和安靜環境下,測量大鼠的尾中動脈SBP, MAP,DBP和HR,每次測量均在同一時間點,每只大鼠均連續測量至少3次,取平均值。連續觀察8周以獲取相關資料。分別記錄試驗前和試驗8周后的大鼠體重。
1.3.2 免疫熒光染色:取大鼠心、肝、肺、腎臟和腦組織,將各組織進行固定、沉積、速凍、切片。將切片置于顯微鏡載物玻璃片容器上,加50%蔗糖,蓋上蓋玻片,在熒光顯微鏡下觀察綠色熒光蛋白,以得知慢病毒載體在體內分布情況,觀察各組中綠色熒光蛋白表達的區別,同時鑒別轉染是否成功。
1.3.3 酶聯免疫吸附(ELISA)測定:利用3%戊巴比妥鈉(0.2 g/100 g)將大鼠麻醉,開胸,用注射器從心尖取5 mL血,室溫下以轉速3 000 r/ min離心 15 min獲得血清標本。一氧化氮(NO)、白蛋白(ALB)、谷草轉氨酶(AST)、丙氨酸轉氨酶(AL T)、膽固醇(CHOL)、高密度脂蛋白膽固醇(HDL-C)、甘油三酯(TG)、血尿素氮(BUN)、肌酐(CREA)及鈉、鉀、鈣等含量用ELISA法測定。
2 結 果
2.1 lenti-miR-126-KD的構建
下調miR-126 DNA的測序結果見圖1,高亮區顯示與成熟 miR-126 5′CGCATTAT2 TACTCACGGTACGA3′完全互補的反義序列。這表明慢病毒載體建立成功,病毒滴度為2×1010TU/mL。
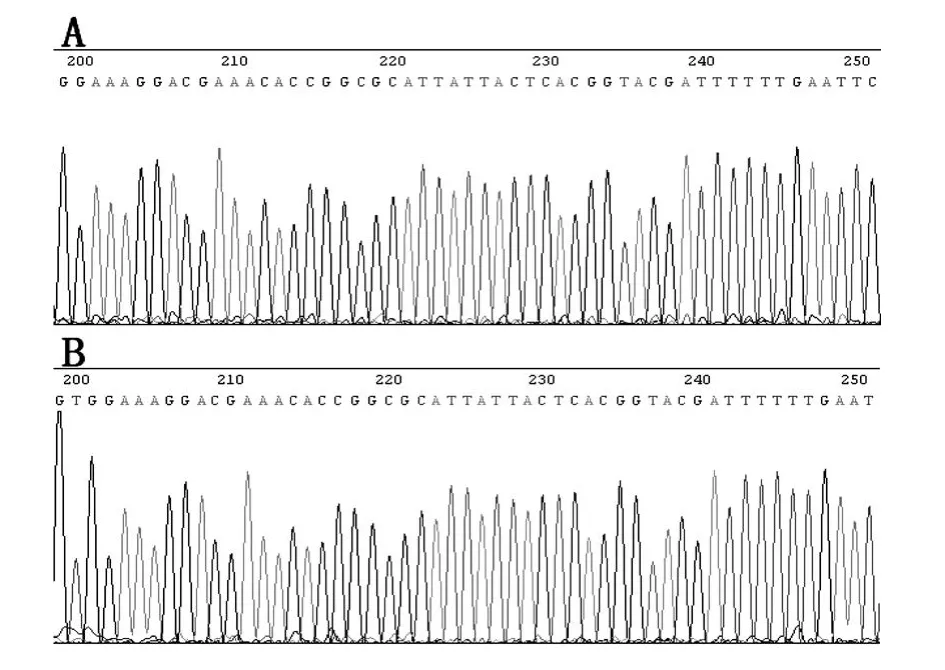
圖1 lenti-miR-126-KD的DNA測序結果高光區域為miR-126的反義核苷酸序列: A.MS2117-1;B.MS2117-2
2.2 血壓和心率
如表1~表4和圖2所示,收縮壓,舒張壓和心率在試驗前和試驗后8周中無統計學意義(P >0.05)。無論處理或不處理,無論藥物劑量的大小均無顯著影響。經過處理后4周,HD組和LD組與對照組相比,心率有下降趨勢,但無統計學差異(P>0.05)。
2.3 綠色免疫熒光蛋白染色
慢病毒載體沒有明顯的嗜組織性。綠色熒光在每個組織中的表達,如圖3。所有組織在每一組顯示綠色熒光,其腦組織中分布較少,多在肺組織。
2.4 一氧化氮和生化指標
一氧化氮和生化指標如AST、AL T、ALB、CHOL、HDL-C、TG、BUN、CREA、鈉、鉀、鈣等,各組間無統計學差異(P>0.05)。見表5。
表1 收縮壓的時間依賴性(±s,mmHg)

表1 收縮壓的時間依賴性(±s,mmHg)
時間 HD(n=6) LD(n=6) Scramblemir(n=6) 對照組(n=6) P value Pre-administer 167.32±8.83 166.67±7.54 162.62±9.31 164.95±9.48 0.809 1stweek 174.80±3.12 177.86±4.31 175.97±4.32 180.22±6.77 0.364 2ndweek 186.98±5.34 187.71±5.30 182.16±4.42 182.22±5.45 0.163 3rdweek 189.86±7.73 185.07±6.96 187.94±7.21 190.28±8.99 0.667 4thweek 179.83±7.06 184.62±8.93 187.75±5.65 185.44±8.20 0.469 5thweek 180.08±7.18 178.39±12.39 184.60±7.69 188.14±6.24 0.268 6thweek 187.35±12.50 192.85±8.44 186.06±10.89 189.71±12.53 0.740 7thweek 193.25±8.39 187.54±8.11 190.06±4.51 187.58±7.01 0.570 8thweek 182.88±5.33 189.17±7.12 183.65±4.29 185.50±8.03 0.405
表2 平均動脈壓的時間依賴性(±s,mmHg)

表2 平均動脈壓的時間依賴性(±s,mmHg)
(3Kruskal-Wallis nonparameter test)
時間 HD(n=6) LD(n=6) Scramblemir(n=6) 對照組(n=6) P Pre-administer 143.43±9.95 140.28±10.55 135.29±6.85 139.30±8.50 0.527 1stweek 145.44±9.21 144.39±6.91 144.18±9.10 147.04±8.45 0.926 2ndweek3 155.88±13.62 152.46±6.71 150.15±3.69 152.32±5.05 0.6983 3rdweek 163.25±10.85 155.92±8.50 160.70±6.22 162.52±9.73 0.520 4thweek 151.25±7.26 160.12±7.76 159.64±8.63 158.69±14.95 0.563 5thweek 153.60±5.56 161.94±8.41 155.68±7.46 164.25±12.27 0.221 6thweek 162.29±7.82 167.37±5.67 159.58±6.69 162.80±10.35 0.409 7thweek 156.58±5.30 157.74±4.58 158.00±10.34 157.04±9.84 0.992 8thweek 150.40±4.75 161.25±9.47 154.18±6.64 154.74±6.65 0.182
表3 舒張壓的時間依賴性(±s,mmHg)

表3 舒張壓的時間依賴性(±s,mmHg)
時間 HD(n=6) LD(n=6) Scramblemir(n=6) 對照組(n=6) P Pre-administer 131.4±10.63 127.06±12.59 121.10±13.02 127.08±13.22 0.599 1stweek 130.83±9.67 128.31±8.00 129.44±8.77 130.88±9.58 0.956 2ndweek 139.33±11.17 134.86±10.17 134.64±7.82 137.45±8.58 0.837 3rdweek 150.33±11.18 140.19±8.99 146.92±7.55 146.70±11.23 0.415 4thweek 137.75±6.93 147.73±11.11 145.83±8.40 145.48±13.95 0.539 5thweek 140.08±6.71 152.90±11.04 141.96±6.11 152.01±12.89 0.103 6thweek 150.31±9.33 153.72±7.32 146.22±12.24 149.62±13.19 0.704 7thweek 138.58±7.60 143.67±6.14 141.72±5.95 142.00±12.82 0.8293 8thweek 134.08±10.22 146.76±7.80 139.44±9.58 138.86±14.16 0.332
表4 心率的時間依賴性(±s,mmHg)
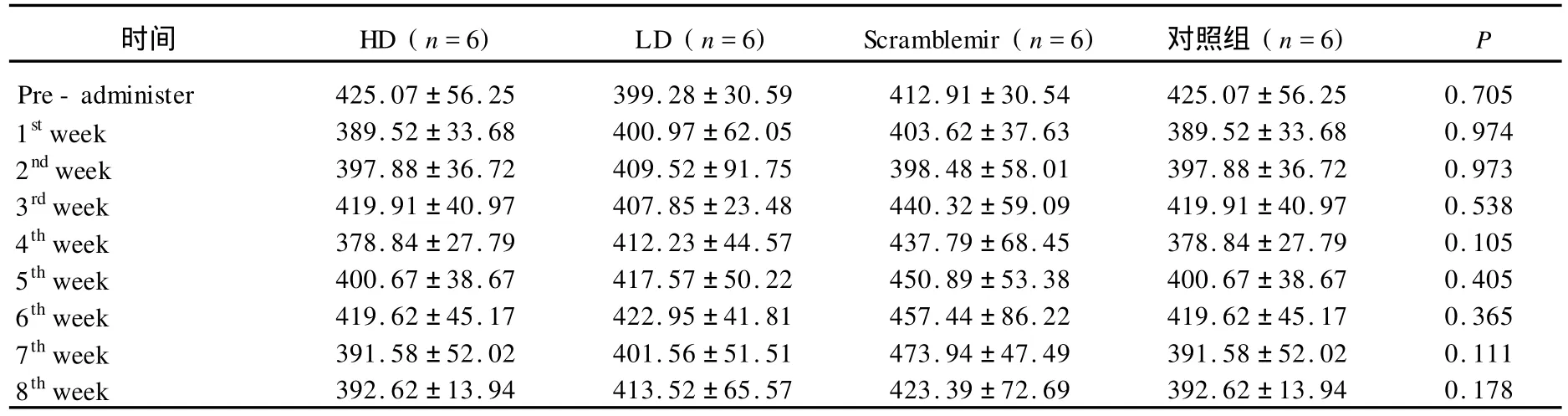
表4 心率的時間依賴性(±s,mmHg)
時間 HD(n=6) LD(n=6) Scramblemir(n=6) 對照組(n=6) P Pre-administer 425.07±56.25 399.28±30.59 412.91±30.54 425.07±56.25 0.705 1stweek 389.52±33.68 400.97±62.05 403.62±37.63 389.52±33.68 0.974 2ndweek 397.88±36.72 409.52±91.75 398.48±58.01 397.88±36.72 0.973 3rdweek 419.91±40.97 407.85±23.48 440.32±59.09 419.91±40.97 0.538 4thweek 378.84±27.79 412.23±44.57 437.79±68.45 378.84±27.79 0.105 5thweek 400.67±38.67 417.57±50.22 450.89±53.38 400.67±38.67 0.405 6thweek 419.62±45.17 422.95±41.81 457.44±86.22 419.62±45.17 0.365 7thweek 391.58±52.02 401.56±51.51 473.94±47.49 391.58±52.02 0.111 8thweek 392.62±13.94 413.52±65.57 423.39±72.69 392.62±13.94 0.178
3 討 論
慢病毒載體是一種復制缺陷的反轉錄病毒載體,本研究中我們采用慢病毒作為下調miR-126的載體,其含有兩個啟動子,一個是CMV啟動子,它促進綠色免疫熒光蛋白基因的表達。另一個是U6啟動子,在它的下游插入與mir-126互補的靶基因片段 ,從而使基因下調。如圖1所示 ,構建載體后成功測序。病毒載體轉染八周后,在自發性高血壓大鼠(SHR)心臟、腎臟、肝臟、腦及肺的組織切片檢測到綠色熒光,如圖4所示。這表明慢病毒轉染成功,并且在試驗結束時在SHR中仍有可確定的密度。原發性高血壓的發病機制非常復雜,有文獻推測炎癥和免疫反應可能是重要的機制之一。Liu等[6]檢測到miR-126可以在細胞和系統水平下調VEGF的表達,亦有研究表明,miR-126在高血壓患者中高表達。因此我們擬想miR-126可能會減少內源性VEGF的表達,從而導致高血壓的發生。遺憾的是,本試驗并未取得預期的結果。經過8周觀察,與 Scram2 blemir及對照組相比較,并未發現血壓下降,NO及其他生化指標,心率等亦無統計學差異。
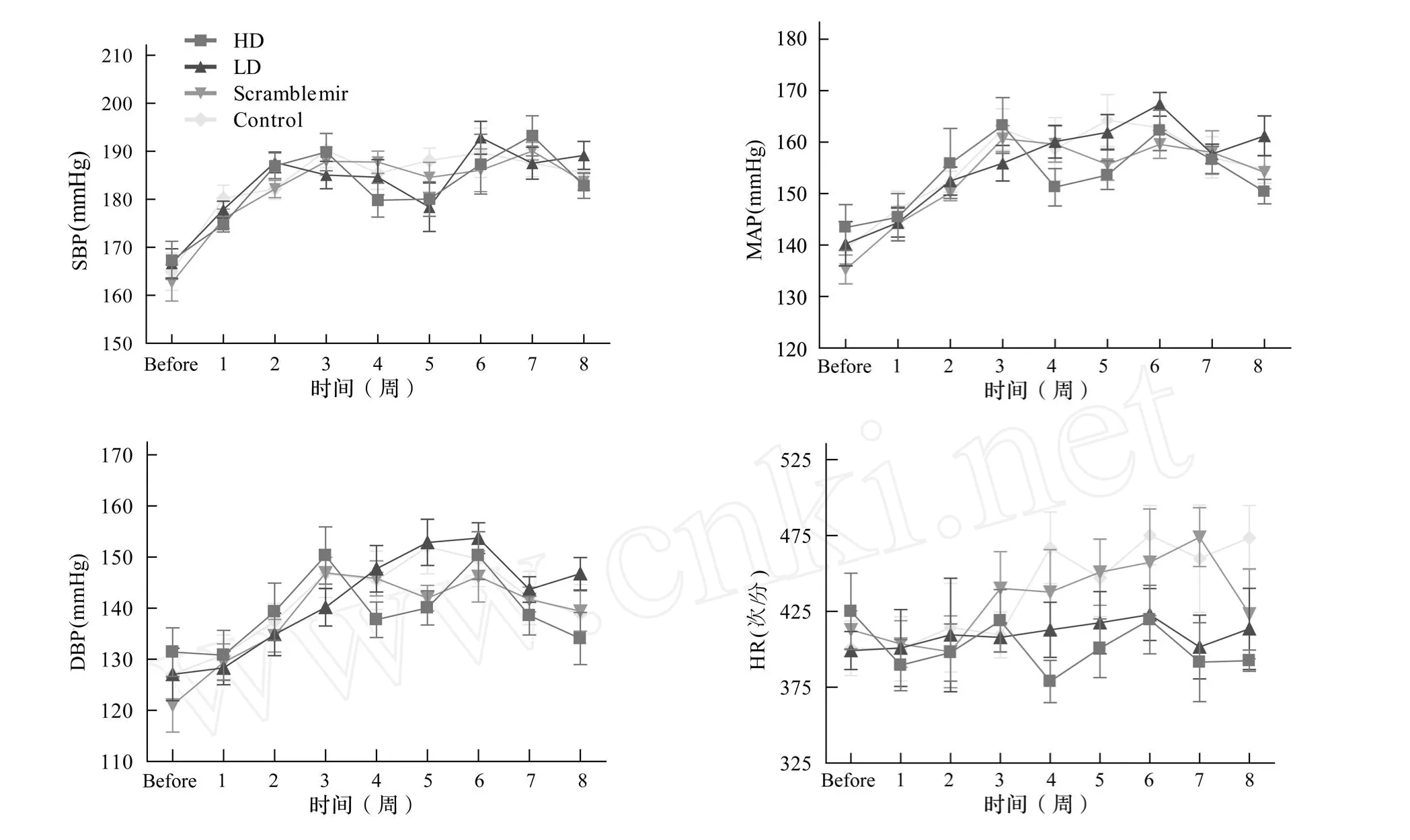
圖2 SBP、MAP、DBP和HR分析

圖3 綠色免疫熒光蛋白的表達A.腦組織;B.肝臟組織;C.肺組織; D1.心肌縱向切面;D2.心肌橫向切面; E1.應用低功率透鏡觀察的腎臟組織; E2.應用高功率透鏡觀察的腎臟組織
下調miR-126的表達并未達到降壓的目的。推測有四種可能:①目前對miR-126的功能研究基于體外研究,很少進行體內試驗,利用慢病毒作為治療高血壓的載體基因的體內研究是非常有限的,尚未確定是否需要重復處理[7]。在本研究中,注射八周后觀察到綠色熒光,本研究可以確定慢病毒載體相關濃度可以被檢測到,但不能證實已達到治療濃度,且也不能確認miR-126表達是否成功下調。應該進一步采用 Westen-blot, RT-PCR和基因芯片等技術檢查SHR大鼠中miR-126的濃度,獲得各組miR-126的表達差異和濃度梯度,由此來確認處理是否合理;②觀察時間:慢病毒載體的基因治療反應慢、持續時間長[8],本研究中每周觀察1次,這個方法是否合理仍需進一步研究;③大鼠與人類的差異:本研究是以高血壓患者與健康人之間的顯著差異性為基礎的,畢竟人和大鼠在基因組學、遺傳學、生理學等各方面都有顯著偏差,其基因表達程度,激活機制和功能都可能不一致;④miR-126表達可能僅僅是高血壓的一個代償機制。本研究推測在高血壓患者中,內皮功能損傷,炎癥反應被激活, miR-126表達代償性增高,一方面它可以激活VEGF信號通路,促進內皮增生和損傷的細胞修復,抑制血管增厚,改善血管重構[9];另一方面,激活的VEGF通路可以促進eNOS產生NO,逆轉腎素-血管緊張素-醛固酮系統紊亂[10]。
表5 一氧化氮和生化指標(±s)

表5 一氧化氮和生化指標(±s)
指標 HD(n=4) LD(n=5) Scramblemir(n=5) 對照組(n=5) P NO(μmol/L) 8.30±5.00 8.08±6.35 14.00±10.01 4.49±2.06 0.233 ALB(g/L) 16.02±1.74 16.62±1.45 17.15±1.72 18.62±0.57 0.131 CHOL(mmol/L) 1.74±0.32 1.59±0.06 1.69±0.12 1.64±0.05 0.552 LDL-C(mmol/L) 0.22±0.14 0.14±0.12 0.15±0.10 0.06±0.04 0.280 TG(mmol/L) 0.27±0.07 0.22±0.09 0.28±0.32 0.29±0.10 0.601 AST(U/L) 311.03±56.75 213.84±63.46 244.84±119.86 205.04±165.65 0.610 ALT(U/L) 59.37±8.66 57.67±8.96 61.47±13.63 65.32±9.18 0.764 BUN(mmol/L) 8.44±1.20 7.67±1.30 7.09±1.27 6.75±1.57 0.398 CREA(umol/L) 41.13±4.77 36.76±11.97 29.97±3.96 34.47±3.36 0.244 Na+(mmol/L) 146.27±2.21 147.93±1.32 147.37±1.46 146.36±1.86 0.422 K+(mmol/L) 6.86±1.07 6.07±0.63 6.75±0.53 6.66±0.71 0.250 Ca2+(mmol/L) 2.42±0.04 2.40±0.12 2.42±0.11 2.40±0.06 0.976
綜上所述,下調miR-126在抗高血壓治療方面無顯著性意義,高血壓患者中miR-126水平的高表達可能是由于代償機制[11-14]。但是,本研究有一定的局限性,需要進一步的研究來揭開其中的潛在機制。
[1] Liu L S,Wang W,Yao C H.Chinese prevention and cure guideline for hypertension[J].Chinese Journal of Hyperten2 sion,2010,18(1):11.
[2] Pillai R S,Bhattacharyya S N,Filipowicz W.Repression of protein synthesis by miRNAs:how many mechanisms[J]. Trends Cell Biol,2007,17(3):118.
[3] Zernecke A,Bidzhekov K,Noels H,et al.Delivery of mi2 croRNA-126 by apoptotic bodies induces CXCL12-depen2 dent vascular protection[J].Sci Signal,2009,2(100): ra81.
[4] Stumpf C,John S,Jukic J,et al.Enhanced levels of platelet P-selectin and circulating cytokines in young patients with mild arterial hypertension[J].J Hypertens,2005,23(5): 995.
[5] Cai J,Yi F F,Yang L,et al.Targeted expression of recep2 tor-associated late transducer inhibits maladaptive hypertro2 phy via blocking epidermal growth factor receptor signaling [J].Hypertension,2009,53(3):539.
[6] Liu B,Peng XC,Zheng XL,et al.MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo[J].Lung Cancer,2009,66 (2):169.
[7] Solly F,Fish R,Simard B,et al.Tissue-type plasminogen activator has antiangiogenic properties without effect on tu2 mor growth in a rat C6 glioma model[J].Cancer Gene Ther, 2008,15(10):685.
[8] Lesch H P,Pikkarainen J T,Kaikkonen M U,et al.Avidin fusion protein-expressing lentiviral vector for targeted drug delivery[J].Hum Gene Ther,2009,20(8):871.
[9] Wang S,Aurora A B,Johnson B A,et al.The endothelialspecific microRNA miR-126 governs vascular integrity and angiogenesis[J].Dev Cell,2008,15(2):261.
[10] Fish J E,Santoro M M,Morton S U,et al.miR-126 reg2 ulates angiogenic signaling and vascular integrity[J].Dev Cell,2008,15(2):272.
[11] 向 紅,黃 榕,周亞麗.高血壓與糖尿病對動脈彈性指數及循環內皮微顆粒影響的對比研究[J].南方醫科大學學報,2010,30(10):2387.
[12] 陳 蘭.洛汀新治療高血壓的療效觀察[J].海南醫學院學報,2010,16(8):1004.
[13] 劉曉明,蘇蘭娣.高血壓病的防控探索及生理學分析[J].海南醫學院學報,2010,16(12):1584.
[14] 陳現紅,鄧偉民,鄒 立,等.血型與高血壓腦出血關系分析[J].南方醫科大學學報,2010,30(11):2521.

