固體基質室溫磷光法測定痕量卡維地洛
林常青,孫莉娜,林 洵
?
固體基質室溫磷光法測定痕量卡維地洛
林常青,孫莉娜,林 洵
(漳州職業技術學院 食品與生物工程系, 福建 漳州 363000)
提出一種簡便、靈敏、選擇測定卡維地洛(CV)的固體基質室溫磷光法(SS-RTP)。所發展的方法是基于十二烷基苯磺酸鈉(SDBS)增敏CV活化NaClO氧化莧菜紅(A)反應而導致體系的室溫磷光(RTP)的劇烈猝滅。與無SDBS時比較,體系的磷光增強度(Δp)增大17.5倍,并且CV含量在0.200-40.0 pg/mL范圍內與Δp值成線性關系,相關系數(r)為0.9976,檢出限為5.1 × 10?14 g/mL(取樣量為0.40 μL),具有很高的靈敏度。此外,此靈敏的方法用于測定人血清中殘留CV含量的測定,結果與同步熒光法.相吻合。該反應的活化能(E)與速率常數()為69.04 Kj/mol 與 3.580×10?4/s。
卡維地洛;莧菜紅;增敏;活化;固體基質室溫磷光法
1 引言
卡維地洛(CV)是一種非選擇性β受體阻滯劑,用于抗心絞痛的高血壓藥物,并也可用于充血性心力衰竭的治療。與此同時,CV被世界反興奮劑機構和國際奧林匹克委員會列為違禁藥物之一。因此,研究CV含量的測定方法對人體疾病的預警與防治以及反興奮劑的體育運動具有重要意義和應用前景。
當前用于測定生物試樣如血漿,血清,尿液中的CV的方法有液相色譜-質譜-質譜法 (LD= 0.20 ng /mL)[1],液相色譜熒光法 (LD = 1.56 ng/mL)[2],高效液相色譜電化學法 (LD = 0.10 ng/mL)[3],氣相色譜-質譜法 (LD = 0.30 ng/mL)[4]和 LC-LC-熒光檢測耦合法 (LD = 0.70 ng/mL)[5]。但是,這些方法有諸多局限,比如耗時、樣品處理過程繁瑣毒性大、靈敏度低、測定時間長、儀器昂貴、不利推廣利用等。有些化學家雖然建立了簡便的方法,如高靈敏的流動注射熒光光譜法(LD = 3.63 × 10?9mol/L)[6]和化學發光法 (LD = 8.7 × 10?9mol/L)[7],但其背景的干擾大,選擇性較差,且推廣應用有一定的局限性;上述方法的靈敏度僅達ng級,不能滿足pg級CV 測定的需求。因此探索高靈敏、高選擇性、簡便、快速測定CV含量的新方法具有重要的學術研究價值。
室溫磷光(RTP)作為一種檢測手段具有Stokes' 位移大、易于減少或消除本底熒光和散射干擾、發光壽命長等優良特性。基于RTP的變化,建立的催化SS-RTP (LD = 5.2×10?20g/mL寶泰松)[8]、抑制SS-RTP (LD = 6.5×10?12g/mL托布他林)[9]、SSRTP傳感器[10]、磷光開關SSRTP[11]、曙紅Y分子自組裝SSRTP[12]和離子印記SSRTP[13]、離子締合SSRTP[14]及固體基質室溫磷光免疫法[15]等,充分顯示了SS-RTP用量少,操作簡便靈活、高靈敏、高選擇性等獨特優點。其中,催化SS-RTP、分子自組裝SSRTP、固體基質室溫磷光免疫法和離子締合SSRTP是分別借助催化反應的信號放大效應、曙紅Y分子自組裝、二溴熒光素納米微球及增加配位體發光分子數目等途徑,以增加生物靶上的RTP信號,從而提高SSRTP的靈敏度。采用其它途徑進一步提高SSRTP的靈敏度是當今SSRTP的研究熱點。
本研究的目的是開發一種簡單、快速、選擇性和靈敏度好的測定CV的SS-RTP。在深入探討檢測興奮劑新方法的實驗中,我們在硝酸纖維素膜(NCM)上不僅觀察到莧菜紅(A)能發射穩定的RTP,而且發現A能被NaClO氧化而發生RTP猝滅,CV被NaClO氧化而生成氯胺,生成的氯胺與A發生反應,使A被進一步氧化,顯示CV對NaClO氧化A反應有強的活化作用。更有意義的是十二烷基苯磺酸鈉(SDBS)可增敏CV活化NaClO氧化A的反應,從而導致RTP信號的劇烈猝滅。與無SDBS時比較,SDBS存在時體系的Δp增大17.5倍,為提高SSRTP的靈敏度提供新的途徑。在此實驗基礎上,我們考察了SDBS增敏CV活化NaClO氧化A的SS-RTP測定CV的可行性、最佳測定條件、分析參數與分析應用。此外,所創建的增敏CV活化SS-RTP及其測定痕量CV的機理鮮見文獻報道外,本方法對維護體育賽事的公平性和探討藥物分析的發展具有重要的研究價值和廣闊的應用前景。本研究不僅推動SS-RTP與興奮劑檢測技術的研究進展,而且促進體育運動的健康發展。
2 實驗部分
2.1 儀器與試劑
LS-55型熒光分光光度計及固體前表面處理器(貝克曼有限公司, 美國);AE240型電子分析天平(梅特勒-托利多儀器有限公司);pHS-3B酸度計;80-2 離心機(上海手術器械廠);0.5μL平頭微量注射器(上海醫用激光儀器廠)。
CV工作溶液:稱取0.00500 g CV標準品(Sigma), 用1mL of 4.0% (m/v) 乙醇溶液溶解,并定容至50.0 mL。此標準貯備溶液的濃度為0.10 mg/mL。臨用時, 用水溶液稀釋成100.00 fg/mL,避光存放。1.00×10?2mol/LA的水溶液: 0.6045 g用水溶解,并定容到100 mL, 臨用時逐級稀釋。NaClO溶液的配制:10% NaClO臨用時逐級稀釋制得。SDBS溶液: 稱取3.00gSDBS, 用水溶液溶解,并定容至100.0 mL,臨用時逐級稀釋制得所需濃度。Britton-Robinson緩沖溶液(pH 11.2)﹕在100 ml三酸混合液(磷酸、乙酸、硼酸,濃度均為0.040 mol/L)中,加入85.0ml的0.2mol/LNaOH,混合均勻即得。除了CV為基準試劑外,其它為分析純, 水為三次石英亞沸水。
定量濾紙、聚酰胺素膜(PAM)、醋酸纖維素膜(ACM)與NCM購于杭州新華紙業有限公司。預先剪切成直徑為 1.5厘米的圓片備用。
2.2 人血漿樣品制備
參考文獻[16]方法,10名男性健康志愿者參加受試,年齡(21.5±1.42)歲,身高(170.0±4.85)cm,體重(69.2± 8.13)kg,受試者無心、肝、腎等病史,無低血壓史。試驗前及試驗期間未用任何藥物,并禁煙酒。試驗期間進統一食譜且低脂飲食。研究方案經醫學倫理委員會批準,并簽署知情同意書。每名志愿者于早晨(試驗前禁食10 h 以上)空腹口服 1 mg CV試劑片(25 mg, 批號為 20090103,寧波市天衡制藥有限公司),用250 mL水送服。受試者服藥后4h 內保持臥位,服藥2 h 后飲水,并在 4h 后進食統一標準午餐。
受試者分別于給藥前取空白血樣,給藥后0.25、0.5、0.75、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0、12.0、24.0 h 由肘靜脈各取血5mL,每次取血均應在上述指定時間前后2min內完成。將采集到的血樣置肝素化離心管中,離心(3000 r/min)15 min,血漿轉移至塑料管中置-20 ℃冰箱保存,一周內測定。
2.3 實驗方法
往25 mL比色管中加入適量CV,2.00 mL A,1.50 mL SDBS,2.00 mL B-R,2.00 mLNaClO,水定容,混勻,50℃水浴加熱10 min,水流冷卻5 min,取NCM(Ф = 15 mm)壓痕(Ф= 4.0 mm),浸入1.00 mol/L Pb2+溶液10秒后,于90±1℃干燥2.5 min, 用0.50 μL平頭微量注射器懸空點樣0.40 μL,90±1 ℃下干燥2.5 min,同時做試劑空白。掃描體系的磷光光譜,記錄466 /630(nm)處的p1和p2,計算Δp值。
3 結果與討論
3.1 磷光光譜
按實驗方法掃描SDBS增敏CV活化NaClO氧化A體系的磷光光譜(圖1)。結果表明,在B-R緩沖溶液中50℃、10 min 的條件下,雖然Pb2+離子微擾劑能增強A從單線態向三線態躍遷的幾率,使A在NCM固體基質上發射RTP(圖1曲線5.,λem= 644.7 nm,p= 65.2),但A卻被NaClO氧化成為在644.3 nm處不發射RTP的化合物,從而導致A-B-R buffer體系的RTP猝滅(圖1曲線6.6',λem= 644.3 nm,p= 61.4,Δp= 3.8)。當往A-NaClO-B-R buffer體系中加入1000.0 pg CV時,加速體系的RTP猝滅(圖1曲線7. λem= 644.6 nm,p= 54.9),顯示了CV能活化NaClO氧化A的反應。然而,體系的Δp(6.5)很小,無分析價值。當SDBS存在時,A-NaClO-B-R buffer-CV體系的RTP劇烈猝滅(圖1曲線4.,λex/λem= 634.8 nm,p= 171.3),且λemmax藍移了11.1 nm,可能是SDBS與A作用形成膠束化合物(SDBS-A)。該SDBS- A對CV活化NaClO氧化A的反應有強的增敏效應,導致體系的△p(113.5)比無SDBS時的△p(6.5)增大17.5倍。此實驗事實為增敏活化NaClO氧化A的SS-RTP測定CV提供可能性。
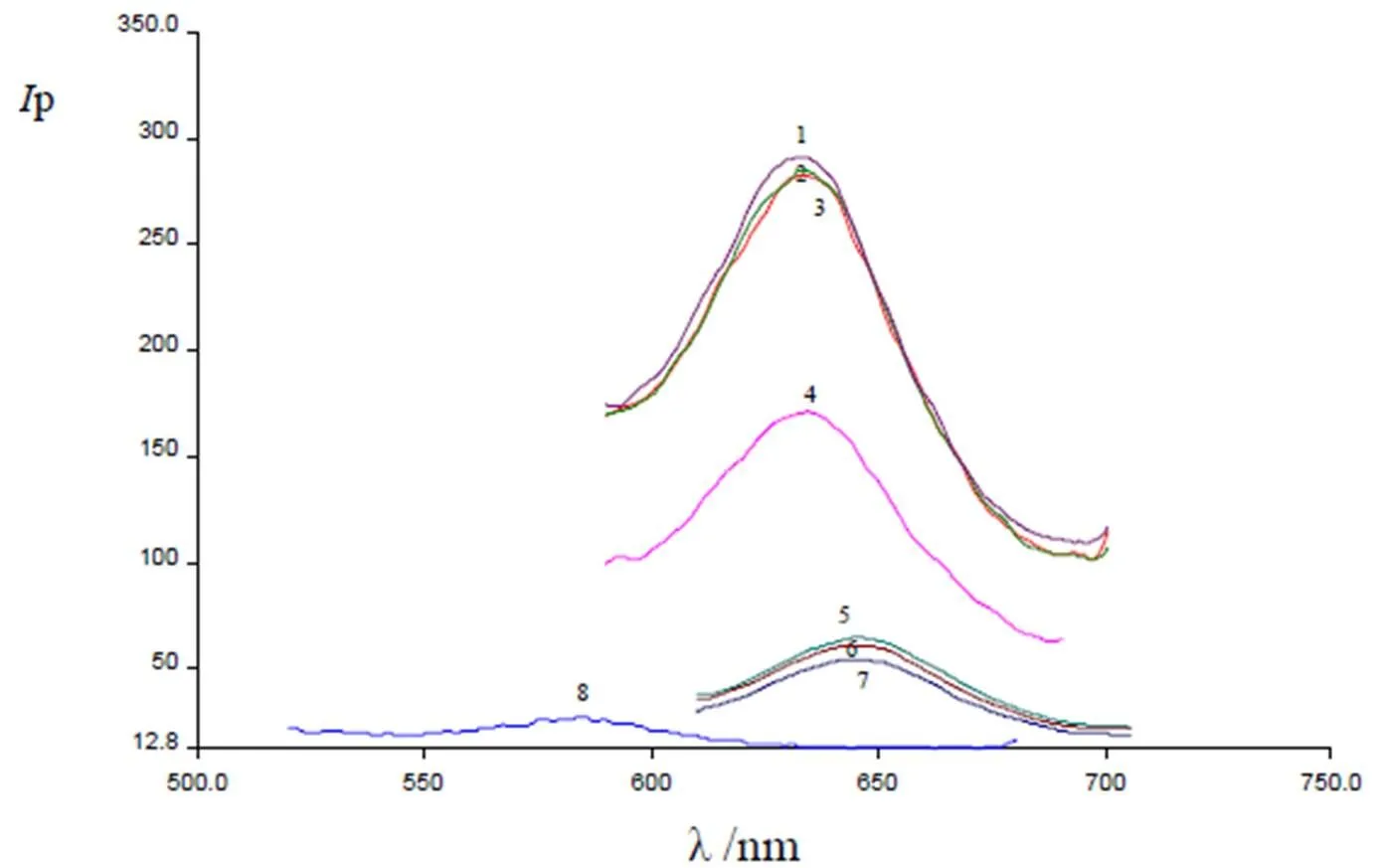
圖1 SDBS增敏CV活化NaClO氧化A體系的磷光光譜圖
3.2 最佳條件
對于CV 20Pg/mL,分別考察試劑的濃度與用量、反應酸度、反應溫度和時間、干燥溫度和時間、固體基質、增敏劑、離子微擾劑、通氮氣時間與放置時間等對體系Δp的影響,結果表明,當選用2.00 mL of 1.0×10?4mol/LA, 2.00 mL of 0.50% NaClO, 1.50 ml of 1.00% SDBS, 2.00 mL of pH 10.88 B-R and 1.00 mol/LPb2+、反應pH為10.88-11.40、反應溫度為50 ℃和反應時間為10 min、干燥溫度為90 ℃和干燥時間為2.5 min、固體基質為NCM、增敏劑為SDBS、離子微擾劑為Pb2+和通干燥N2時間為10 min時,體系的Δp最大。自取出水流冷卻5min 后始計,在5-35 min內體系中的 Δp幾乎不變。
3.3 動力學常數
對于CV 20Pg/mL,在30-50 ℃范圍內,1/T與– log[logp0/p] 呈正相關,其回歸方程為–[p0/p] = ?7.284+ 2.682×1000/ T,r = 0.9963,當T = 323 K時,活化能(E)= 69.04 Kj/mol。對于CV 200 Pg/mL,在2―10 min范圍內,t與lnp0/p線性相關,其回歸方程為p0/p= ?0.0259 + 0.0218(min), r = 0.9960,當t = 10 mim時,速率常數(k)= 3.58 × 10?4/s。
3.4 工作曲線、線性范圍、檢出限
本法CV含量在0.200-40.0 pg/mL (取樣量為0.40 μL)范圍內與Δp值成線性關系,相關系數(r)為0.9976,對CV 0.25 pg/mL和40.0pg/mL進行8次平行測定,RSD分別為 1.4%、3.7%,檢出限5.1 × 10?14g/mL(對試劑空白進行11次測定,求得p平均值為284.8,b為0.045。按3×b/及0.40μL取樣量)。
3.5 干擾實驗
用本法測定 CV 20.0 pg/mL,當相對誤差(Er)為 ± 5 ℅ 時,本法比文獻[11, 12]方法的共存離子(物)允許濃度高,選擇性好。
3.6 樣品分析
各取1.00 mL試液,按實驗方法測定血漿樣本中的CV含量,顯示了血漿中CV的平均濃度與時間的關系:在服用量為78.91 pg/mL水平的CV1.5小時后血漿濃度達到最大值,最低檢出濃度為0.80 pg/mL(相對標準偏差(RSD)≤ ± 5%)。測定結果與文獻[2]變化趨勢相吻合,并且其Er (%) ≤ ± 5%,表明本方法具有高的準確度與精密度。
同時,進行加標回收率實驗。由表1可知,本方法的回收率為 96.4%-102 %,RSD 在 1.2-1.6%,測定結果與SF相吻合,表明本方法具有高的準確度,適用于血漿樣品中CV的測定。
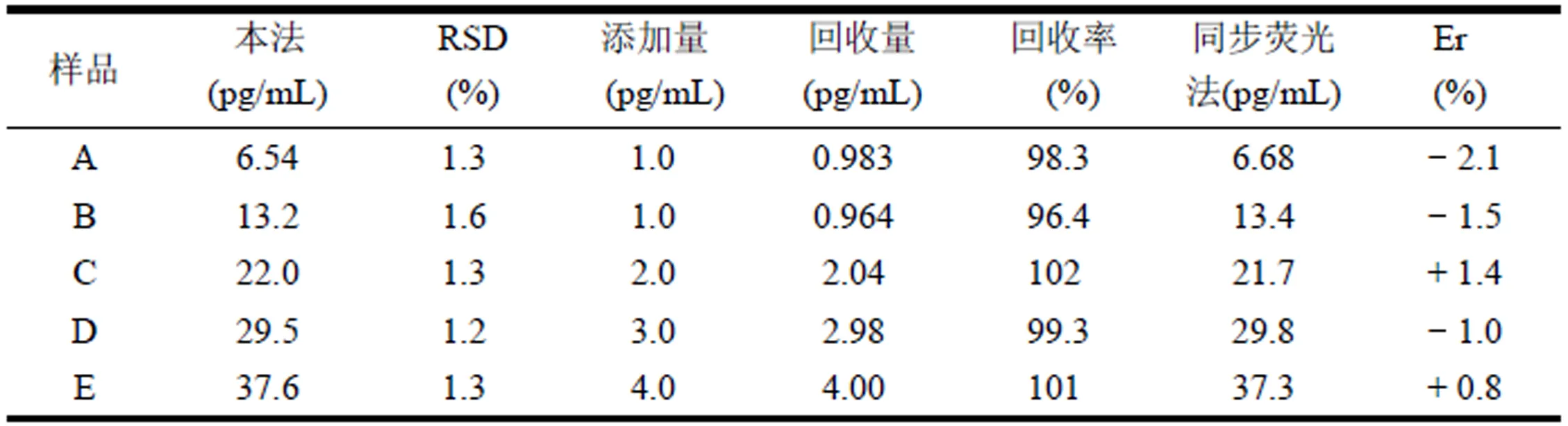
表1 分析結果(n = 6)
4 結束語
基于SDBS增敏CV活化NaClO氧化A反應而導致體系的室溫磷光劇烈猝滅的現象,提出了增敏活化SS-RTP測定CV的新方法及其反應機理。本研究發展了新的SS-RTP與CV殘留分析技術,為興奮劑的檢測提供新的方法,為提高SSRTP的靈敏度提供新的途徑。同時,為人體疾病的預警與防治提供臨床診斷依據,推動體育運動的健康發展。
[1] Eric Yang, Sherry Wang, John Kratz, et.al. Cyronak. Stereoselective analysis of carvedilol in human plasma using HPLC/MS/MS after chiral derivatization [J]. Journal of Pharmaceutical and Biomedical Analysis 2004, 36 (4) 609–615.
[2] A. Zarghi, S.M. Foroutan, A. Shafaati, et.al. Quantification of carvedilol in human plasma by liquid chromatography using fluorescence detection: Application in pharmacokinetic studies [J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 44 (3) 250–253.
[3] Maiko Machida, Masato Watanabe, Shigeru Takechi, et.al. Measurement of carvedilol in plasma by high-performance liquid chromatography with electrochemical detection [J]. Journal of Chromatography B, 2003, 798 (5) 187–191.
[4] Seung-Woon Myung, Cheon-Ho Jo. Gas chromatograph–mass spectrometric method for the determination of carvedilol and its metabolites in human urine [J]. Journal of Chromatography B, 2005, 822 (6) 70–77.
[5] Andrei Medvedovici, Florin Albu, Cristina Georgita, et.al. Achiral–chiral LC/LC–FLD coupling for determination of carvedilol in plasma samples for bioequivalence purposes [J]. Journal of Chromatography B, 2007, 850 (7) 327–335.
[6] Rau′ l A. Silva, Chien ChunWang, Liliana P. Ferna′ndez, et.al. Flow injection spectrofluorimetric determination of carvedilol mediated by micelles [J]. Talanta, 2008,76 (8) 166–171.
[7] Cherrine K. Pires, Karine L. Marques, Jo?ao L.M. Santos, et.al. Chemiluminometric determination of carvedilol in a multi-pumping flow system [J]. Talanta, 2005, 68 (3) 239–244.
[8] Jiaming Liu, Liqing Zeng, Zhiming Li, et.al. Solid substrate-room temperature phosphorimetry for the determination of residual clenbuterol hydrochloride based on the catalysis of sodium periodate oxidizing eosine Y [J]. Analytica Chimica Acta, 2009, 638 (1) 69–74.
[9] Jia-Ming Liu, Fei Gao, Wen-Yan Gao, et.al. Solid SubstrateRoom Temperature Phosphorimetry for the Determination of Trace Terbutaline Sulfate Based on Its Inhibition Oxidation of Rhodamine 6G by Sodium Periodate [J]. J Fluoresc, 2008, (4) 18:573–579.
[10] Xiaohong Shu, Ying Chen, Hongyan Yuan, et.al. H2O2Sensor based on the room-temperature phosphorescence of nano TiO2/SiO2composite [J]. Anal. Chem., 2007,(10), 3695–3702
[11] Jia-Ming Liu, Fei-Ming Li, Zhen-Bo Liu, et.al. 8-Quinolineboronic acid as a potential phosphorescent molecular switch for the determination of alpha-fetoprotein variant for the prediction of primary hepatocellular carcinoma [J]. Analytica Chimica Acta, 2010, 663 (7) 184–189.
[12] Jia-Ming Liu, Zhen-Bo Liu, Wen-Qi Li, et.al. Determination of bioactive matter by affinity adsorption solid substrate–room temperature phosphorimetry based on lectin labeled with self-ordered ring of eosin Y [J]. J Fluoresc, 2009 (9) 19:73–83.
[13] Zhi-Ming Li, Jia-Ming Liu, Zhen-Bo Liu, et.al. Preparation for nitrocellulose membrane-poly (vinyl alcohol)-ionic imprinting and its application to determine trace copper by room temperature phosphorimetry [J]. Analytica Chimica Acta, 2007,589 (7) 44–50.
[14] Jia-Ming Liu, Wen-Ting Chen, Qing-Hua Wang, et.al. Determination of trace mercury by solid substrate-room temperature phosphorimetry based on catalytic effect of Hg2+on formation of the ion association complex [Fe(bipy)3]2+·[(FinBr4)2]2-[J]. Talanta, 2004, 62(3)713-717.
[15] Jia-Ming Liu, Guo-Hui Zhu , Zhi-Ming Rao, et.al.Determination of human IgG by solid substrate room temperature phosphorescence immunoassay based on an antibody labeled with nanoparticles containing dibromofluorescein luminescent molecules [J]. Analytica Chiimica Acta, 2005, 528(1) 29-35.
[16] 顧世芬,肖宙, 代宗順, 等. HPLC-熒光法測定人血漿中卡維地洛濃度及其藥動學研究[J]. 中國藥科大學學報,2004, 35 (1) :54-56.
Determination of trace carvedilol by solid substrate-room temperature phosphorimetry
LIN Chang-qing, SUN Li-na, LIN Xun
(Department of Food and Biological Engineering, Zhangzhou Institute of Technology, Zhangzhou, 363000, China)
This work proposes a simple and sensitive solid substrate-room temperature phosphorimetry(SS-RTP) for selective determination of carvedilol (CV). The developed method is based on the sensitizing effect of sodium dodecyl benzene sulfonate (SDBS) on CV to activate the oxidation between NaClO and amaranth (A) resulting in the intense quenching of room temperature phosphorescence (RTP) of the system. Compared with non-SDBS system, the reducing value of phosphorescence intensity (Δp) with SDBS is 16.5 times higher and is directly proportional to the content of CV covering a wide range of 0.200-40.0pg mL?1, with a low detection limit (LD) of 5.1×10?14 g mL?1(sample volume: 0.40 μL). Additionally, this sensitive method has been applied to determine trace CV in human plasma, and results were analysed with synchronous fluorimetry (SF). The activation energy () and rate constant () of this activating reaction were 69.04 kJ mol?1and 3.580×10?4s?1.
Carvedilol; Amaranth; Sensitizing; Activating; Solid substrate-room temperature phosphorimetry
2012-09-20
漳州職業技術學院科技資助項目(ZZY1217)
林常青(1963-),男,福建龍海人,教授。
O629.8
A
1673-1417(2012)04-0013-05
(責任編輯:季平)

