碳化法制備高純碳酸鋰
周啟立,王莫飛
(中海油天津化工研究設計院,天津300131)
碳化法制備高純碳酸鋰
周啟立,王莫飛
(中海油天津化工研究設計院,天津300131)
以工業(yè)級碳酸鋰為原料,采用碳化法進行提純,對碳化溫度、碳化時間、碳化壓力等重要影響因素進行了實驗研究及分析,并確定了最佳反應條件。最佳工藝參數:碳化壓力為6×105~6.5×105Pa,碳化時間為2~3 h,碳化溫度為30~40℃,樹脂牌號為D110,母液流出速度為120~140 g/h,分解攪拌速度為30 r/s以上,此工藝條件下制得的碳酸鋰純度為99.991%。
碳化法;高純;碳酸鋰
1 實驗部分
1.1 原料
碳酸鋰(工業(yè)級,技術指標見表1);CO2(純度≥99.9%);離子交換樹脂(D110,D113,D152,D418)。

表1 工業(yè)級碳酸鋰產品技術指標 %
1.2 設備
不銹鋼高壓反應釜(2×106Pa,3 L);抽濾瓶;真空泵;樹脂柱;不銹鋼桶(100 L);數顯攪拌器;溫度計;電熱爐;WXY-405型原子吸收分光光度計。
1.3 實驗方法
稱取一定量的工業(yè)碳酸鋰及二次蒸餾水置于高壓反應釜。開啟攪拌,通入高純CO2并開啟夾套升溫。此時發(fā)生如下反應:
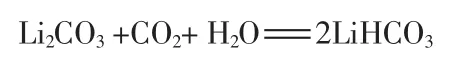
恒溫恒壓一定時間后碳化反應結束,過濾除去雜質得到濾液。濾液通過離子交換柱進行離子置換,將流出液收集。樹脂柱加入二次蒸餾水進行反洗再生。流出液經過濾后置于不銹鋼桶,開啟攪拌并加熱,控制一定溫度、一定時間后開始析出碳酸鋰晶體。此時發(fā)生如下反應:
眾人想想,還真有道理。秦鐵崖接著道:“秦某為何常常獲勝?很簡單,膽氣壯,不怕傷,不怕死。對手以為,我身在官場,慣于指手畫腳,只會讓手下當炮灰,以為我怕輸,怕負傷,怕死。嘿嘿,他想錯了,我不怕!或許諸位要說,那些亡命之徒,也不怕負傷、不怕死,怎不老打勝仗?那是不同的,亡命之徒都不是高手,真正的高手,都不是亡命之徒,本事不同,境界不同。試想想,沒有真功夫,一味死纏爛打,這叫不怕死?這叫白送死!而那些江湖高手呢,往往太珍惜名聲,怕輸,更怕受傷。一旦受傷,就算贏了,內心也長久放不下:我居然會受傷?我的功夫如此不濟?傳出去豈不是笑談?看來今后要加倍小心,盡量少出手,保全名聲要緊。”
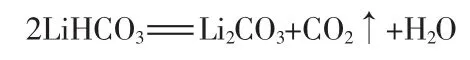
將濃縮液進行過濾,母液循環(huán)利用,濾餅即為碳酸鋰晶體,將濾餅置于干燥箱控制一定溫度干燥若干小時即得到高純碳酸鋰。
2 結果與討論
2.1 碳化條件的選擇
碳化條件影響著碳酸鋰的轉化率以及產品中的重金屬含量。
2.1.1 碳化壓力的選擇
固定溶劑(二次蒸餾水)質量為1 300 g,工業(yè)級碳酸鋰80 g,碳化溫度為40℃,碳化時間為2 h,得到碳酸鋰的溶解量隨壓力變化的曲線,見圖1。由圖1可知:當壓力為7.5×105Pa,碳酸鋰的溶解量最大。
同樣條件下,各母液中重金屬含量(以Fe為例,下同)檢測結果見圖2。由圖2可知:壓力在4.5×105~6.5×105Pa時,母液中鐵離子含量相對較小。
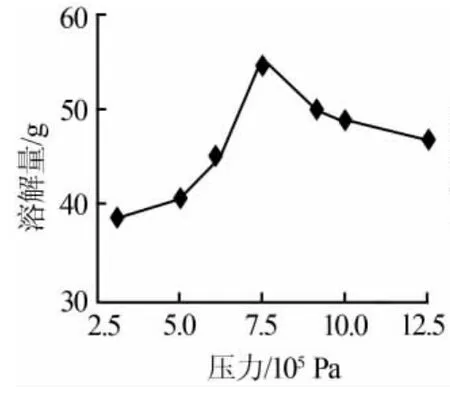
圖1 碳酸鋰的溶解量隨壓力變化曲線
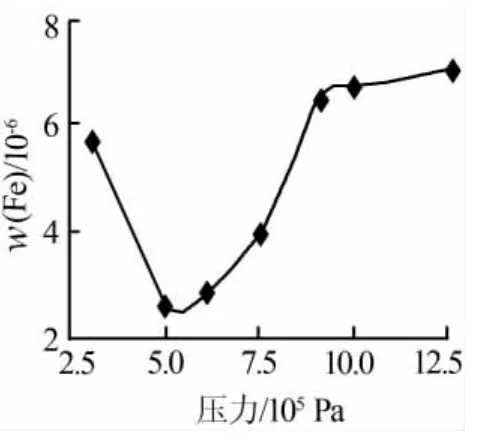
圖2 母液中Fe含量 隨壓力變化曲線
2.1.2 碳化時間的選擇
固定溶劑(二次蒸餾水)質量為1 300 g,工業(yè)級碳酸鋰80g,碳化溫度為40℃,碳化壓力為6×105Pa,得到碳酸鋰的溶解量隨時間變化的曲線,見圖3。由圖3可知:碳酸鋰的溶解量隨著時間的延長呈現(xiàn)上漲趨勢,但2 h后碳酸鋰的溶解量變化不是很明顯。因此,最佳碳化時間為2~3 h。
同樣條件下,各母液中重金屬Fe含量隨時間的變化見圖4。由圖4可知:碳化2 h后,隨時間延長母液中鐵離子含量變化不大,均在3×10-6以下。
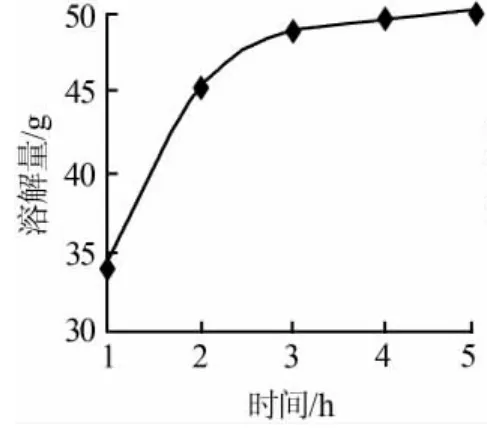
圖3 碳酸鋰的溶解量隨時間變化曲線
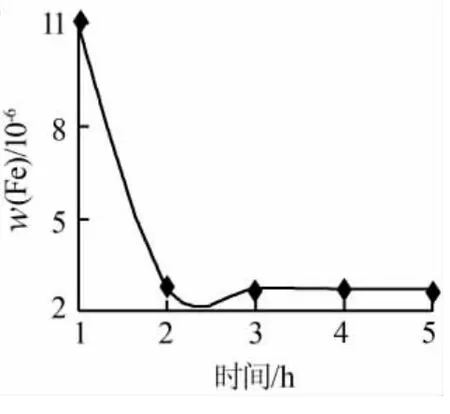
圖4 母液中Fe含量 隨時間變化曲線
2.1.3 碳化溫度的選擇
固定溶劑(二次蒸餾水)質量為1 300 g,工業(yè)級碳酸鋰80 g,碳化時間為2 h,碳化壓力為6×105Pa,得到碳酸鋰的溶解量隨溫度變化的曲線,見圖5。由圖5可知:碳酸鋰的溶解量隨著溫度的升高呈現(xiàn)上升趨勢,但40℃后碳酸鋰的溶解量變化較小。因此,最佳碳化溫度為40℃左右。
同樣條件下,各母液中重金屬Fe含量隨溫度的變化見圖6。由圖6可知:母液中的Fe含量隨碳化溫度的上升呈現(xiàn)下降趨勢,溫度超過30℃后,母液中鐵離子含量變化不大,均在3×10-6以下。
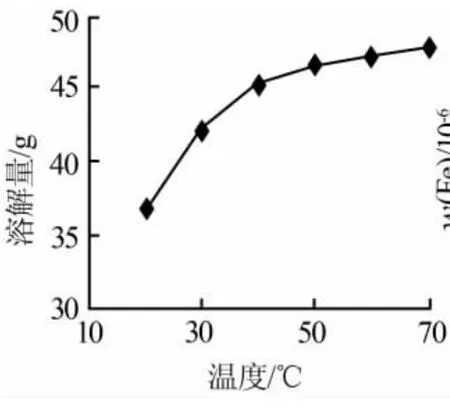
圖5 碳酸鋰的溶解量隨溫度變化曲線
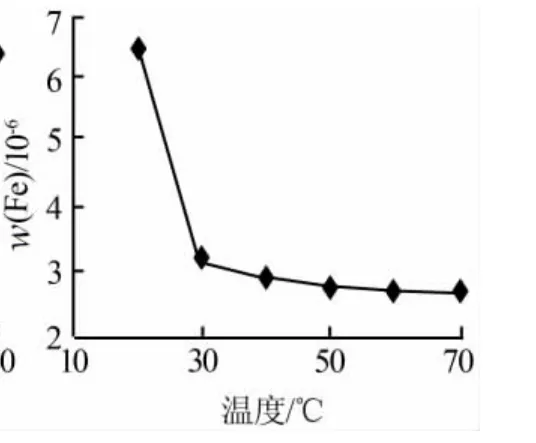
圖6 母液中Fe含量 隨溫度變化曲線
通過上述實驗研究,確定最佳碳化條件為:碳化壓力為6×105~6.5×105Pa,碳化時間為2~3 h,碳化溫度為30~40℃。
2.2 堿金屬離子去除條件的選擇
根據楊卉芃等[2]對碳化液離子交換法提純二次鋰的研究報告,筆者采用4種不同型號的樹脂(D110,D113,D152,D418)分別對母液進行處理,以去除母液中的堿金屬離子。
分別取樹脂各500 g,按陽離子交換樹脂的處理方法處理后裝入聚乙烯做成的離子交換柱中(長2 m、φ6 cm)。取相同母液,分別通過不同的樹脂柱。控制母液流出速度在120~140 g/h,流出液中Na、K、Ca、Mg含量見表2。從表2可以看出,D110樹脂的離子交換能力最強。實驗發(fā)現(xiàn),母液的流速對樹脂的交換容量影響也很大,具體數據有待進一步實驗研究。

表2 通過不同樹脂柱后流出液中堿金屬離子含量
2.3 產品的獲得及提高鋰回收率的途徑
將經過離子交換柱后的流出液,在不銹鋼桶內加熱蒸發(fā),這時碳酸氫鋰分解,過濾后,母液循環(huán)再利用,將濾餅干燥得到產品。需注意的是LiHCO3分解過程中若攪拌強度不夠,粘壁現(xiàn)象將十分嚴重,而且分解劇烈并放出大量的CO2氣體。根據數顯攪拌器顯示,當Li2CO3晶體開始析出時,攪拌器轉速應保持在30 r/s以上才不至于發(fā)生粘壁現(xiàn)象。
美國、日本的專利記載,采用碳化法最終Li2CO3產品的純度可達99.99%,回收率在90%以上[3],其中鈣質量分數低于1.3×10-5,鎂質量分數在4×10-7以下[4]。筆者采用碳化法制得5批產品,Li2CO3質量分數均大于99.991%。
3 結論
實驗結果表明,采用碳化法制備高純碳酸鋰工藝可行,通過實驗得到的最佳工藝參數:碳化壓力為6×105~6.5×105Pa,碳化時間為2~3 h,碳化溫度為30~40℃,樹脂牌號為D110,母液流出速度為120~140 g/h,分解攪拌速度為30 r/s以上,此工藝條件下制得的碳酸鋰純度為99.991%。
[1] 戴志鋒,肖小玲,李法強,等.高純碳酸鋰的制取方法探討[J].鹽湖研究,2005(2):52-59.
[2] 楊卉芃,李琦,曹躍華,等.離子交換法提純二次鋰[J].中國資源綜合利用,2002(5):22-25.
[3] Kamyab Amouzegar,Guy St Amant,Stephen Harrison.Process for the purification of lithium carbonate:US,6048507[P].2000-04-11.
[4] Shiro Harafuji,Nobuyuki Yamazaki.High-purity lithium carbonate and production thereof:JP,62252315[P].1987-11-04.
聯(lián)系方式:zhouql2@cnooc.com.cn
Preparation of high purity lithium carbonate by carbonization method
Zhou Qili,Wang Mofei
(CNOOC Tianjin Chemical Research&Design Institute,Tianjin 300131,China)
Carbonization method was adopted for purification of industrial lithium carbonate.The key influencing factors,such as carbonization temperature,carbonization time,and carbonization pressure,were experimentally studied and analyzed.The optimum reaction conditions were confirmed as follows:carbonization pressure was 6×105~6.5×105Pa,carbonization time was 2~3 h,carbonization temperature was 30~40℃,brand of resin was D110,flow rate of mother liquor was 120~140 g/h,and mixing speed was over 30 r/s.Under such conditions the purity of prepared lithium carbonate could reach 99.991%.
carbonization method;high purity;lithium carbonate
TQ131.11
:A
:1006-4990(2012)07-0036-02
2012-03-09
周啟立(1980—),男,大學本科,工程師,從事生產管理工作,已發(fā)表論文7篇。

