高血壓(5)頑固性高血壓的評估及治療進展(續完)
孫寧玲,姚丹
高血壓的控制一直是目前關注的重要問題。血壓的控制不良將會導致器官損害和臨床心腦血管事件。由于高血壓患者基數龐大所以難治性高血壓在臨床很常見,約占高血壓的20% ~30%,也是臨床工作中比較棘手的問題。了解頑固性高血壓的病因以及診斷流程和治療規范,是提高血壓達標率的關鍵。
1 定義
頑固性高血壓(resistant hypertension,RH)又稱難治性高血壓或高血壓的抵抗,是指在使用包括一種利尿劑在內的、足夠劑量而且搭配合理的3種或3種以上降壓藥物,血壓仍不能控制在140/90mm-Hg(1mmHg=0.133 kPa)以下。對于糖尿病和腎臟疾病(肌酐>1.5mg/dl或24 h尿蛋白排泄>300mg)血壓未能降至130/80mmHg以下,對于老年單純收縮期高血壓,其收縮壓仍未能降至160mmHg以下者。而新近診斷為高血壓或尚未接受降壓治療的高血壓患者,不論其血壓水平有多高,都不包括在本定義中。
2 頑固性高血壓病因及常規治療方法
確定高血壓干預手段,是基于明確的血壓診斷,因此確定是否存在頑固性高血壓的第一步,是需要排除由于白大衣效應所導致的假性頑固性高血壓。24小時動態血壓檢測(ABPM)對于診斷白大衣性高血壓是十分關鍵的。
在病因方面:高鹽和高酒精攝入、肥胖以及睡眠呼吸暫停、原發性醛固酮增多癥和腎血管性高血壓等繼發性高血壓在內的多因素均可以促進頑固性高血壓的發生。
2.1 基于大規模人群的研究提示:飲食中鹽的攝入與高血壓呈線性關系。過多的鹽攝入會使血管緊張素轉換酶抑制劑(ACEI)類藥物的效果減弱,因此,對頑固性高血壓患者強烈建議應嚴格限制飲食中鈉的攝入。
2.2 研究顯示:體重每增加10%,收縮壓則可升高6.5mmHg。Framingham的研究提示,肥胖與頑固性高血壓有關,其中的可能機制包括了:睡眠呼吸暫停、交感神經系統的激活(心臟和腎臟交感活性增加)、腎素血管緊張素系統的異常、脂肪組織的直接效應等。因此,所有超重的頑固性高血壓都應建議減輕體重。
2.3 在頑固性高血壓患者有呼吸暫停指數(AHI)>5的人群中發生阻塞性睡眠呼吸暫停(OSA)占76.5%。其中,中、重度OSA占53.7%。頑固性高血壓AHI>20時的中、重度OSA,男性8年后的死亡率約為40%。對這類患者采用輔助呼吸治療(cPAP)則可較好的控制血壓以及減少死亡率。
2.4 在繼發性高血壓中以原發性醛固酮增多癥、腎血管性高血壓是最常見的原因。既往低血鉀被認為是診斷原發性醛固酮增多癥的首要條件,但目前發現很多患者的血鉀并不低,因此對于低腎素的頑固性高血壓患者,必須進行醛固酮水平的篩查,高醛固酮、低腎素以及影像學支持原醛的頑固性高血壓對外科手術和醛固酮拮抗劑藥物治療將會獲得頑固性高血壓的血壓控制。對有腎血管疾病的頑固性高血壓,血管再通對腎功能有保護作用,但對血壓的控制是有限的。
3 頑固性高血壓治療的關注點
3.1 需要進行有效的臨床評估:2008年美國高血壓研究專業教育委員會(ASH)和美國心臟病協會(AHA)發布的首個頑固性高血壓診斷、評估和治療的科學聲明,其中指出:對頑固性高血壓首先要進行臨床評估,而臨床評估的目的是明確是否為真正的難治性高血壓;和明確靶器官損害狀況。評估的內容包括:①評估診療史;②評估生活模式;③評估正確測量血壓的方法;④體格檢查的評估;⑤實驗室檢查的評估;⑦常規代謝指標測定、尿液分析、同步清晨血漿醛固酮及腎素活性的測量;⑧治療依從性評估。
3.2 多因素治療:最大限度提高患者的依從性:新指南在治療建議中又根據頑固性高血壓的病因強調了多因素治療,并重點提到了“鹽皮質激素受體拮抗劑的臨床應用”。①科學聲明提到應用以下多種方法來提高患者的依從性:處方盡量簡單,可選擇長效藥物;增加隨訪的頻率;建議患者記錄自己血壓的變化;包括護士、藥師、營養師在內的梯隊治療。②在限制食鹽的攝入方面效果:科學聲明指出,限制食鹽對非洲后裔以及老年人效果更好。同時給出的限制的食鹽量為每24小時總的鈉離子小于100mmol/L。并非常明確地指出,若僅用食鹽(氯化鈉)來算,每天小于5.855 g;另外提出在計算鈉離子來源時不能僅限于食鹽(氯化鈉),還要考慮到食物中的其他鈉離子來源,例如小蘇打(碳酸氫鈉)。并提倡DASH(dietary approaches to stop hypertensionor DASH diet)飲食。通過DASH飲食平均可以降低血壓11.4/5.5(mmHg)。DASH飲食是一種富含低脂奶、高鉀、高鎂、高鈣、低飽和脂肪酸的飲食。③控制飲酒方面:科學聲明提出控制飲酒的量為每天要小于2個單位的酒(約1盎司乙醇),即24盎司的啤酒、10盎司的葡萄酒和3盎司的40度烈酒。而對于女性則以上均減半。
3.3 藥物治療方案:以聯合治療方案為主,提出對已經應用3種降壓藥物的頑固性高血壓患者[ACEI或者血管緊張素受體拮抗劑(ARB)、鈣離子通道阻滯劑(CCB)和噻嗪類利尿劑]加用小劑量醛固酮拮抗劑(螺內酯最大劑量<50mg/d)可使頑固性高血壓患者從中獲益。對夜間血壓增高的患者,在科學申明指出可在睡前服用至少一種降壓藥,較好的藥物為RAS抑制劑(ACEI或ARB)。
4 頑固性高血壓新的藥物研發以及治療技術
4.1 新的研究藥物:近年在高血壓治療中發現了一些新藥,這些藥有的還處于研究中,有些已進入臨床應用的早期,但其療效和安全性還需更多的循證醫學證實。這些藥物在頑固性高血壓的輔助治療中可能會發揮一定的作用。現將藥物作一簡單介紹:
4.1.1 內皮素靶向治療:內皮素1是一種強力的內源性血管收縮劑,對血管以及其他器官有增生、炎癥和纖維化作用。內皮素A、B受體的激活可導致不同甚至相反的結果,有助于調節血管彈性和血壓。研究顯示,選擇性和雙重內皮素受體拮抗劑均降低健康人和高血壓患者的血壓,同時可能改善內皮功能,減輕炎性纖維化和逆轉血管重構,選擇性內皮素A受體的阻滯可產生額外的腎保護作用。選擇性內皮素A受體拮抗劑達盧生坦是一種強力的血管擴張劑,對頑固性高血壓患者可能是一種新的治療藥物。臨床研究結果顯示ET1受體拮抗劑(達盧生坦)對平均收縮壓和平均舒張壓的降低水平呈劑量依賴性。ET1受體拮抗劑更適合于肺動脈高壓的患者,但達盧生坦最常見的不良事件是輕度到中度的液體潴留和水腫,部分患者出現心力衰竭。其安全性的評估還有待于完善。
4.1.2 醛固酮合成酶抑制劑,可降低血中醛固酮的水平,從而達到降壓的作用。例如LCI 699。
4.1.3 LCZ696是一種新型的雙重作用的降壓藥物。作用一是阻斷AT1受體,另一作用為抑制腦啡肽酶,由于對多部位的阻滯,而達到較好的血壓降低的療效。研究表明:LCZ696與纈沙坦相比,LCZ696能更安全有效的降低血壓,無明顯副作用。
4.2 新的治療方法
4.2.1 經皮導管腎臟交感神經去除術:2009年,Krum教授首先報道了采用經皮導管腎臟交感神經射頻消融技術來治療頑固性高血壓的新技術,并于2009年報道的第一篇文章(Simplicity HTN-1.lancet,2009,373:1275-1260.),試驗選擇性非隨機入組了45例頑固性高血壓患者,這些患者平均使用4.7種降壓藥而收縮壓仍≥160mmHg,平均基線血壓177/101mmHg,在45例患者中,前10例先進行單側,1個月后再行另一側腎動脈的射頻消融治療;后35例一次完成雙側腎動脈交感神經消融,平均手術時間為38 min,手術后建議患者繼續服用原有降壓藥物。消融后隨訪一年。結果顯示,與基線水平相比,腎臟去交感神經治療后1、3、6、9及12個月診室血壓平均下降分別為14/10mmHg、21/10mmHg 、22/11mmHg 、24/11mmHg和27/17mmHg。10例患者在射頻治療前和后15~30天時測定雙側腎臟交感神經的去甲腎上腺素排出量,結果顯示腎動脈交感消融后去甲腎上腺素的排出量平均降低47%(95%可信區間為28% ~65%),進一步證實了射頻消融治療對腎臟交感傳出神經的去神經效應。在安全性評估中發現,45例患者僅1例出現腎動脈夾層,經腎動脈支架處理后無后遺癥,1例股動脈假性動脈瘤,壓迫后減小無任何后遺癥。其余43例無并發癥,術后14~30 d 18例患者行腎動脈造影檢查,未發現動脈狹窄或其他異常。此研究顯示:經皮導管腎臟交感神經去除術方法操作簡單安全,并發癥較少,能顯著和持久地降低頑固性高血壓患者的血壓,為治療頑固性高血壓開辟了新的途徑。但由于HTN-1只是一項觀察確證性研究,病例數量少、無對照組、缺乏對安全性的長期隨訪,并且有6例患者(13%)治療后血壓下降不足10mmHg,因此還需要隨機對照研究試驗加以肯定。基于此隨后進行的Simplicity HTN-2則采用了隨機對照的方式開展頑固性高血壓的腎交感神經射頻消融的研究(Lancet,2010,376.)此研究在歐洲、加拿大等24個中心參加,進入190例患者,經過篩查合格入選106例頑固性高血壓的患者,1∶1的隨機對照,治療組52例,對照組54例,進行為期2年的隨訪,在6個月的時候曾有81例患者進行了CTA的隨訪觀察。希望通過這種RCT研究對頑固性高血壓的交感神經射頻消融的治療技術進行評價,并獲得新的頑固性高血壓的治療方法的確認。最近一項來自澳大利亞、歐洲和美國等19個中心臨床研究入選153例患者,基線平均診室血壓為176/98±17/15(mmHg),平均使用5種降壓藥物,腎小球率過濾為 83±20[ml/(min·1.73 m2)]射頻消融手術平均時間為38 min,97%患者(149/153)無手術相關并發癥,僅4例出現術后并發癥,其中3例腹股溝假性動脈瘤,1例腎動脈夾層,處理后均無后遺癥。術后1、3、6、12、18、24 個月血壓分別下降 20/10、24/11、25/11、23/11、26/14、32/14(mmHg)。該研究說明,頑固性高血壓患者,經皮導管腎臟交感神經去除術后2年或更長的時間內血壓可平穩降低,無明顯不良事件發生。此外,多項關于經皮導管腎臟交感神經去除術治療頑固性高血壓的臨床研究已經開展,以便更好的為這項新技術的應用找到更多的臨床證據。
4.2.2 頸動脈竇壓力反射激活療法:激活人體減壓反射來治療頑固性高血壓是通過介入的方法刺激頸動脈的壓力感受器從而降低血壓的一種新方法。壓力感受器反射又稱為減壓反射。減壓反射的調節作用主要發生在動脈血壓迅速變化時,而高血壓患者血壓持續升高時減壓反射不能提供有效防護。在這樣的理論基礎下,“Rheos高血壓治療系統”的裝置研發成功,并用于臨床頑固性高血壓的治療。該系統的組成包括一個埋藏于鎖骨下方皮下組織的小型脈沖發生器(與心臟起搏器類似)、兩根植于左、右頸動脈的電極導線和一個體外的程控裝置(圖1)。當對頸動脈壓力感受器進行電刺激后,由于交感神經受到抑制,通過減慢心率、擴張血管和利尿作用等作用從而使血壓下降。Rheos系統有兩個優點:①通過激活患者自身的血壓調節系統來降低血壓。②患者在醫生指導下學會使用程控裝置后,可以個體化地調節降壓過程及降壓幅度。目前在美國和歐洲各有一項評價Rheos系統可行性的小規模的臨床試驗(美國Rheos系統可行性試驗以及歐洲DEBuT-HT試驗)所入選頑固性高血壓患者,均行手術置入Rheos系統,1個月后啟動刺激,1年后均顯示持續的降壓效果。在ACC大會上報告的這兩項試驗合并的中期分析結果:38例頑固性高血壓患者,平均使用5.1種降壓藥物的情況下收縮壓仍≥160mmHg,基線平均血壓183/105mmHg。植入Rheos系統2年后,收縮壓和舒張壓分別平均下降22、15mmHg(均P<0.001);22例頑固性高血壓患者,植入Rheos系統3年,收縮壓和舒張壓分別下降31和21mmHg(均P<0.001)。降壓效果從第1年持續到第3年,甚至在第3年的效果更明顯。最近歐洲一項前瞻性、非隨機、關于Rheos系統可行性試驗入選45例高血壓患者,平均血壓179/105mmHg,平均服用5種降壓藥,經頸動脈竇壓力反射激活療法治療3個月,平均血壓降低21/12mmHg,17例患者完成兩年隨訪,血壓平均降低33/22mmHg,試驗表明:這種治療方法能為頑固性高血壓患者提供一個安全、個性化的治療方案。
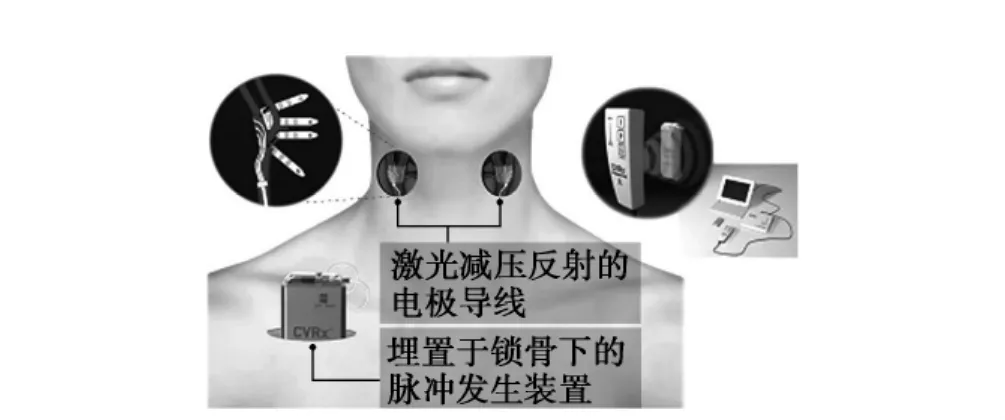
圖1 Rheos系統示意圖
此項技術的特點是通過自身生理的血壓調節系統控制血壓,降壓效果好,容易實現個體化降壓治療,為頑固性高血壓患者提供了一種新的治療選擇。但鑒于該系統埋藏于鎖骨下方皮下組織,而此處肌肉組織比較薄弱,較難固定。當頸部轉動可使埋藏裝置移動,這種現象是否可以影響對頸動脈壓力感受器刺激的定位,從而影響治療的效果,還是需要較多的臨床試驗證實。根據以上結果,美國食品藥品監督管理局(FDA)已經批準了一項多中心、隨機雙盲、以安慰劑作為對照的在頑固性高血壓患者中評價Rheos系統降壓療效的Ⅲ期臨床試驗,進一步明確此方法的安全性和有效性。

