人nm23-H1基因重組腺病毒載體的構建與鑒定*
范紅渠 周衛兵 郝魯峰 邵 磊 王智勇
nm23-H1在口腔癌中已明確為腫瘤轉移抑制基因,同時口腔癌轉移大多沿局部淋巴結發生,因此選擇對淋巴結轉移有明顯抑制作用、又可抑制腫瘤發生的nm23-H1基因具有重要的臨床意義[1],nm23-H1是進行基因治療的理想基因,因而日益受到人們的重視[2,3]。我們選擇腺病毒(adenovirus,Ad)作為基因治療的載體,運用AdEasy系統構建攜帶全長nm23-H1基因的重組腺病毒Ad-nm23-H1,為進一步研究Ad-nm23-H1腫瘤轉移抑制活性奠定了基礎。
1.材料和方法
1.1 試劑和材料 AdEasyTMAdenoviralVector System中的質粒pShuttle-CMV、pAdEasy-1及表達腺病毒E1區功能的人胚腎293細胞(Stratagene,美國);大腸桿菌菌株BJ5183、DH5α、脂質體Lipofectamine2000及含人nm23-H1 cDNA的質粒pcDNA3.1-nm23-H1(Invitrogen,美國);限制性內切酶 Sac II、Eco R I、Pac I及 Pme I(TaKaRa,日本);T4DNA連接酶、核酸分子量標準DL2000、DL15000(大連寶生物公司,中國);膠回收試劑盒、總RNA提取試劑盒及質粒小提試劑盒(上海華舜公司,中國);病毒基因組DNA提取試劑盒(上海生工公司,中國);一步法RT-PCR試劑盒(Qiagen,德國);PTC-200 型 PCR 儀(MJ,美國)。
1.2 實驗方法
1.2.1 nm23-H1基因的PCR擴增 重組質粒pcDNA3.1-nm23-H1經Sac II、Eco R I酶切后,膠回收nm23-H1基因片段。以該片段為模板,用引物Primer a和Primer b PCR擴增帶有Sac II、Eco R I酶切位點的nm23-H1片段。引物序列:Primer a(上游引物):5’-GCGTCGACATGGC TATGATGGAGGTC-3’,含有Sac II酶切位點和起始密碼子;Primer b(下游引物):5’-GCGATATCTTAGCCAACTAAAAAGGCCC-3’,含有Eco R I酶切位點和終止密碼子。
1.2.2 重組穿梭質粒 pShuttle-CMV-nm23-H1的構建 擴增出的目的基因經Sac II、Eco R I雙酶切后,T4 DNA連接酶分別連接經同樣的酶雙酶切的穿梭質粒pShuttle-CMV和nm23-H1片段,構建重組穿梭質粒pShuttleCMV-nm23-H1。轉化宿主菌大腸桿菌DH5α,篩選陽性克隆。小提質粒,用Sac II和Eco R I雙酶切鑒定陽性克隆,進一步通過DNA雙向測序確認構建無誤。
1.2.3 重組腺病毒基因組質粒pAdEasy-nm 23-H1的構建與鑒定[4]把腺病毒基因組質粒pAdEasy-1轉化大腸桿菌BJ5183,電轉化條件設置為:200Ω,215kv,25μF。篩選陽性BJ5183,制備成電轉化用的感受態細胞備用。PmeⅠ酶切pShuttle-CMV-nm23-H1重組質粒使之線性化,電泳后膠回收酶切產物,加入堿性磷酸酶去磷酸化酶處理。取100-400ng線性化的pShuttle-CMV-nm23-H1電轉化含pAdEasy-1的BJ5183感受態細胞,利用大腸桿菌的同源重組機制獲得重組腺病毒基因組質粒,然后室溫放置5-10min,直接涂布在含卡那霉素的LB平板上,次日挑取10-20個形態最小的克隆在5mL含50μg/mL卡那抗性的LB培養基中培養15h。堿裂解法小提質粒,PCR及Pac I酶切鑒定,陽性重組子命名為pAdEasy-nm23-H1。將鑒定正確的腺病毒重組質粒再次轉化E.coli DH5α感受態細胞,以大量擴增重組腺病毒基因組質粒。
1.2.4 重組腺病毒的包裝及大量擴增 用含10%胎牛血清和200U/ml青霉素、250U/ml鏈霉素的DMEM培養液培養293細胞,轉染前一天用無血清無雙抗DMEM培養,豐度達70%時用Lipofectamine2000陽離子脂質體將重組腺病毒載體pAdEasy-nm23-H1轉染入293細胞,置37℃5%CO2培養箱內培養。轉染后14d用首次收集的病毒上清再次感染293細胞進行擴增,以相同的凍融法收集病毒上清,用0.22μm濾膜過濾后分裝于2ml凍存管,-80℃保存。
1.2.5 病毒滴度測定 應用TCID50法測病毒感染性滴度[5]:在96孔板中培養293細胞至長成單層,分別加人不同稀釋度病毒液,每個稀釋度做8個復孔,設立3個空白對照,每天觀察至不再出現CPE為止,TCID50法計算病毒滴度。
1.2.6 病毒擴增后重組腺病毒基因組PCR鑒定 裂解重組腺病毒傳代感染的293細胞,提取腺病毒基因組DNA作為模板,PCR分析經傳代后外源基因插入腺病毒基因組中的情況,所用的引物為pShuttle-CMV通用引物:Forward:5’-GG TCTATATAAGCAGAGCTG-3’, Reverse:5’-GTGGTATGGCTGATTATGATCAG-3’。用未線性化的腺病毒基因組質粒AdEasy-1轉染293,并模擬重組病毒傳代相同次數,提取DNA作為PCR陰性對照模板。
1.2.7 RT-PCR檢測nm23-H1基因在293細胞中的表達 取兩只T-25培養瓶的293細胞,待80%鋪滿時,分別接種重組腺病毒和空腺病毒,按試劑盒說明分別抽取細胞總RNA。以Qiagen一步法RT-PCR反應體系要求配制反應液,反應結束后取5μ L進行1%的瓊脂糖凝膠電泳,檢測條帶大小。
2.結果
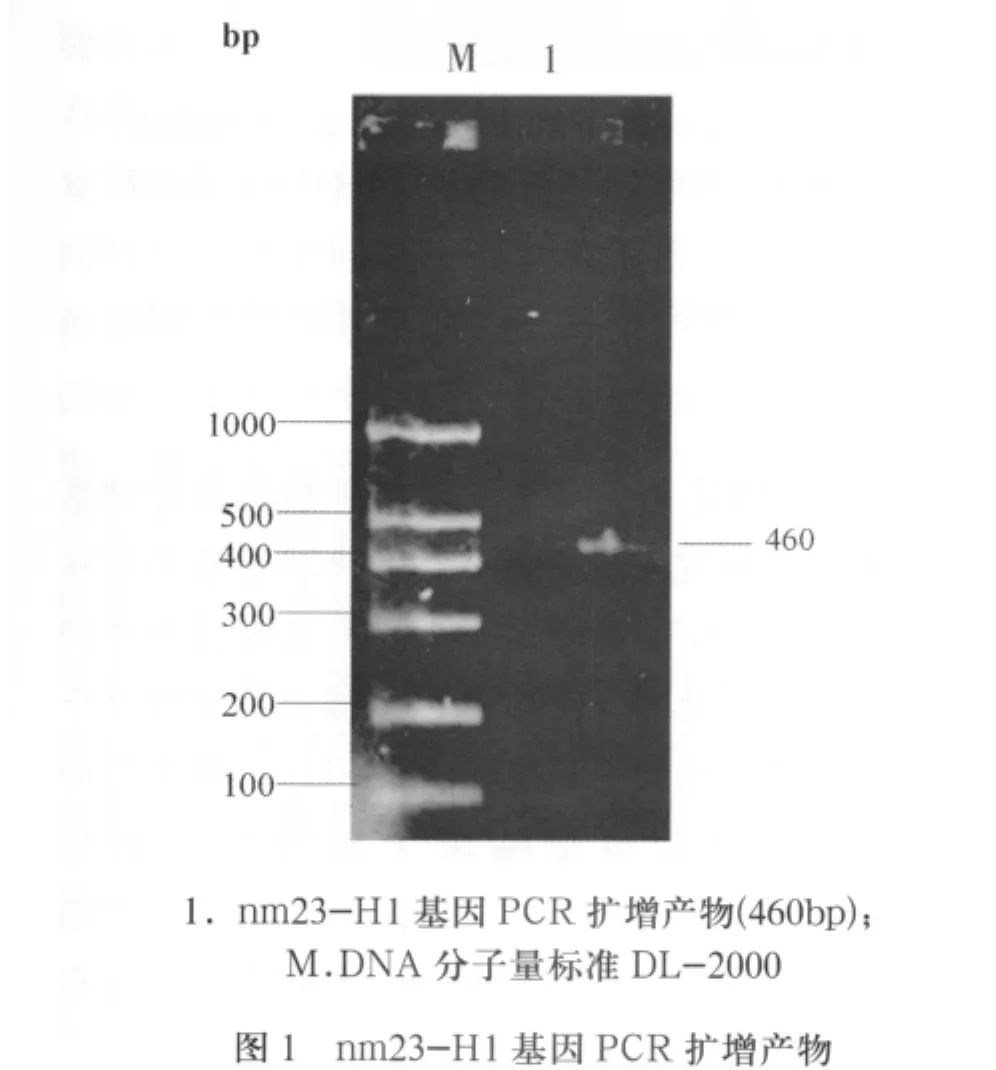
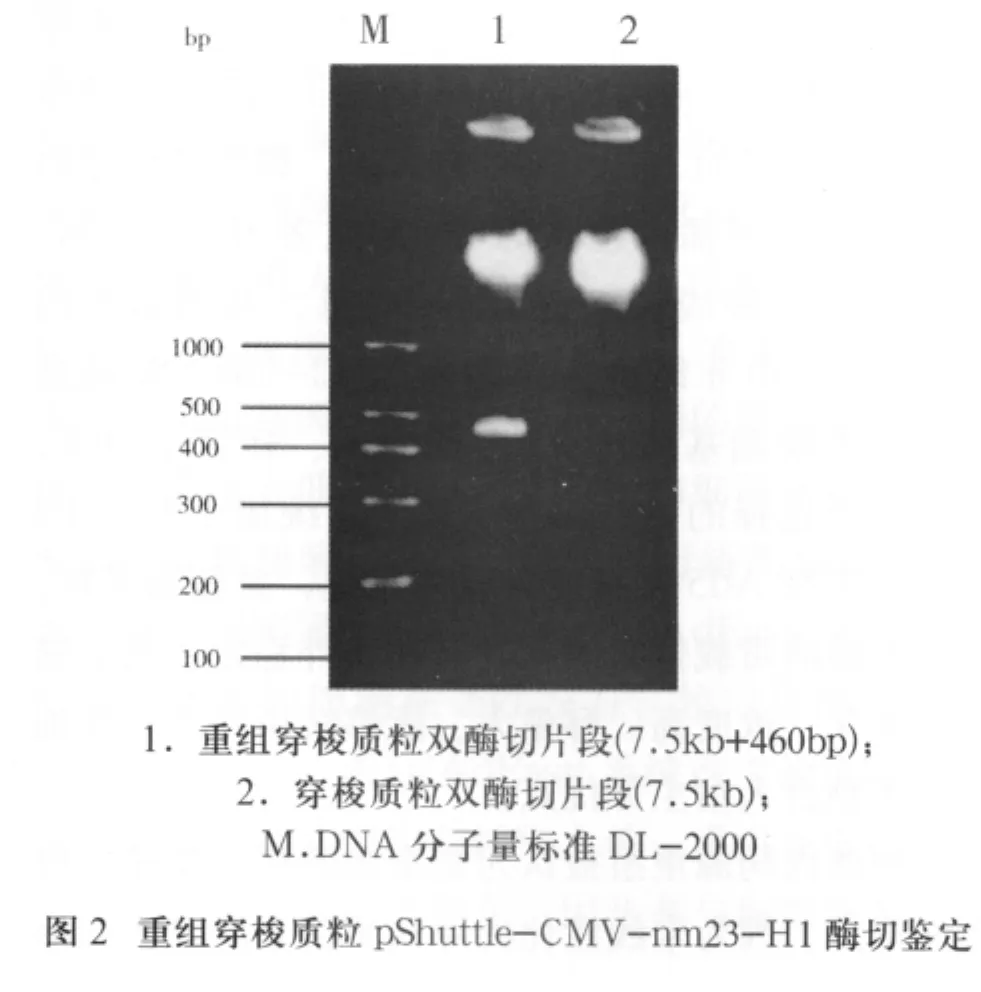
2.1 nm23-H1基因克隆與重組穿梭質粒構建及鑒定 重組質粒pcDNA3.1-nm23-H1經Sac II、 Eco R I酶切后,利用帶有酶切位點的引物經PCR擴增出一條大小約460bp的條帶,電泳結果與預期相符(圖1)。重組穿梭質粒pShuttle-CMV-nm23-H1酶切后出現大小為7.5kb和460bp的兩個條帶,而單純的穿梭質粒只有一條7.5kb的條帶(圖2)。測序發現條帶大小460bp的核苷酸序列與Genebank上nm23-H1 cDNA(BC000293)序列完全一致,且插入方向正確。
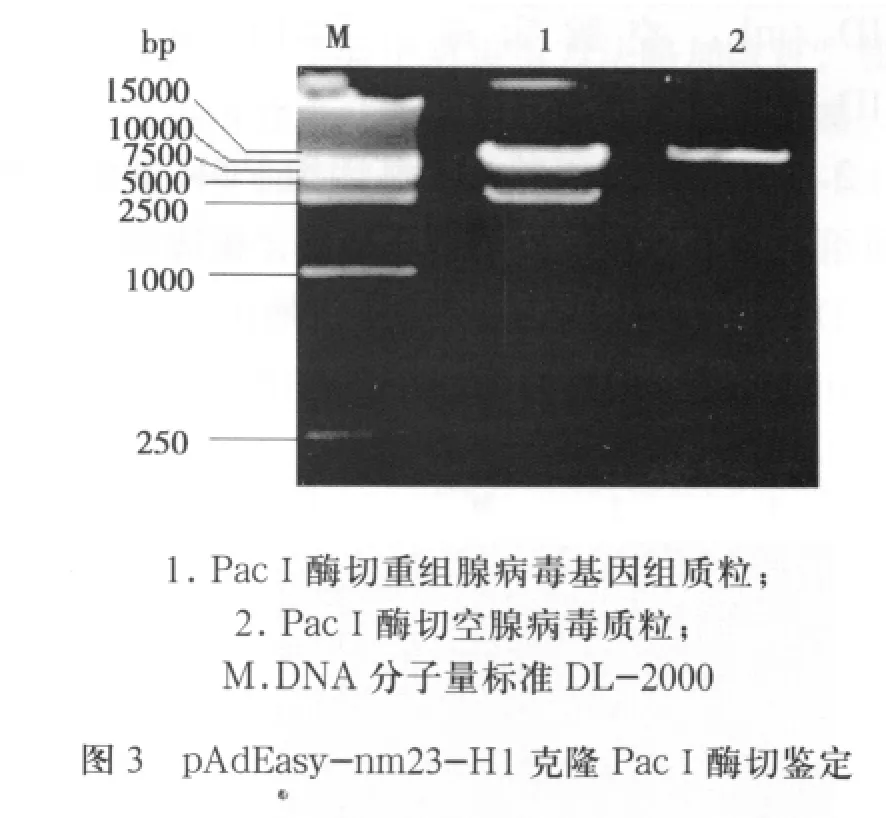
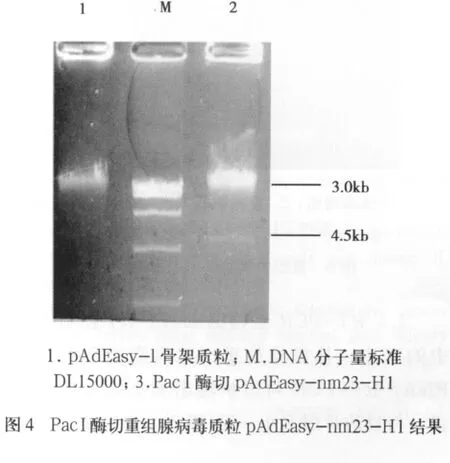
2.2 重組腺病毒基因組質粒的構建及鑒定 重組穿梭質粒pShuttle-CMV-nm23-H1經Pme I線形化,然后轉染含pAdEasy-1的大腸桿菌BJ5183,通過細菌內同源重組產生重組腺病毒基因組質粒pAdEasy-nm23-H1。以Pac I酶切鑒定候選重組子,瓊脂糖凝膠電泳后經酶切可獲得穿梭質粒所特有的長度為3.0 kb的片段(圖3)。腺病毒穿梭質粒pShuttle-CMV與骨架質粒pAdEasy-1都各有Pac I酶切位點,經過Pac I酶切就能得到一大(30kb)和一小3.0kb(重組發生在骨架質粒右臂和左臂)或4.5kb(重組發生在骨架質粒右臂和復制起點區)兩個片段(圖4)。以重組腺病毒基因組質粒pAdEasy-nm23-H1為模板,經PCR擴增得到約460bp的條帶,與目的片段大小一致,而空腺病毒基因組質粒不能擴出相應條帶(圖5)。
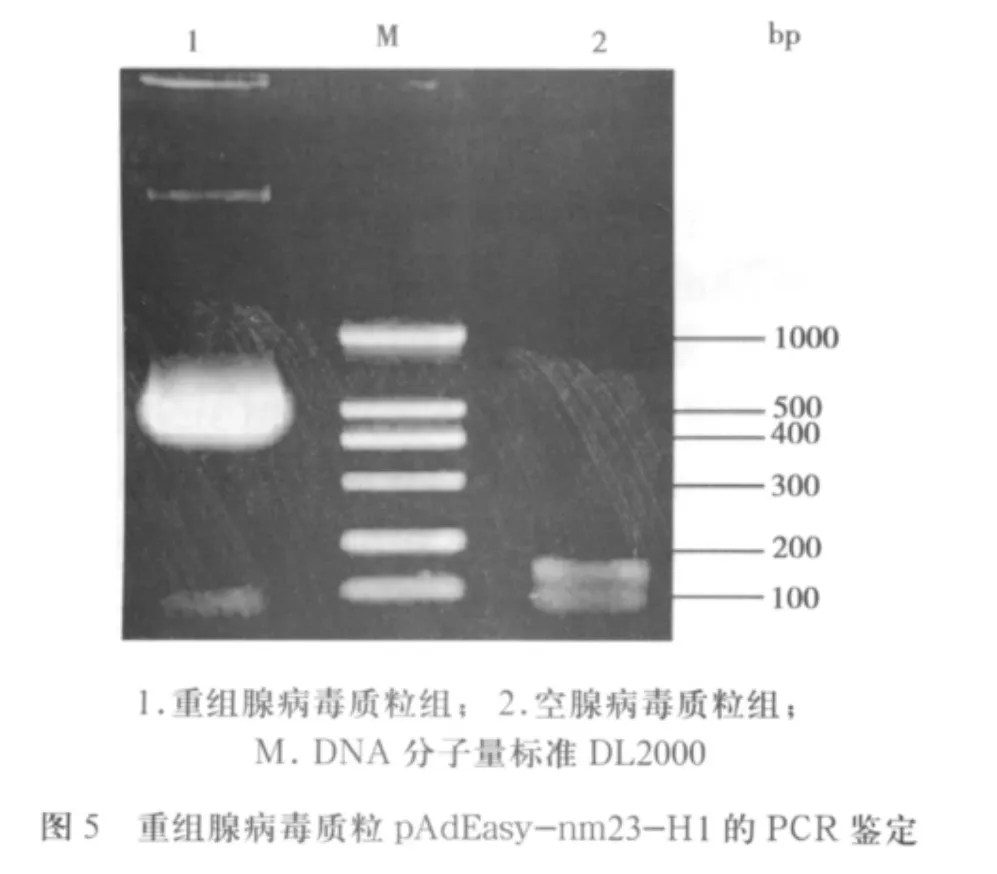
2.3 重組腺病毒滴度測定TCID50法測病毒感染性滴度:重組腺病毒:T=109.5(3.4×109)TCID50/mL;空腺病毒:T=109.3(1.9×109)TCID50/mL
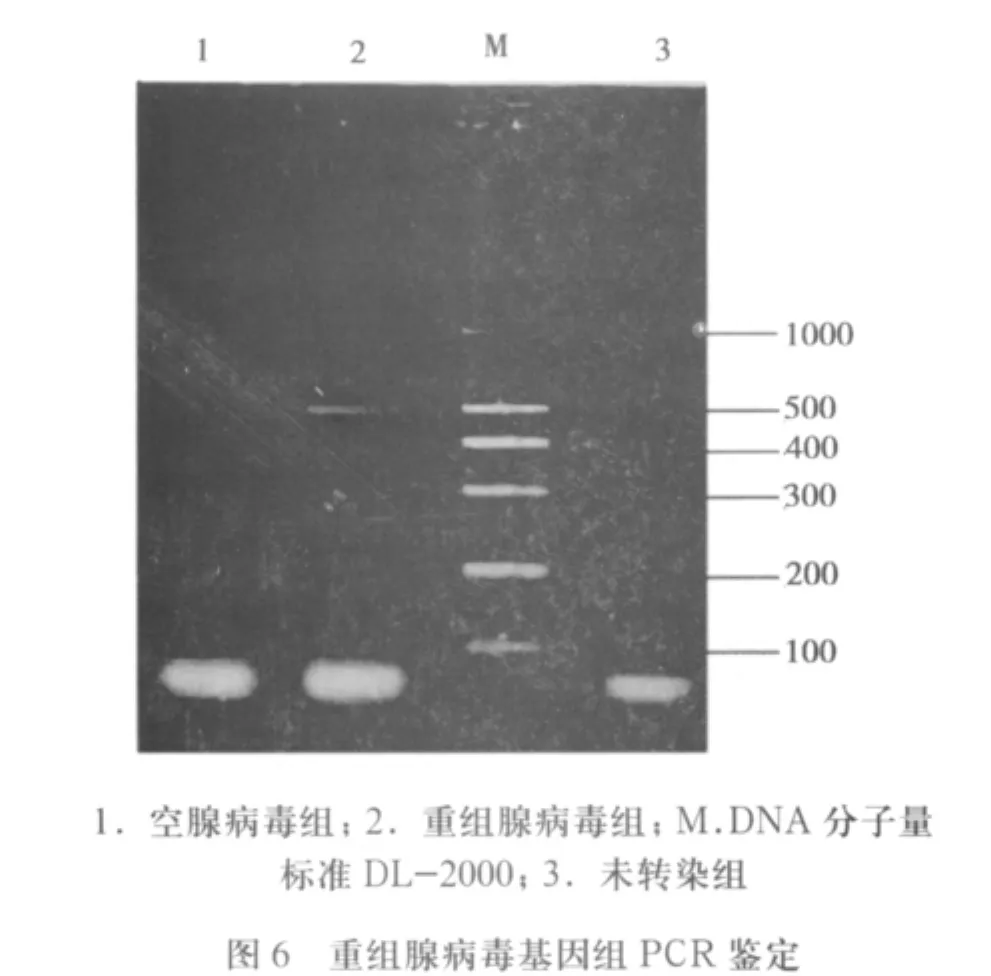
2.4 擴增后重組腺病毒基因組PCR鑒定 裂解重組腺病毒傳代感染的293細胞,提取腺病毒基因組DNA為模板,通過PCR擴增出與目的基因大小nm23-H1相當的460bp條帶(圖6)。
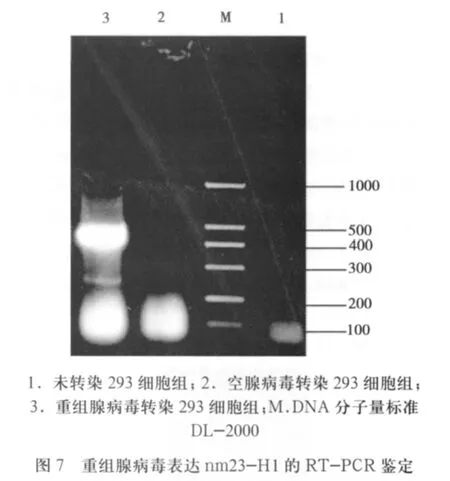
2.5 RT-PCR法檢測nm23-H1在293細胞中的表達 抽提感染重組腺病毒的293細胞總RNA,RT-PCR可以擴增出大小約460bp的片段,與目的片段大小一致(圖7),而感染空腺病毒的細胞不能擴增出相應條帶。
3.討論
nm23基因是第一個被發現的腫瘤轉移抑制基因,多數學者研究發現,其表達與多種腫瘤的轉移成負相關[6-8]。nm23基因是一個具有高度同源性的保守基因家族,迄今nm23基因家族已經發現9個成員,分別為nm23-H1至nm23-H9,其中與腫瘤關系最為密切也是臨床上研究最多的是nm23-H1[6]。如何實現目的基因nm23-H1的穩定、高效和安全的表達是當前研究癌轉移以及將nm23-H1用于基因治療前提和基礎。
基因轉移(Gene transfer)指借助于載體(Vertor)將目的基因轉移至靶細胞的過程[7]。載體則是基因轉移的工具。某種意義上,載體是構建的含有治療基因插入位點的DNA或者RNA序列。腺病毒是一種線性雙鏈DNA病毒,基因組長約30-50kb,由非結構性早期基因(El-E4)、編碼結構蛋白的晚期基因和RNA聚合酶、轉錄子組成。本研究所選擇的AdEasy-1載體系統屬于E1、E3區雙缺失型Ad5型腺病毒載體系統,是較為成熟、高效的腺病毒載體系統,具有在體外穩定、易于制備、純化、濃度高、容量大、能夠轉染終末分化細胞并不整合入宿主等優點。
細菌內同源重組被認為是重組腺病毒構建過程中的難點,因為未線性化的環狀質粒之間發生同源重組的幾率非常低,所以重組轉移載體必須用PmeI線性化。實驗發現,即使按操作手冊的方法,重組效率仍然不高,因此有必要將原細菌內同源重組方法作進一步改進。研究表明,把原方案中的一步共轉化分成兩步完成,即先把一個質粒轉化進入BJ5183,然后轉化第二個質粒,可以大大提高重組效率。用改進后的方法進行實驗,在一次操作中能夠獲得幾十個重組子,而且出現了預期的兩種同源重組類型,即通過腺病毒序列同源重組和質粒復制起點同源重組。
從重組所借助的同源序列來看,AdEasy系統允許發生兩種同源重組,一種是通過轉移載體和腺病毒基因組質粒之間的腺病毒同源序列(左臂和右臂)進行重組;另一種則是通過兩個質粒相同的復制起點(Ori)和腺病毒序列右臂之間的同源重組。同時存在兩組同源序列有利于提高重組效率,兩種重組子具有等同的使用價值。經過改進,大大提高了重組效率,但同時也增加了非重組子的比例,增加了后續篩選陽性重組子的工作量。所以在操作中,我們注意了一些小的技巧。例如,電轉化后室溫放置5-10min,然后直接涂布含卡那霉素的平板,而無需37℃孵育半小時,這樣可以降低非重組子的比例。在挑選克隆進行鑒定時,我們挑選克隆形態最小的,因為往往形態最小的克隆陽性重組率較高。
線性化的重組腺病毒基因組質粒轉染293細胞是產生重組腺病毒的又一關鍵步驟。轉染之前,Pac I消化重組腺病毒基因組質粒的目的一是切除卡那抗性基因和質粒復制起始點Ori等原核質粒序列,二是釋放重組腺病毒基因組。用于產生重組腺病毒的293細胞是5型腺病毒轉化的人胚腎細胞,染色體整合有人腺病毒5型E1區序列,可反式支持E1缺陷的重組腺病毒的增殖。在轉染后7-10天內,病毒基因表達并產生出早期的重組腺病毒顆粒,但滴度太低不足以形成典型的細胞病變。將這些細胞收獲裂解,用裂解液再進行新的感染,3-4天可觀察到明顯的細胞病變。用AdEasy系統構建重組腺病毒的周期在20d左右,較以往的方法大大節省了時間,而且AdEasy系統產生的重組病毒純度很高。這是因為在轉染之前,重組病毒的基因組以純化的質粒形式存在,因此參與病毒包裝的基因組非常均一;而經典方法是通過293細胞內同源重組直接產生病毒顆粒,所有符合包裝條件的同源重組產物都參與病毒的組裝,重組病毒純度必然受到影響。因此,對于經典方法來說,用多次挑取噬斑擴增的方法來純化重組病毒是必不可少的步驟,工作量巨大而且周期長。AdEasy系統產生的重組病毒純度通常高于95%,可滿足絕大部分實驗的要求,節省了大量時間和實驗材料。
我們對重組腺病毒進行了多種指標的檢測。外源nm23-H1基因整合到腺病毒基因組中,用PCR直接擴增基因組DNA可以擴增出nm23-H1 cDNA,而空腺病毒基因組質粒不能擴出相應條帶,從而證明了目的基因nm23-H1已經整合到腺病毒基因組質粒中。RT-PCR鑒定也證實重組腺病毒構建取得了預期結果,重組腺病毒攜帶的nm23-H1基因的表達也比較理想。
綜上所述,AdEasy系統是目前最先進的腺病毒載體系統之一,具有構建過程簡便快速,重組病毒均一等優點,實驗中對重組方法略加改進,使細菌內同源重組效率及重組病毒純度均顯著提高。本部分為進一步研究以腺病毒作載體的nm23-H1基因對舌癌細胞生物學行為研究奠定了基礎。
[1]Parkin DM,Pisan P,Ferlay J.Global cancer statistics[J].CA Cancer J Clin,1999,49(1):33-64
[2]Khan MH,Yasuda M,Higashion F,et al.Nm23-H1 suppresses invasion of oral squamous cell carcinoma-derived cell lines without modifying matrix metalloproteinase-2 and matrix metalloproteinase-9 expression[J].Am J Pathol,2001,158(5):1785-1791
[3]Willems,Roel,Slegers,etal.Extracellularnucleoside diphosphate kinase NM23/NDPK modulates momal hematopoietic diffentiation[J].Exp-Hematol, 2002,30(7):640-648
[4]He TC,Zhou S,Da Costs LT,et al.A simple system for generating recombinant adenovirus[J].Proc Natl Acad Sci USA,1998,95(5):2509-2514
[5]戴華生編譯.病毒學實驗診斷技術[M].江西:江西省科學技術情報研究所,1979.227-229
[6]Braun S,Mauch C,Boukamp P,et al.Novel roles of nm23 proteins in skin homeostasis, repair and disease[J].Oncogene.2007,25;26(4):532-542
[7]Cemazar M,Sersa Q,Wilson J,et al.Effective gene transfer to solid tumors using differentnonviral gene delivery techniques:electroporation,liposomes,and integrin-targeted vecter[J].Cancer Gene Ther,2002,9(4):399-406

