依帕司他與甲鈷胺聯合治療糖尿病周圍神經病變療效觀察
劉 鵬 王尚珍 魏學娟
1)河南南陽市第三人民醫院神經內科 南陽 473000 2)北京市豐臺區方莊醫院 北京 100078
糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是糖尿病常見的慢性并發癥之一,可累及神經系統的任何部位,其導致的肢體麻木、疼痛、感覺異常等癥狀嚴重影響患者生活質量,是糖尿病患者致殘的最常見原因[1],但目前尚缺乏療效顯著的治療手段[2]。依帕司他是一種新型的醛糖還原酶抑制劑,能抑制細胞內山梨醇的積累,減輕糖尿病患者的氧化應激,有效改善糖尿病的神經病變[3]。本院在應用基礎藥物治療的前提下,采用依帕司他聯合甲鈷胺治療DPN,觀察其療效,旨在尋求更有效的治療措施。
1 資料與方法
1.1 一般資料 所觀察對象均為我院門診DPN患者,均符合DPN的診斷標準[4],并排除其他原因造成的神經損害。臨床表現為肢體麻木、疼痛、運動障礙等周圍神經損害。查體可見深、淺感覺障礙,多呈對稱性,下肢較上肢嚴重,遠端重于近端,重者可見肌肉萎縮、肌張力下降、腱反射減弱、下肢癱瘓。肌電圖示正中神經及腓神經的傳導速度減慢。將96例患者隨機分為治療組48例,對照組48例,2組一般情況比較差異無統計學意義(P>0.05)(具體見表1)。
表1 2組治療前一般資料比較 ()
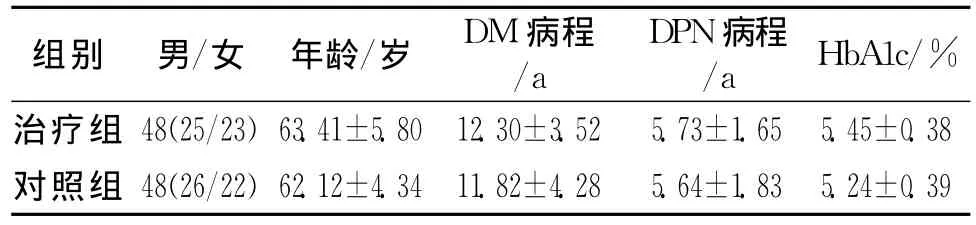
表1 2組治療前一般資料比較 ()
組別 男/女 年齡/歲 DM病程/a DPN病程/a HbA1c/%治療組 48(25/23)63.41±5.8012.30±3.525.73±1.655.45±0.38對照組 48(26/22)62.12±4.3411.82±4.285.64±1.835.24±0.39
1.2 給藥方法 治療前對全部患者進行糖尿病防治教育,嚴格控制飲食,進行適當運動,口服降糖藥或用胰島素控制血糖,對高血壓患者進行控制血壓及降脂治療,并且停用口服鎮痛藥。在此基礎上,對照組給予甲鈷胺片,0.5mg/次,3次/d,治療組在同樣應用甲鈷胺片的基礎上,加用依帕司他50mg/次,3次/d,飯前服用,連續治療8周。
1.3 數據采集方法 治療前后,對所有患者進行詢問癥狀、進行膝反射等檢查并記錄;室溫保持在24~28℃,采用肌電圖儀對全部患者作神經電生理檢查,使用表面電極(刺激和記錄),測定主側肢體正中神經、腓總神經的運動神經傳導速度(MNCV)和感覺神經傳導速度(SNCV)。
1.4 療效判定[5](1)顯效:自覺癥狀消失,膝腱反射基本恢復正常,振動覺恢復正常,正中神經和腓神經的神經傳導速度較前增加>5m/s或恢復正常;(2)有效:自覺癥狀明顯減輕,膝腱反射、振動覺好轉,正中神經和腓神經的神經傳導速度較前增加,但幅度<5m/s;(3)無效:自覺癥狀無好轉,膝腱反射、振動覺無改善,正中神經和腓神經的神經傳導速度無變化。
1.5 統計學處理 應用SPSS 16.0軟件對實驗結果進行統計分析。計量資料用(±s)表示,組內治療前后數據比較采用配對t檢驗,組間比較采用t檢驗;計數資料用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 療效比較 治療后2組治療結果比較,治療組的有效率、顯效率和總有效率顯著高于對照組,差異均有統計學意義(P<0.05)(見表2)。

表2 2組治療前后療效比較 [n(%)]
2.2 神經傳導速度變化比較 治療后,2組神經傳導速度均較治療前顯著改善(P<0.05),治療組尤其明顯。治療前,對照組和治療組進行組間比較,差異無顯著性意義 (P>0.05)。治療后,2組進行比較,治療組的神經傳導速度較對照組提高,差異有顯著性意義(P<0.05)(見表3)。
表3 2組治療前后神經傳導速度變化 ()
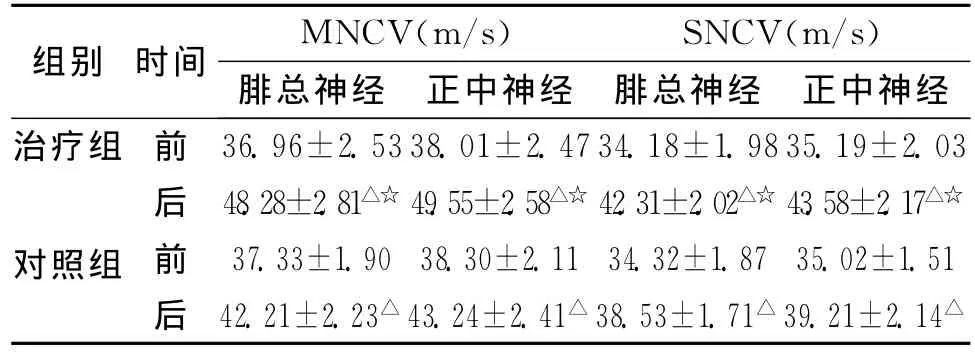
表3 2組治療前后神經傳導速度變化 ()
注:與本組治療前比較,△P<0.05;與對照組比較,☆P<0.05
?
3 討論
DPN是常見的糖尿病慢性并發癥之一,其發生與糖尿病病程有關,隨著年齡老化,其發病率逐年升高。DNP的病因及發病機制尚未完全闡明,近年來研究認為,DPN發病的主要因素為:(1)代謝障礙:多元醇代謝途徑激活,山梨醇代謝旁路代謝增強,過多的葡萄糖在醛糖還原酶的作用下產生山梨醇,使山梨醇在神經細胞內大量蓄積,直接造成神經損害。(2)血供障礙:長期高血糖導致神經滋養血管病變(包括血管內皮細胞增生、基底膜增厚、以致管腔狹窄、閉塞及血栓形成)及血流動力學改變,進而導致神經組織缺血缺氧及營養障礙。(3)神經營養因子缺乏及免疫損傷。上述因素共同作用可導致軸突變性和神經纖維節段性脫髓鞘,神經傳導速度減慢。
依帕司他是一種新型的醛糖還原酶抑制劑,通過抑制醛糖還原酶在多元醇代謝通路中的活性[6-7],減少山梨醇和果糖在周圍神經細胞內的蓄積,糾正多元醇代謝紊亂,恢復肌醇及Na+-K+-ATP酶活性,抑制蛋白激酶信號通路,增加內皮細胞NO的生成,從而抑制高糖介導的中性粒細胞內皮細胞黏附及內皮黏附因子的表達[8-9],糾正微血管及血流動力學的異常[10],增加神經傳導速度,改善感覺和運動神經功能,有效防治DPN。
甲鈷胺是維生素B12的衍生物,參與體內甲基化轉移,與氰鈷胺相比,更容易進入神經細胞內,通過甲基轉化反應促進神經組織內核酸、蛋白質及卵磷脂合成,促進軸索結構蛋白的輸送及軸索的磷脂合成,修復損傷的髓鞘,提高神經傳導速度,改善DPN癥狀,是臨床上治療DPN的常用藥物,效果確切[11]。
本研究在血糖控制的基礎上,應用甲鈷胺聯合依帕司他治療DPN,其療效與對照組進行比較,總有效率分別為87.50%和64.58%,差異有顯著意義。另外,2組雖均可改善患者的癥狀以及神經傳導速度,但治療組的療效更顯著,上述結果和國外一些報道相一致[12]。其原因可能為:依帕司他和甲鈷胺作用機制不同,可以相互補充,進一步改善糖尿病患者周圍末梢神經的代謝、傳導功能及運動功能。在整個治療過程中未發現明顯不良反應,患者耐受性好[13-14]。為此,本研究認為兩藥聯合治療DPN是一種有效的方法,值得在臨床上推廣應用。
[1]Wang W,Balamurugan A,Biddle J,et al.Diabetic neuropathy status and the concerns in underserved rural communities:challenges and opportunities for diabetes educators[J].Diabetes Educ,2011 ,37(4):536-548.
[2]李秀艷 .糖尿病周圍神經病變的治療進展[J].中國保健(醫學研究版),2008,16(11):417.
[3]Endo S,Matsunaga T,Fujita A,et al.Rat aldose reductaselike protein(AKR1B14)efficiently reduces the lipid peroxidation product 4-oxo-2-nonenal[J].Biol Pharm Bull,2010,33(11):1886-1890.
[4]何霞,于杰,朱蘋 .長春西汀治療糖尿病周圍神經病變療效觀察[J].中國實用神經疾病雜志,2010,13(11):79.
[5]李劍波,陳家偉 .糖尿病外周神經病變的發病機理研究進展[J].國外醫學內分泌學分冊,2004,24(2):82.
[6]Shen B,Vetri F,Mao L,et al.Aldose reductase inhibition ameliorates the detrimental effect of estrogen replacement therapy on neuropathology in diabetic rats subjected to transient forebrain ischemia[J].Brain Res,2010,25(1342):118-126.
[7]Kawai T,Takei I,Tokui M,et al.Effects of epalrestat,an aldose reductase inhibitor,on diabetic peripheral neuropathy in patients with type 2diabetes,in relation to suppression of N(?)-carboxymethyl lysine[J].J Diabetes Complications,2010,24(6):424-432.
[8]Calderone V,Testai L,Martelli A,et al.Anti-ischaemic activity of an antioxidant aldose reductase inhibitor on diabetic and non-diabetic rat hearts[J].J Pharm Pharmacol,2010 ,62(1):107-113.
[9]Shen Y,Zhong L,Markwell S,et al.Thiol-disulfide exchanges modulate aldo-keto reductase family 1member B10activity and sensitivity to inhibitors[J].Biochimie,2010,92(5):530-537.
[10]Gu J,Wang JJ,Yan J,et al.Effects of lignans extracted from Eucommia ulmoides and aldose reductase inhibitor epalrestat on hypertensive vascular remodeling[J].J Ethnopharmacol,2011,133(1):6-13.
[11]Mizukami H,Ogasawara S,Yamagishi S,et al.Methylcobalamin effects on diabetic neuropathy and nerve protein kinase C in rats[J].Eur J Clin Invest,2011,41(4):442-450.
[12]Hotta N,Kawamori R,Atsumi Y,et al.Stratified analyses for selecting appropriate target patients with diabetic peripheral neuropathy for long-term treatment with an aldose reductase inhibitor,epalrestat[J].Diabet Med,2008,25(7):818-825.
[13]Schemmel KE,Padiyara RS,D'Souza JJ.Aldose reductase inhibitors in the treatment of diabetic peripheral neuropathy:a review[J].J Diabetes Complications.,2010,24(5):354-360.
[14]Maccari R,Del Corso A,Giglio M,et al.In vitro evaluation of 5-arylidene-2-thioxo -4-thiazolidinones active as aldose reductase inhibitors[J].Bioorg Med Chem Lett,2011,21(1):200-203 .

