枯草芽孢桿菌谷氨酰胺轉氨酶的異源表達
劉 凱,劉逸寒,張 艷,田 耀,路福平
(工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
枯草芽孢桿菌谷氨酰胺轉氨酶的異源表達
劉 凱,劉逸寒,張 艷,田 耀,路福平
(工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
以野生型枯草芽孢桿菌基因組DNA為模板,PCR擴增獲得帶有SD序列及谷氨酸棒狀桿菌信號肽ΔS0949的BTG基因.將其與大腸桿菌–谷氨酸棒狀桿菌穿梭表達載體pXMJ19連接,構建重組質粒pXMJ19-Sbtg轉化谷氨酸棒狀桿菌ATCC13032.經IPTG誘導后該重組菌發酵液具有交聯酪蛋白的能力,表明該重組菌能夠實現分泌表達.
谷氨酰胺轉氨酶;谷氨酸棒狀桿菌;信號肽;分泌表達
谷氨酰胺轉氨酶(transglutaminase,EC 2.3.2.13,簡稱TG或TGase)是一種催化酰基轉移反應的轉移酶.TG作為酰基受體與蛋白質中的賴氨酸殘基的ε–氨基作用,形成ε–(γ–谷氨酰)Lys鍵,催化蛋白質分子內和分子間發生交聯、蛋白質和氨基酸之間的連接以及蛋白質分子內谷氨酰胺基的水解反應,從而改善蛋白質功能性質,提高蛋白質的營養價值,在肉制品、魚類制品、豆制品、面食和乳制品等食品加工業以及紡織和生物制藥等領域有著廣泛的應用前景[1–6].
目前,食品工業中谷氨酰胺轉氨酶的主要生產方法是通過茂源鏈霉菌(Streptomyces mobaraensis)直接發酵獲得,由于酶活收率較低(僅為37%)[7]使其價格居高不下.雖然以日本的味之素公司科研人員為代表的中外學者對茂源鏈霉菌谷氨酰胺轉氨酶(Streptomyces mobaraensis transglutaminase,MTG)進行了大量研究,發現使用谷氨酸棒狀桿菌作為表達宿主,將MTG的酶原區基因和激活該酶原的蛋白酶基因同時轉入宿主細胞后能夠大量表達MTG[8–9],之后不斷研究通過分子生物學技術改進酶的活力,先后采用嵌合前肽替代自身前肽[10]、親水表面熱區區域趨向突變(WASH-ROM)理性進化和隨機突變的非理性分子進化技術[11],在提高酶的活力的同時,對酶的突變體的構效關系以及底物特異性進行了詳細的分析,肯定了隨機突變是提高酶比活力的有效手段,確定了影響酶活力的關鍵氨基酸.同時證明了C. ammoniagenes ATCC6872等棒狀桿菌屬微生物都是表達外源蛋白的良好宿主[12],但MTG一些特性(諸如:pH和溫度等)對一些加工底物和加工過程的需求不能很好滿足[13],使得開發不同種類和特性的TG成為食品加工業發展的一個必然趨勢.而枯草芽孢桿菌谷氨酰胺轉氨酶(Bacillus subtilis transglutaminase,簡稱BTG)則能較好地彌補這些缺點.1996年日本的Kobayashi等[14]最早在枯草芽孢桿菌中發現了BTG,同時克隆出BTG基因,研究其分子結構,發現BTG沒有信號肽.而Suzuki等通過對BTG進行分離和特性研究,證明該酶相對分子質量約為2.9×104,最適作用溫度為60,℃,最適pH 8.2,能分別催化酪素液及BSA蛋白分子的交聯和凝膠化[15].關于BTG的研究目前主要以大腸桿菌(Escherichia coli)為表達宿主,主要存在表達量不高[16],產物極易形成包涵體等問題,而關于該酶分泌表達的報道則極少.
谷氨酸棒狀桿菌(Corynebacterium glutamicum)目前主要用于工業化生產谷氨酸和賴氨酸等各類氨基酸[17].以谷氨酸棒狀桿菌作為表達宿主有著極其明顯的優勢:擁有一套高效的分泌信號肽及分子伴侶系統,轉錄翻譯機制、遺傳背景較清楚,從而能夠高效分泌目的蛋白,也簡化了目的蛋白的分離純化,而且在多數情況下,谷氨酸棒狀桿菌分泌的重組異源蛋白具有天然構象和生物活性[18];谷氨酸棒狀桿菌分泌的蛋白酶極少,幾乎不會對表達的蛋白造成影響;谷氨酸棒狀桿菌嚴格好氧,生長迅速,培養條件簡單,使用安全,無致病性,作為表達宿主時間久,人們積累了極其豐富的發酵經驗.這些都說明谷氨酸棒狀桿菌是一種優良的食品用酶表達宿主.
本實驗旨在通過構建谷氨酸棒狀桿菌表達系統來實現BTG的分泌表達,為未來BTG的廣泛應用奠定基礎.
1 材料與方法
1.1 材料
1.1.1 菌種與質粒
大腸桿菌(Escherichia coli)JM110、谷氨酸棒狀桿菌(Corynebacterium glutamicum)ATCCA13032、野生型枯草芽孢桿菌(wild type Bacillus subtilis)、質粒pXMJ19均為本實驗室保存.
1.1.2 主要試劑和工具酶
Taq DNA聚合酶、限制性內切酶HindⅢ和PstⅠ,Takala公司;DNA純化回收和質粒快速提取試劑盒,天根生化科技(北京)有限公司;蛋白胨和酵母浸粉,Oxoid公司;其他試劑均為國產分析純.
1.1.3 培養基
LB(Luria-Bertani)培養基(g/L):胰蛋白胨10,酵母浸出粉5,NaCl 5,pH 7.0.
LA培養基(g/L):胰蛋白胨10,酵母浸出粉5,NaCl 5,瓊脂粉20,pH 7.0~7.2.
谷棒復蘇培養基(g/L):胰蛋白胨10,酵母浸出粉5,NaCl 5,葡萄糖5,pH 7.0~7.2.
1.1.4 引物合成
根據GenBank中枯草芽孢桿菌谷氨酰胺轉氨酶基因序列(登錄號為:E13095),參考谷氨酸棒狀桿菌信號肽篩選的結果[19],設計一段含SD序列及全長信號肽序列ΔS0949的BTG基因,該信號肽為Keiro W等在野生型谷氨酸棒狀桿菌基因組中篩選出的具有高效分泌能力的信號肽0949的基礎上,通過優化切割位點的首個氨基酸,將原始信號肽的首個氨基酸亮氨酸(L)改為谷氨酰胺(Q)得到的.引物設計為:上游引物P1:5′-TATCGGCGCTGCCAGCATGTTTAT GCCAAAGGCCAACGCCCAAGGAGCATCGAGAT GATTATTGTATCAGGACAA-3′,上游引物P2:5′-CCCAAGCTTAAAGGAGGACACGCATGCAAATA AACCGCCGAGGCTTCTTAAAAGCCACCGCAG GACTTGCCACTATCGGCGCTGCCAG-3′,下游引物P3:5′-AAAACTGCAGTTAGCGGACGATGCG-3′.上游引物P1除互補序列外還含有信號肽序列ΔS0949的下游49個堿基序列,上游引物P2的5′端引入了HindⅢ酶切位點(AAGCTT),含有信號肽序列ΔS0949的上游50個堿基序列及全長SD序列;下游引物P3的5′端引入了PstⅠ酶切位點(CTGCAG).引物委托上海英俊生物工程有限公司合成.
1.2 方法
1.2.1 野生型枯草芽孢桿菌染色體DNA的提取
接1環枯草芽孢桿菌單菌落于5,mL LB液體培養基,180,r/min、37,℃培養過夜;取1,mL菌液于1.5,mL的EP管中,離心去上清液,用500,μL去離子水重懸菌體,加溶菌酶至終質量濃度50,μg/mL,37,℃放置30,min;加10% SDS 100,μL,混勻,放置10,min左右直至黏稠;然后加入5,mol/L NaCl 100,μL,充分混勻,放置10,min;再加入體積比為1﹕1的苯酚與氯仿混合溶液700,μL,劇烈振蕩,離心10,min;直至兩界面澄清.用2倍體積無水乙醇沉淀DNA,12,000,r/min離心10,min,棄上清液,充分晾干;然后加50,μL去離子水溶解DNA,–20,℃保存備用.
1.2.2 含SD序列及信號肽ΔS0949的btg基因擴增
以野生型枯草芽孢桿菌染色體為模板,首先用引物P1、P3擴增目的基因,然后以該擴增產物為模板,以P2、P3為引物擴增出含SD序列及全長信號肽序列ΔS0949的BTG基因;擴增循環條件:95,℃預變性5,min,94,℃變性30,s,65,℃退火30,s,72,℃延伸1,min,30個循環.
1.2.3 重組質粒的構建
PCR產物純化回收后用HindⅢ和PstⅠ雙切后與同樣經過HindⅢ和PstⅠ雙切的質粒pXMJ19連接,轉化E. coli JM110,涂布含氯霉素質量濃度為50,μg/mL的平板,挑取轉化子,提取質粒,酶切驗證,實驗流程如圖1所示.

圖1 重組質粒pXMJ19-Sbtg構建流程圖Fig. 1 Construction of pXMJ19-Sbtg
1.2.4 谷氨酸棒狀桿菌的電轉化
接種新鮮的對數期菌液至含0.1%吐溫80和3%甘氨酸的LB液體培養基中,培養至A600約為0.9時取出搖瓶,冰浴15,min,4,℃、8,000,r/min離心10,min.用預冷的10%甘油洗滌菌體4次,最后用10%甘油重懸菌體,分裝保存.取50,μL感受態細胞和2,μL構建好的重組質粒混勻,迅速加入預冷的電轉杯中電擊.電擊條件為電壓2.5,kV,電阻400,?,電容200,μF.電擊結束后迅速取出電轉杯,加入LB培養基1,mL,46,℃熱擊6,min,30,℃振蕩培養1,h,取200,μL涂布于含10,μg/mL氯霉素的LB抗性平板.挑取轉化子酶切驗證.
1.2.5 目的基因在谷氨酸棒狀桿菌ATCC13032中的表達
接1環重組菌單菌落于裝有50,mL LB培養基的250,mL三角瓶中,30,℃、200,r/min振蕩培養過夜,以1%的接種量轉接于裝有100,mL LB培養基的500,mL三角瓶中,30,℃、200,r/min振蕩培養8,h,加入終濃度為1,mmol/L的IPTG誘導目的蛋白的表達,繼續培養48,h.發酵液于12,000,r/min離心5,min,取1,mL上清液,向其中加入100%TCA 130,μL,–20,℃放置30,min,4,℃沉淀12,h,12,000,r/min離心5,min,棄去上清液,加1,mL丙酮洗滌,待丙酮揮發完全后向沉淀中加入30 μL電泳上樣緩沖液,沸水浴5,min,12,000,r/min離心10,min,取上清液進行SDS-PAGE分析.
1.2.6 酪蛋白交聯實驗
用0.1,mol/L Tris·Cl(pH 7.5)配制1,mg/mL酪蛋白溶液.將酪蛋白溶液與粗酶液按一定比例混合,再加入DTT至終濃度為5,mmol/L,于37,℃反應過夜.反應產物進行SDS-PAGE檢測.
2 結果與分析
2.1 重組表達載體的構建
以野生型枯草芽孢桿菌染色體為模板,分別用引物P1、P3和P2、P3擴增目的基因Sbtg.由于在引物合成過程中,在btg的上游外源添加了一段SD序列和谷氨酸棒狀桿菌的高效分泌信號肽序列ΔS0949,使得btg具有了在谷氨酸棒狀桿菌中能夠分泌表達的潛力.PCR產物純化回收后用HindⅢ和PstⅠ雙切,后與同樣經過HindⅢ和PstⅠ雙切的質粒pXMJ19連接,轉化E. coli JM110,涂布含氯霉素質量濃度為50,μg/mL的平板,挑取轉化子,提取質粒,酶切驗證(圖2).經HindⅢ和PstⅠ雙切,重組質粒產生6,600,bp和850,bp的兩條帶,與預計大小相符,表明重組質粒構建成功.
2.2 谷氨酸棒狀桿菌的電轉化及鑒定
鑒于谷氨酸棒狀桿菌具有非常強的限制系統,能有效降解來自不同菌種的異源 DNA或被異源甲基化修飾的 DNA,使得在普通大腸桿菌中構建的重組DNA對谷氨酸棒狀桿菌的電轉化效率不高,因此,首先在甲基化修飾缺陷系統的大腸桿菌菌株JM110中構建好重組質粒pXMJ19-Sbtg,利用該質粒的大腸桿菌–谷氨酸棒狀桿菌穿梭特性轉化谷氨酸棒狀桿菌,可提高其轉化效率.提取JM110中構建好的質粒,轉化ATCC13032感受態細胞,涂布于含氯霉素10,μg/ mL 的LA抗性平板.挑取轉化子酶切驗證.
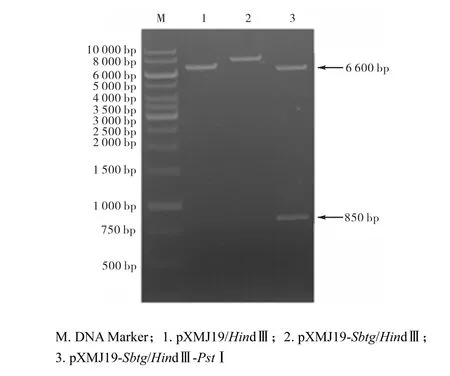
圖2 重組質粒的酶切鑒定Fig. 2 Idenfication of recombined vector by digestion with HindⅢ and PstⅠ
2.3 重組菌pXMJ19-Sbtg/13032的誘導表達
將未誘導及誘導48,h后的重組菌株和對照菌株pXMJ19/13032發酵液進行SDS-PAGE(圖3).通過測序結果推測,目的蛋白的相對分子質量應該為2.7×104,但電泳結果顯示,重組菌株pXMJ19-Sbtg/13032及對照菌株pXMJ19/13032均未見明顯的目的條帶出現,推測原因:活性形式的BTG由于其交聯作用會對菌體產生毒害作用,導致該蛋白的表達量不高.
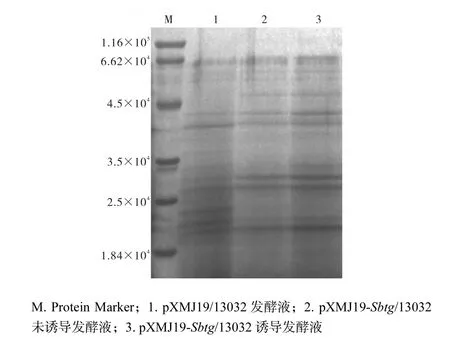
圖3 重組蛋白的SDS-PAGEFig. 3 SDS-PAGE analysis of the recombined protein
2.4 酪蛋白交聯實驗
分別將誘導前后重組菌及對照菌pXMJ19/13032發酵液過濾除菌后與配制的酪蛋白溶液混合,37,℃反應過夜后可見重組菌發酵液變渾濁,有白色絮狀沉淀產生,而對照菌發酵液則依然為澄清狀態.取反應液SDS-PAGE分析(圖4),結果表明與重組菌發酵液混合的酪蛋白經過BTG的交聯作用產生相對分子質量極大的聚合體,該聚合體無法進入濃縮膠內,而對照菌則未發生交聯反應.這表明重組菌經誘導后BTG得到了表達.
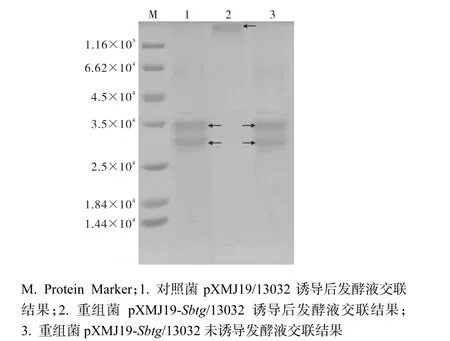
圖4 酪蛋白交聯產物SDS-PAGEFig. 4 SDS-PAGE analysis of cross-linked polymer
3 結 語
枯草芽孢桿菌谷氨酰胺轉氨酶(BTG)作為谷氨酰胺轉氨酶家族中較為特殊的一種,由于其相對分子質量較小(約2.8×104)及比活力較高,從而具有巨大的潛在應用價值.大腸桿菌由于產內毒素和易形成包涵體等局限,無法達到食品級用酶嚴格的生產要求,而谷氨酸棒狀桿菌則無此局限,是生產該酶潛在的優良宿主.由于天然存在的BTG是胞內酶,不含信號肽序列,無法得到分泌表達,故參閱相關文獻,利用一段適于谷氨酸棒狀桿菌高效分泌表達的信號肽序列ΔS0949,將其與BTG基因連接,得到了能分泌表達BTG的重組谷氨酸棒狀桿菌.目前還沒有關于特異性測定BTG酶活的方法,而氧肟酸比色法[20]是測定茂源鏈霉菌谷氨酰胺轉氨酶酶活的特異方法,但無法使用該方法測出BTG的酶活,推測可能原因為不同來源的谷氨酰胺轉氨酶的底物要求不同造成的,尋找特異性底物對BTG的表達量進行定量分析成為下一步工作的重點.
[1]Cofrades S,López-López I,Ruiz-Capillas C,et al. Quality characteristics of low-salt restructured poultry with microbial transglutaminase and seaweed [J]. Meat Science,2011,87(4):373-380.
[2]Yeoh S Y,Alkarkhi A F,Ramli S B,et al. Effect of cooking on physical and sensory properties of fresh yellow alkaline noodles prepared by partial substitution of wheat flour with soy protein isolate and treated with cross-linking agents[J]. International Journal of Food Sciences and Nutrition,2011,62(4):410-417.
[3]Benjakul S,Phatcharat S,Tammatinna A,et al. Improvement of gelling properties of lizardfish mince as influenced by microbial transglutaminase and fish freshness[J]. Journal of Food Science,2008,73(6):239-246.
[4]Agyare K K,Damodaran S. pH-stability and thermal properties of microbial transglutaminase-treated whey protein isolate[J]. Journal of Agricultural and Food Chemistry,2010,58(3):1946-1953.
[5]Zhu Y,Rinzema A,Tramper J. Microbial transglutaminase:A review of its production and application in food processing[J]. Applied Microbiology and Biotechnology,1995,44(3/4):277-282.
[6]Seguro K,Nio N,Motoki M. Some characteristics of a microbial protein cross-linking enzyme:Transglutaminase[J]. ACS Symposium Series,1996,650:271-280.
[7]周楠迪,田亞平,華子安,等. 微生物轉谷氨酰胺酶的純化方法和酶學性質研究[J]. 工業微生物,2004,34(3):20-23.
[8]Kikuchi Y,Date M,Yokoyama K,et al. Secretion of active-form Streptoverticillium mobaraense transglutaminase by Corynebacterium glutamicum:Processing of the pro-domain by a co-secreted subtilisin-like protease from Streptomyces albogriseolus[J]. Applied Environmental Microbiology,2003,69(1):358-366.
[9]Date M,Yokoyama K,Umezawa Y,et al. Production of native-type Streptoverticillium mobaraense transglutaminase in Corynebacterium glutamicum[J]. Applied Environmental Microbiology,2003,69(5):3011-3014.
[10]Date M,Yokoyama K,Umezawa K,et al. High level expression of Streptomyces mobaraensis transglutaminase in Corynebacterium glutamicum using a chimeric pro-region from Streptomyces cinnamoneus transglutaminase[J]. Journal of Biotechnology,2004,110(3):219-226.
[11]Yokoyama K,Utsumi H,Nakamura T,et al. Screening for improved activity of a transglutaminase from Streptomyces mobaraensis created by a novel rational mutagenesis and random mutagenesis[J]. Applied Microbiology and Biotechnology,2010,87(6):2087-2096.
[12]Itaya H,Kikuchi Y. Secretion of Streptomyces mobaraensis pro-transglutaminase by coryneform bacteria[J]. Applied Microbiology and Biotechnology,2008,78(4):621-625.
[13]Bernard B K,Tsubuku S,Shioya S. Acute toxicity and genotoxicity studies of a microbial transglutaminase[J]. International Journal of Toxicology,1998,17(6):703-721.
[14]Kobayashi K,Kumazawa Y,Miwa K,et al. ε-(γ-Glutamyl)lysine cross-links of spore coat proteins and transglutaminase activity in Bacillus subtilis[J]. FEMS Microbiology Letter,1996,144(2/3):157-160.
[15]Suzuki S,Izawa Y,Kobayashi K,et al. Purification and characterization of novel transglutaminase from Bacillus subtilis spores[J]. Bioscience,Biotechnology,and Biochemistry,2000,64(11):2344-2351.
[16]周建,董亞芳,吳自榮. 枯草桿菌谷氨酰胺轉氨酶的克隆及其在大腸桿菌中的融合表達[J]. 中國生物工程雜志,2004,24(8):77-81.
[17]Kr?mer R. Secretion of amino acids by bacteria:Physiology and mechanism[J]. FEMS Microbiology Reviews,1994,13(1):75-93.
[18]Lothar E,Michael B. Handbook of Corynebacterium glutamicum [M]. Boca Raton London New York Singapore:CRC Press,2005.
[19]Watanabe K,Tsuchida Y,Okibe N,et al. Scanning the Corynebacterium glutamicum R genome for highefficiency secretion signal sequences[J]. Microbiology,2009,155(3):741-750.
[20]Grossowicz N,Wainfan E,Borek E,et al. The enzyme formation of hydroxamic acids from glutamine[J]. Journal of Biological Chemistry,1950,187:111-125.
責任編輯:郎婧
Heterogeneous Expression of Bacillus subtilis Transglutaminase
LIU Kai,LIU Yihan,ZHANG Yan,TIAN Yao,LU Fuping
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
GeneSbtgwith SD sequence and signal peptide ΔS0949Corynebacterium glutamicumwas obtained from the genomic DNA of wild typeBacillus subtilisthough PCR amplification. It was then inserted into anE. coli-C. glutamicumshuttle vector pXMJ19 to construct expression plasmid pXMJ19-Sbtg. The recombined plasmid was then transformed intoCorynebacterium glutamicumATCC13032. Induced by IPTG,the fermentatiom broth had a cross-linking ability. The result indicated that gene Sbtg was a secretion expression.
transglutaminase;Corynebacterium glutamicum;signal peptide;secretion expression
Q814.4
:A
:1672-6510(2012)03-0001-05
2011–12–16;
2012–01–22
“863”“十二五”農村領域國家科技計劃課題資助(2011AA100905-4);國家自然科學基金資助項目(21076159)
劉 凱(1986—),男,山東泰安人,碩士研究生;通信作者:路福平,教授,lfp@tust.edu.cn.

