食用百合卷丹離體培養再生體系的建立
張傳海,葛自兵,白雪峰,孫 婉
(1.皖西學院 生物與制藥工程學院,安徽 六安237012;2.安徽省舒豐現代農業科技開發有限公司,安徽 舒城231300;3.安徽省植物生物技術實訓中心,安徽 六安237012)
食用百合卷丹離體培養再生體系的建立
張傳海1,3,葛自兵2,白雪峰3,孫 婉3
(1.皖西學院 生物與制藥工程學院,安徽 六安237012;2.安徽省舒豐現代農業科技開發有限公司,安徽 舒城231300;3.安徽省植物生物技術實訓中心,安徽 六安237012)
選取食用百合卷丹的鱗片作為外植體,以MS為基本培養基,添加6-BA和NAA的不同植物激素組合,分組進行不定芽誘導、繼代增殖和誘導生根培養。結果表明,鱗莖的中層鱗片具有較強的不定芽分化能力,6-BA 0.5mg/L+ NAA 0.1 mg/L的激素組合適宜于鱗片的不定芽分化和繼代增殖,而最利于誘導生根的激素組合為NAA 1.0mg/L+6-BA 0.1mg/L。組培苗經過60天左右培養可在培養基中直接產生小鱗莖。
百合卷丹;鱗片;不定芽;快速繁殖
百合為百合科(Liliaceae)百合屬(Lilium)多年生宿根草本植物,因其根莖由多數肉質鱗片抱合和可治百病而得名。全世界共有90余種,原產我國的約有47種。百合是藥食同源的著名經濟植物,其鱗莖肉質鮮嫩,性味甘寒,富含營養,具有補中益氣、養陰潤肺、抗衰老、治腫瘤、提高機體免疫力等多種功效[1-3]。
地處皖西大別山區的六安市霍山、舒城、金寨等縣,具有二十多年的食藥用百合人工栽培歷史,年種植規模達5萬畝以上,霍山縣“漫水河百合”于2010年被國家質量監督檢驗檢疫總局批準為地理標志保護產品,已發展成為區域性特色農業產業[4]。
百合生產上,一般是通過分球、鱗片扦插等方式來進行繁殖。對霍山等百合規模種植區的田間調查發現,由于不規范的種球自繁、重茬栽培、病害預報與防治跟不上等原因,近年來主產區百合病害日趨嚴重,導致種性退化,百合產量和質量大幅度下降,對產業發展構成了直接威脅[5][6]。因此,建立百合脫毒種苗生產技術體系和種球繁育供應基地,對于促進當地百合產業的健康發展具有重要意義。
植物組織培養技術在百合種苗快繁生產上有很大的應用空間[7-9]。本文以皖西大別山區百合主栽品種卷丹的鱗片為材料,研究外植體來源、培養基中植物激素配比等因素對于不定芽誘導發生、繼代增殖以及生根成苗等組培過程的影響,并為進一步開展百合莖尖脫毒培養和建立規模化脫毒種苗生產技術體系提供基礎依據。
1 材料與方法
1.1 材料
1.1.1 植物材料
供試百合品種為卷丹(Lilium lancifolium Thunb)。從霍山縣漫水河鎮種植基地采挖健壯的百合鱗莖帶回,用沙埋藏備用。
1.1.2 儀器
電熱蒸汽滅菌器(YX-450,上海三申),超凈工作臺(蘇州凈化),電子天平(上海精科)。
1.1.3 試劑
乙醇,升汞,萘乙酸(NAA),6-芐氨基嘌呤(6-BA),MS培養基配方中的各種試劑。
1.2 方法
1.2.1 培養基的制備
基本培養基為:MS+蔗糖30g/L+瓊脂粉50g/L。根據實驗目的加入不同的植物激素組合;芽誘導培養基加入0.05%活性炭,芽增殖培養基和生根培養基皆不加活性炭。培養基的配制,按常規流程進行,調整pH值至5.8,分裝后,高壓濕熱滅菌,冷凝備用。
1.2.2 外植體的消毒和接種
將百合鱗莖用自來水和軟毛刷洗凈,剝去最外層鱗片,選取潔白無病斑的鱗片作為外植體。在超凈工作臺上,將鱗片放入燒杯,加入75%乙醇浸泡10s,無菌水沖洗2次,然后將材料轉入無菌燒杯中,加入0.1%升汞溶液浸泡10min,倒去升汞,無菌水沖洗4次。用滅菌濾紙吸去鱗片表面水分,在無菌培養皿內,將鱗片切分為大約0.6cm×0.8cm的小塊,然后平放接種到芽誘導培養基上,每瓶接種4~6塊。轉入培養室,培養溫度(24±2)℃,光照強度1200Lux,光照時間10~12h/d。
1.2.3 不同部位鱗片材料的芽誘導
剝離百合鱗片時,按自然生長的外層、中層、內層分為3類,分別消毒、切塊和接種,培養30d,觀察記錄不定芽分化情況。
1.2.4 不同激素組合對不定芽分化的影響
將百合鱗片切塊分別接種在附加6-BA和NAA不同濃度組合的MS基本培養基上培養,觀察統計不定芽分化率和單塊外植體的不定芽分化數量。
1.2.5 不定芽的繼代增殖培養
當誘導產生的不定芽生長到0.6cm左右時,將其從鱗片外植體上剝離,選取長勢良好均一的不定芽轉接到增殖培養基上,培養30d,觀察不定芽的增殖情況。
1.2.6 不定芽的誘導生根
不定芽繼代增殖后,轉接到生根培養基上繼續培養,至第30d,統計生根情況。
1.2.7 數據統計方法
平均產芽數=不定芽總數/產芽的總外植體數;不定芽分化率(%)=(產生不定芽的外植體數/接種的總外植體數)×100;芽增殖倍數=增殖后不定芽數/接種的不定芽數;平均生根率(%)=(生根的不定芽數/接種的不定芽數)×100。
2 結果與分析
2.1 不同部位鱗片材料的不定芽誘導效果
鱗片切塊接種到芽誘導培養基上培養2~3周,鱗片切口處發生膨大或凸起,不定芽逐步分化形成(圖1)。至第30d,統計外層、中層、內層鱗片切塊的不定芽發生數量,結果(表1)表明,不同部位來源的鱗片外植體,其分化產生不定芽的能力有顯著差異,總體上呈現為中層>外層>內層,鱗片的所處部位對不定芽分化有明顯影響。
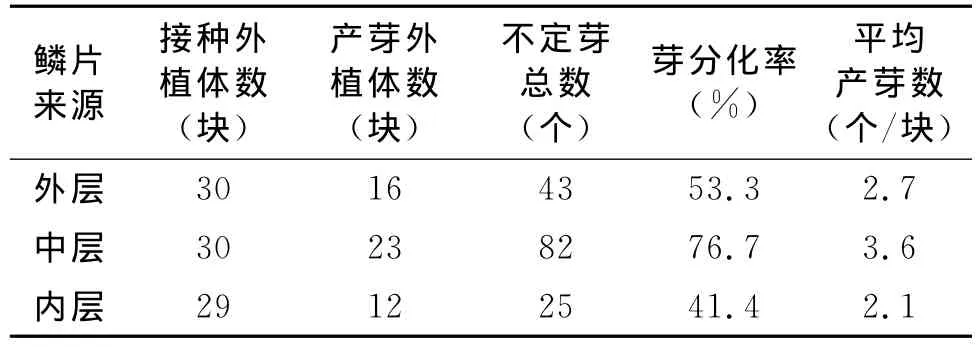
表1 不同部位的鱗片材料誘導產生不定芽的效果
2.2 不同植物激素對誘導產生不定芽的影響
在MS基本培養基中添加不同濃度水平的6-BA和NAA激素組合,對中層鱗片切塊的不定芽誘導效果進行比較,結果見表2。在設置的6個實驗組中,以6-BA0.5mg/L+NAA0.1mg/L的激素組合為優,芽誘導率達到83.3%,平均每個外植體分化產生的不定芽數為3.8個。就單一激素類別對芽誘導分化的效應而言,6-BA的使用濃度以0.5mg/L最佳,其次為1.0mg/L,0.1mg/L最差;而 NAA與6-BA的配比使用效果,0.1mg/L組皆優于0.5mg/L組。
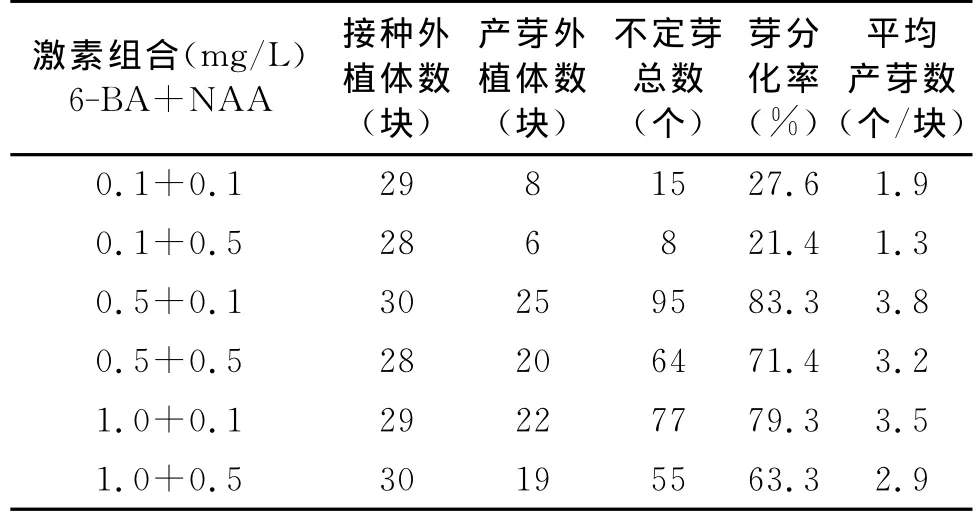
表2 不同激素組合對中層鱗片誘導產生不定芽的影響
2.3 植物激素對不定芽繼代增殖的影響
設定 NAA的濃度為0.1mg/L,改變6-BA的濃度,考查不定芽繼代培養的增殖效果,結果(表3)表明,當6-BA的濃度為0.5mg/L時,增殖倍數最高,為3.60;繼續提高6-BA的濃度,芽增殖倍數呈現明顯下降。在6-BA為0.5mg/L的濃度水平上,以不添加NAA為對照,與添加NAA0.1mg/L的實驗組相比,不定芽增殖數與增殖倍數有一定下降,但差異并不顯著。
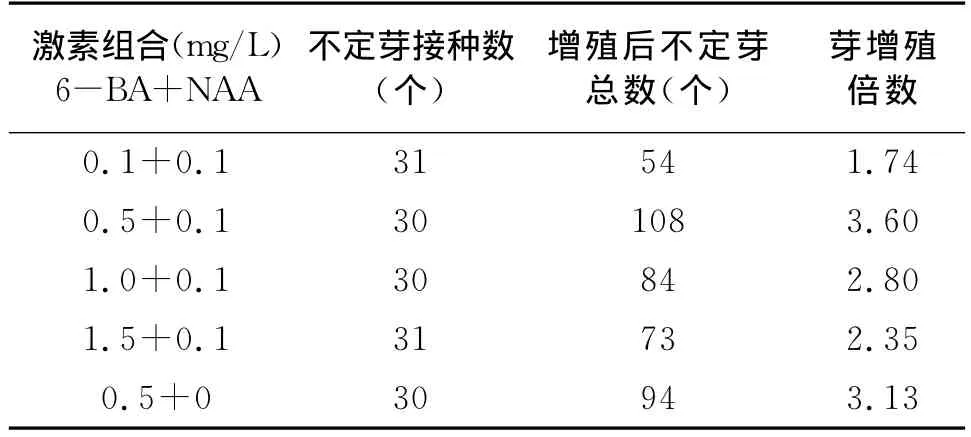
表3 植物激素對不定芽繼代增殖的影響
2.4 不定芽的生根培養與小鱗莖發生
生根培養基的植物激素組合:6-BA固定為0.1mg/L,NAA 設置0.1、0.5、1.0、1.5mg/L共4個濃度;以不加任何植物激素為對照組。從繼代增殖的不定芽中,挑取長勢一致者接種到生根培養基中培養,第10d左右開始,不定芽的葉片抽展形成幼苗(圖2),芽體基部陸續誘導生根,從而形成完整試管苗。培養至第30d,統計誘導生根情況,從表4結果可見,實驗組 NAA1.0mg/L+6-BA0.1mg/L的誘導生根效果最好,根多,根系發達健壯。
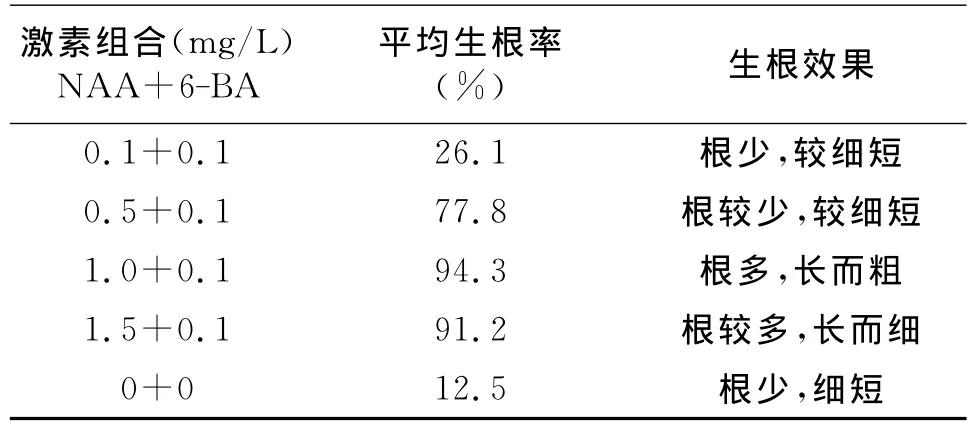
表4 植物激素對不定芽誘導生根的效果比較
觀察發現,若完成上述誘導生根培養后不更換培養基,繼續培養40d左右,試管苗發生枯萎,但每株苗會相應形成1~4個小鱗莖(圖3),可作種球使用或擴大繁殖。

圖1 鱗片不定芽的發生

圖2 不定芽生長成苗

圖3 試管苗產生小鱗莖
3 討論
百合鱗片常被選擇作為組培快繁的良好外植體。本研究以食用百合卷丹的鱗片為材料,探討不定芽分化發生、繼代增殖和誘導生根的基本影響因素,為進一步建立以莖尖培養為基礎的百合脫毒種苗生產技術體系打下基礎。
影響百合鱗片誘導分化的因素是多方面的[10][11]。本實驗結果表明,在培養基和培養條件一致的情況下,不同部位的鱗片,其不定芽分化率存在顯著差異,中層鱗片的芽分化能力最強,其次是外層鱗片,而內層鱗片產生不定芽的數量最少。不同的外源激素組合對鱗片的不定芽分化也存在顯著影響,本實驗選用6-BA與NAA兩種植物激素的不同濃度水平配比,考查對不定芽的誘導效果,以0.5mg/L6-BA與0.1mg/LNAA的組合最佳,不定芽誘導分化率達到83.3%,在此基礎上提高6-BA的濃度水平反而會降低芽分化率。本實驗在芽誘導培養基中附加了0.05%的活性炭,而我們做過與不加活性炭實驗組的比較研究(結果未報道),發現MS基本培養基添加一定量的活性炭,不僅可以提高不定芽的誘導效率,而且產生的芽較為壯實,有利于后期增殖和生長。
通過對比實驗,發現卷丹鱗片不定芽誘導的適宜激素組合也最適于芽的增殖培養,芽增殖的6-BA濃度以0.5mg/L最佳,而外源 NAA 保持在0.1mg/L的低濃度水平為宜。對于不定芽的誘導生根而言,NAA1.0mg/L+6-BA0.1mg/L的激素組合誘導效果最好,產生的不定根多,根系發達健壯。
關于百合的組織培養已有大量研究報道[12]。不同品種、不同地域的實驗材料,對于研究結果可能具有直接影響,得到的結論會呈現差異化,因此,實際研究或生產中,應充分考慮到基因型、內源性激素等因素的影響,建立科學客觀的技術體系。
[1]周佳民,朱校奇,彭福元,等.食用百合規范化栽培技術[J].安徽農學通報,2009,15(3):206-208.
[2]國家藥典委員會.中華人民共和國藥典(一部)[M].北京:化學工業出版社,2005.
[3]熊麗,王祥寧,張藝萍,等.百合種球國產化的回顧及發展商榷[J].西南農業學報,2008,21(3):859-862.
[4]儲成虎,武麗,許自文,等.皖西大別山區食用百合無公害高產栽培技術[J].安徽農業科 學,2005,33(11):2068-2069.
[5]鄧余良,彭慧,金鑫.皖西山區藥百合病害流行原因及其防治技術[J].現代農業科技,2006,(8):63-64.
[6]張健,許自文,何新祥.霍山縣百合品種退化原因及對策[J].上海蔬菜,2006,(3):13-14.
[7]張建華,莊天明,陳銀華.百合無病毒苗快速繁殖技術[J].上海交通大學學報(農業科學版),2006,24(4):370-373.
[8]王海新.東方百合種球脫病毒快繁及生產技術[J].現代農業科技,2008,(12):75-76.
[9]張藝萍,屈云慧,王祥寧,等.提高百合莖尖組織培養脫毒效率研究[J].廣東農業科學,2007,(1):37-38.
[10]王延秀,張金文,師桂英.東方百合鱗片組織培養研究[J].甘肅農業科技,2009,(2):8-11.
[11]儲俊,許娜,龔義平,等.安徽霍山藥百合組織培養的研究[J].安徽農學通報,2009,15(14):39-42.
[12]李筱帆,張啟翔.百合組織培養和植株再生的研究進展[J].安徽農業科學,2009,37(4):1479-1482.
Establishment of Regeneration Systems by Squama Culture of Lilium LancifoliumThunb
ZHANG Chuan-hai1,3,GE Zi-bing2,BAI Xue-feng3,SUN Wan3
(1.College of Biological and Pharmaceutical Engineering,West Anhui University,Lu’an237012,China;2.Anhui Shufeng Modern Agriculture Science and Technology Development Limited Company,
Shucheng231300,China;3.Plant Biotechnology Training Center of Anhui Province,Lu’an237012,China)
Squamas of edible lily bulbs of Lilium lancifoliumThunb were used as explants,and MS media added different combination of 6-BA and NAA were employed for adventitious bud induction,bud multiplication subculture and root induction.The results showed that bud differentiation ability of outward squamas was better than that of inward ones,the medium MS+6-BA 0.5mg/L+ NAA 0.1mg/L was optimal both to bud induction and to bud multiplication,and the optimal medium for rooting was MS+ NAA 1.0mg/L+6-BA 0.1mg/L.Small bulbs directly generated from seedlings after an about 60days’continuous culture in the medium.
Lilium lancifolium;Thunb;bulb squamas;adventitious buds;rapid propagation
Q813.1
A
1009-9735(2012)02-0001-03
2012-02-12
安徽省高校省級自然科學研究重點項目(KJ2012A278)。
張傳海(1965-),男,安徽金寨人,教授,博士,研究方向:植物生物技術。

