外源性鋅離子對大鼠肺組織中表皮生長因子受體表達及活化的影響*
李 冰,梁 寧,賈陳志,燕 貞,王 威,吳逸明,吳衛東
鄭州大學公共衛生學院勞動衛生學教研室 鄭州 450001
二氧化硫是造成大氣污染和影響人體健康的主要因素,其進入大氣層后溶于水形成亞硫酸,部分被氧化為硫酸。空氣微細顆粒物的呼吸道毒性作用與其化學成分,尤其是某些可溶性金屬離子成分有關[1-2]。研究[3]發現鋅離子是 PM2.5 顆粒物造成呼吸道反應的主要因素。研究[4]顯示含鋅化合物可提高人支氣管上皮細胞和肺泡上皮細胞白介素8(interleukin-8,IL-8)的表達。動物實驗[5-7]結果顯示,呼吸道灌注可溶性鋅可誘發大鼠以中性粒細胞、炎性細胞因子含量升高及蛋白滲出為主的呼吸道炎癥反應。細胞實驗[8-9]表明,鋅離子可激活細胞內多種信號傳導分子,如表皮生長因子受體(epidermal growth factor receptor,EGFR)、絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)等。EGFR是一種多功能糖蛋白,廣泛分布于人體各組織細胞膜上,參與上皮細胞膜的修復等生理反應,在炎癥和癌變組織中高表達或異常表達[10]。作者觀察了氣管灌注鋅離子對大鼠肺組織EGFR表達、活化的影響及可能機制。
1 材料與方法
1.1 實驗動物、主要試劑與儀器 13周齡清潔級健康雄性Wistar大鼠20只,體質量100~130 g,購自河南省實驗動物中心,合格證號scxk(豫)2005-0001。硫酸鋅(天津凱通化學試劑有限公司),EGFR抑制劑PD153035(美國Calbiochem公司),二甲基亞砜(DMSO,美國Sigma公司),兔抗鼠EGFR抗體、兔抗鼠EGFR-Y1068抗體、辣根酶標記山羊抗兔IgG抗體(美國RD Biosciences公司),DAB顯色試劑盒(北京康為世紀生物科技有限公司)。DYY-8C穩流穩壓電泳儀、SDS-PAGE垂直電泳儀(北京六一儀器廠),Gene Genius Bio成像系統(美國Syngene公司)。
1.2 實驗分組 20只大鼠隨機分為4組(DMSO+PBS組、DMSO+硫酸鋅組、PD153035+PBS組、PD153035+硫酸鋅組),每組5只。先用乙醚將大鼠麻醉,然后根據分組情況,采用支氣管灌注法分別預灌注DMSO或1 μmol/L PD153035溶液,灌注劑量為0.5 mL/kg,約30 min后同法分別灌注 PBS或100 μmol/L硫酸鋅溶液,灌注劑量為1 mL/kg。8 h后,將大鼠頸椎脫臼處死,取大鼠肺組織離心提取蛋白。
1.3 EGFR表達及活化的檢測 將提取的蛋白用Bradford法進行定量,Western blot檢測EGFR的表達及活化量。Y1068是EGFR的主要活化位點,因此以Y1068的磷酸化水平表示EGFR的活化量。用Gel-Pro analyzer軟件對光密度值進行分析,作為EGFR的表達量及活化量。
1.4 統計學處理 采用SPSS 12.0處理數據,采用2×2析因設計的方差分析探討預灌注PD153035和灌注硫酸鋅對大鼠肺組織EGFR的表達水平及活化量的影響,檢驗水準α=0.05。
2 結果
2.1 EGFR的表達情況 結果見圖1、表1。
2.2 EGFR的活化情況 結果見圖2、表2。

圖1 4組大鼠肺組織中EGFR的表達情況
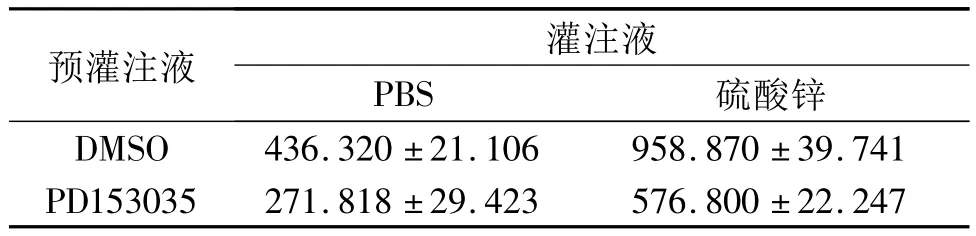
表1 4組大鼠肺組織中EGFR的表達水平比較(n=5)

圖2 4組大鼠肺組織中磷酸化EGFR的表達
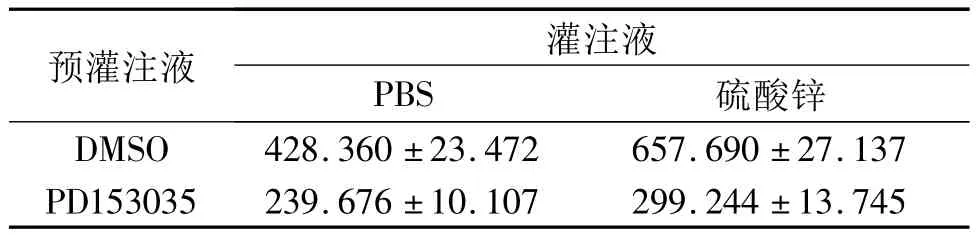
表2 4組大鼠肺組織中磷酸化EGFR的表達比較(n=5)
3 討論
EGFR廣泛分布于上皮組織中。呼吸道上皮細胞中EGFR存在于細胞膜基底外側部,參與呼吸道上皮細胞膜的修復等[11]。當EGFR被外源性毒物等刺激后,可誘發EGFR單體聚合為二聚體,活化自身酪氨酸激酶,活化的激酶再催化二聚化的EGFR胞內發生交聯磷酸化,從而激發下一級信號轉導,精確指導各類型細胞反應,調節由外源鋅離子所致的炎性過程。該研究結果顯示,加入硫酸鋅后,EGFR的表達水平及活化量均升高,提示硫酸鋅可致大鼠炎癥反應。EGFR是酪氨酸激酶受體,PD153035是酪氨酸激酶抑制劑,可競爭性抑制EGFR磷酸化。該研究結果顯示,硫酸鋅單用可致大鼠肺組織EGFR表達水平及活化量升高,PD153035可降低大鼠肺組織EGFR的表達水平及活化量,而2者合用,有交互作用,提示硫酸鋅致EGFR的表達水平及活化量升高,可能與酪氨酸激酶的磷酸化有關。
綜上所述,氣管灌注外源性鋅離子可致大鼠肺組織中EGFR的表達水平與活化量增加,其機制可能與酪氨酸激酶的磷酸化有關。
[1]Gavett SH,Haykal-Coates N,Copeland LB,et al.Metal composition of ambient PM2.5 influences severity of allergic airways disease in mice[J].Environ Health Perspect,2003,111(12):1471
[2]Merolla L,Richards RJ.in vitro effects of water-soluble metals present in UK particulate matter[J].Exp Lung Res,2005,31(7):671
[3]Adamson IY,Prieditis H,Hedgecock C,et al.Zinc is the toxic factor in the lung response to an atmospheric particulate sample[J].Toxicol Appl Pharmacol,2000,166(2):111
[4]徐磊,燕貞,吳衛東,等.納米氧化鋅對人呼吸道上皮細胞白細胞介素-8表達的影響[J].鄭州大學學報:醫學版,2010,45(1):39
[5]Ho M,Wu KY,Chein HM,et al.Pulmonary toxicity of inhaled nanoscale and fine zinc oxide particles:Mass and surface area as an exposure metric[J].Inhal Toxicol,2011,23(14):947
[6]Wallenborn JG,Schladweiler MJ,Richards JH,et al.Differential pulmonary and cardiac effects of pulmonary expo-sure to a panel of particulate matter-associated metals[J].Toxicol Appl Pharmacol,2009,241(1):71
[7]賈陳志,關文池,李冰,等.表皮生長因子受體抑制劑對外源鋅離子致大鼠急性呼吸道炎癥的影響[J].鄭州大學學報:醫學版,2011,46(3):349
[8]Zhang Q,Wu W,Zhang T,et al.Involvement of EGF receptor and PI3K in ICAM-1 expression in human airway epithelial cells exposed to zinc sulfate[J].Wei Sheng Yan Jiu,2008,37(5):552
[9]Haase H,Rink L.Functional significance of zinc-related signaling pathways in immune cells[J].Annu Rev Nutr,2009,29:133
[10]Webster RJ,Giles KM,Price KJ,et al.Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J].J Biol Chem,2009,284(9):5731
[11]Choi HJ,Seo CH,Park SH,et al.Involvement of epidermal growth factor receptor-linked signaling responses in Pseudomonas fluorescens-infected alveolar epithelial cells[J].Infect Immun,2011,79(5):1998