體外定向誘導(dǎo)臍血間充質(zhì)干細(xì)胞分化為心肌樣細(xì)胞
趙洪昌,趙文靜,劉 薇,葉冬霞
(1.長春急救中心,吉林 長春130062;2.吉林省肝膽病醫(yī)院,吉林 長春130062)
間 充 質(zhì) 干 細(xì) 胞 (Mesenchymal stem cells,MSCs)是一類具有多向分化潛能的干細(xì)胞,具有高度可塑性,在特定的誘導(dǎo)條件下可分化為不同胚層來源的細(xì)胞,其生物學(xué)特點(diǎn)使其在臨床治療如組織和器官修復(fù)等方面具有廣闊的應(yīng)用前景[1,2]。在一定誘導(dǎo)條件下MSCs可分化為中胚層的骨細(xì)胞、軟骨細(xì)胞、脂肪細(xì)胞、心肌細(xì)胞,外胚層的神經(jīng)元、神經(jīng)膠質(zhì)細(xì)胞及內(nèi)胚層的肝細(xì)胞[3-5]。MSCs向心肌細(xì)胞的分化為擴(kuò)張性心肌病、心肌梗死等的治療帶來了新的希望。研究證明,5-氮胞苷可誘導(dǎo)MSCs定向分化為心肌樣細(xì)胞,但如何誘導(dǎo)MSCs定向分化為心肌細(xì)胞仍是需要重點(diǎn)研究的問題,為此本研究在分離培養(yǎng)臍血MSCs的基礎(chǔ)上,采用5-氮胞苷誘導(dǎo)培養(yǎng)臍血MSCs分化為心肌樣細(xì)胞,為臨床應(yīng)用MSCs治療心血管疾病提供實(shí)驗(yàn)基礎(chǔ)和理論依據(jù)。
1 材料和方法
1.1 材料
低糖DMEM培養(yǎng)基(Gibco公司),胎牛血清(杭州四季青);胰蛋白酶、5-氮胞苷(Sigma);臍血/骨髓干細(xì)胞處理試劑盒(寧夏中聯(lián)達(dá)公司);鼠抗人肌鈣蛋白(cTnT)單抗(丹麥DAKO公司),SP免疫組化試劑盒(邁新公司)。
1.2 臍帶血采集
選擇30歲以下剖宮產(chǎn)婦采集臍帶血,孕婦健康、無急慢性疾病,抗HIV、抗HCV及乙肝病毒標(biāo)志物檢測均為陰性。此項(xiàng)研究經(jīng)醫(yī)院倫理委員會批準(zhǔn),前期告知孕婦并簽署知情同意書。新生兒產(chǎn)出后立即在距臍輪5-7cm處鉗夾結(jié)扎臍帶并切斷,行臍帶靜脈穿刺直接將臍血引流入裝有枸櫞酸鈉抗凝劑的一次性采血袋內(nèi),臍帶血采集完畢后置冰盒內(nèi)運(yùn)輸至實(shí)驗(yàn)室進(jìn)行細(xì)胞分離培養(yǎng)。
1.3 臍血MSCs的分離培養(yǎng)
臍血單個(gè)核細(xì)胞的分離采用臍帶血細(xì)胞處理試劑盒,嚴(yán)格按照試劑盒說明書操作。分離后計(jì)數(shù)并檢測細(xì)胞存活率(臺盼藍(lán)染色)。分離獲得的單個(gè)核細(xì)胞,無血清DMEM培養(yǎng)液洗2次,以2×106/ml接種于60mm培養(yǎng)皿內(nèi),培養(yǎng)72h后換液,以后每3-4d換液1次,約10-1 4d細(xì)胞80%融合時(shí),胰酶消化傳代培養(yǎng)。鏡下逐日觀察細(xì)胞生長情況。
1.4 臍血MSCs的表型和分化潛能鑒定
取3代臍血MSCs細(xì)胞以1×104/孔接種于24孔培養(yǎng)板中(孔中預(yù)先放置無菌蓋玻片),二氧化碳培養(yǎng)箱培養(yǎng),待細(xì)胞生長接近80%融合時(shí),取出蓋玻片,PBS沖洗,4%多聚甲醛固定10min,免疫組織化學(xué)染色檢測細(xì)胞表面分子CD29、CD44、CD34的表達(dá);
根據(jù)文獻(xiàn)[6]。3代臍血 MSCs的細(xì)胞,含20%馬血清的培養(yǎng)基誘導(dǎo)培養(yǎng),隔日換液;對照組取同代細(xì)胞,常規(guī)培養(yǎng)液培養(yǎng)。誘導(dǎo)培養(yǎng)基培養(yǎng)14d后取出中蓋玻片,PBS沖洗,4%多聚甲醛固定10min,油紅O染色鑒定細(xì)胞分化情況。
1.5 5-氮胞苷誘導(dǎo)培養(yǎng)臍血MSCs
取第3代MSCs,以細(xì)胞濃度1×105/mL接種于6孔板內(nèi)(孔內(nèi)預(yù)置無菌蓋玻片),培養(yǎng)24h更換培養(yǎng)基為含10μmol/L 5-氮胞苷低糖DMEM培養(yǎng)基,繼續(xù)24h后棄去培養(yǎng)液,PBS洗滌2次,更換為常規(guī)培養(yǎng)基培養(yǎng);對照組始終采用常規(guī)培養(yǎng)基培養(yǎng)。培養(yǎng)不同時(shí)間點(diǎn)取出蓋玻片,4%多聚甲醛固定10min,風(fēng)干后保存于-20℃待檢。
1.6 免疫組織化學(xué)法檢測臍血MSCs的表達(dá)
嚴(yán)格按照試劑盒說明書進(jìn)行操作。取出已固定細(xì)胞爬片,PBS濕化20min,3%H2O2甲醇液封閉內(nèi)源性過氧化物酶,PBS沖洗后,滴加正常山羊血清封閉30min,滴加鼠抗人cTnT單抗(1∶200稀釋),對照組用PBS代替,37℃孵育1h,PBS沖洗后滴加辣根過氧化物酶標(biāo)記兔抗鼠二抗,37℃孵育30 min,PBS沖洗,DAB顯色,封片,鏡下觀察染色結(jié)果。結(jié)果判定:陽性細(xì)胞胞漿內(nèi)出現(xiàn)棕褐色顆粒,顯微鏡下計(jì)數(shù)5個(gè)低倍視野,計(jì)算陽性細(xì)胞百分率。
1.7 統(tǒng)計(jì)分析
實(shí)驗(yàn)數(shù)據(jù)以ˉx±s表示,兩組數(shù)據(jù)間比較用兩樣本t檢驗(yàn)。采用SPSS13.0軟件包進(jìn)行統(tǒng)計(jì)學(xué)分析。
2 結(jié)果
2.1 臍血MSCs的分離培養(yǎng)、表型和分化潛能鑒定
從臍帶血分離的單個(gè)核細(xì)胞培養(yǎng)72h后換液,部分細(xì)胞貼壁并分裂增殖形成集落,隨著培養(yǎng)時(shí)間的延長,細(xì)胞集落不斷增多,擴(kuò)大,約10-14d細(xì)胞融合,進(jìn)行傳代培養(yǎng)。傳代臍血MSCs很快貼壁,呈梭形均勻分布,增殖迅速,傳代周期為6-7d(見圖1)。
免疫細(xì)胞化學(xué)染色結(jié)果顯示:臍血MSCs高表達(dá)CD44和CD29,不表達(dá)CD34。成脂肪誘導(dǎo)組細(xì)胞變得稍大而扁平,油紅O染色后鏡下觀察可見,細(xì)胞核呈淺藍(lán)色,胞漿內(nèi)有橘紅色脂肪滴;對照組細(xì)胞無形態(tài)改變,油紅O染色后胞漿內(nèi)無橘紅色脂肪滴(見圖2)。結(jié)果表明,臍血MSCs可定向誘導(dǎo)分化為脂肪細(xì)胞。
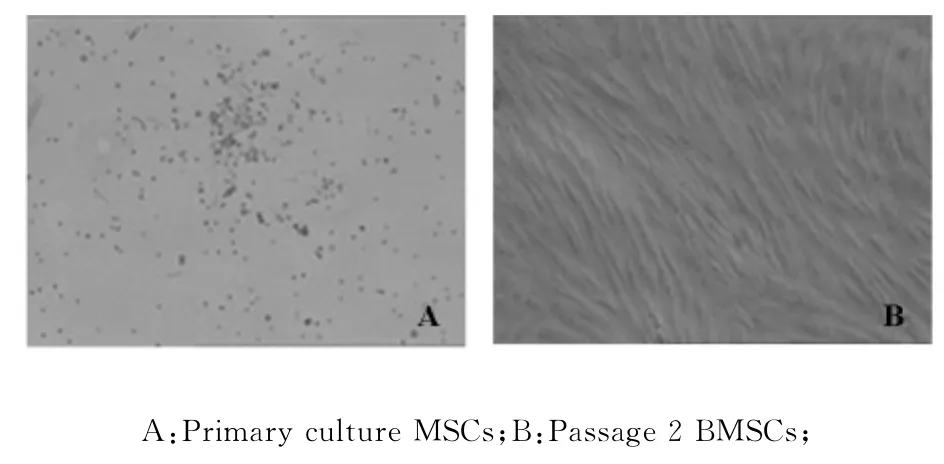
Fig.1 Morphological features of human cord blood MSCs(×40)
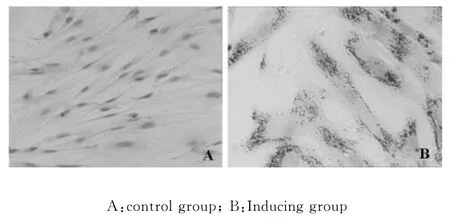
Fig.2 Red oil O staining of human cord blood MSCs(×200)
2.2 誘導(dǎo)培養(yǎng)組MSCs的形態(tài)學(xué)觀察和cTnT的免疫組化染色結(jié)果
對照組MSCs未發(fā)生形態(tài)改變,呈成纖維細(xì)胞樣整齊排列;5-aza誘導(dǎo)組MSCs生長狀態(tài)良好,培養(yǎng)7d細(xì)胞形態(tài)發(fā)生明顯變化,呈緊密平行排列生長,體積變大,隨著培養(yǎng)時(shí)間的延長,多數(shù)細(xì)胞呈桿狀,少數(shù)細(xì)胞呈不規(guī)則外形,相鄰細(xì)胞間的胞膜有接觸,逐漸相連呈肌管狀。
5-aza誘導(dǎo)組 MSCs培養(yǎng)7d、14d、21d、28d cTnT均呈陽性表達(dá),其表達(dá)陽性率分別為(17.2±4.2)%、(21.5±5.8)%、(42.3±8.5)%和(70.4±11.5)%,隨時(shí)間延長cTnT表達(dá)陽性率增高,不同時(shí)間點(diǎn)陽性率比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05);未經(jīng)5-aza誘導(dǎo)的MSCs中未見cTnT表達(dá)。
3 討論
大量研究已表明,臍帶血中含有大量的造血干細(xì)胞以及豐富的MSCs,臍帶血干細(xì)胞的體外增殖、分化能力、集落形成能力、刺激后進(jìn)入細(xì)胞周期的速度以及自泌生長因子的能力均強(qiáng)于骨髓及外周血來源干細(xì)胞,臍血為一種良好的 MSCs來源[7,8]。本研究采用密度梯度離心和貼壁培養(yǎng)法相結(jié)合分離培養(yǎng)臍血MSCs,結(jié)果顯示,密度梯度離心獲得的單個(gè)核細(xì)胞培養(yǎng)72h后大部分細(xì)胞貼壁,呈集落式生長,傳代細(xì)胞增殖迅速、呈均勻有序的成纖維細(xì)胞樣分布,傳代周期為6-7d。體外鑒定MSCs主要是根據(jù)細(xì)胞的形態(tài)和培養(yǎng)特性、表型以及分化潛能等,本研究從臍血分離的MSCs高表達(dá)表面分子CD44和CD29表達(dá),不表達(dá)CD34表達(dá),體外可定向誘導(dǎo)分化為脂肪細(xì)胞。研究結(jié)果表明密度梯度離心和貼壁培養(yǎng)法相結(jié)合可獲得較純化,高活性的臍血MSCs,與文獻(xiàn)報(bào)道一致,為進(jìn)一步實(shí)驗(yàn)奠定了基礎(chǔ)。

Fig.3 The morphology feature and expression of cTnT in MSCs(×100)
MSCs具有多向分化潛能,可定向分化為心肌細(xì)胞和血管內(nèi)皮細(xì)胞,MSCs已經(jīng)成為心血管疾病細(xì)胞移植治療的理想種子細(xì)胞,是近年來心血管疾病領(lǐng)域的研究熱點(diǎn),5-aza是目前公認(rèn)的可以誘導(dǎo)MSCs向心肌細(xì)胞分化的藥物。cTnT是心肌肌鈣蛋白中具有較高特異性的亞型,是鑒定心肌源性細(xì)胞的特異性標(biāo)志物[9,10],本研究采用5-aza對 MSCs進(jìn)行誘導(dǎo)培養(yǎng),并采用免疫組織化學(xué)染色鑒定cT-nT的表達(dá)。研究顯示5-aza誘導(dǎo)培養(yǎng)組MSCs生長狀態(tài)良好,7d后細(xì)胞的形態(tài)出現(xiàn)變化,多緊密平行排列生長,體積變大,隨著培養(yǎng)時(shí)間的延長梭形細(xì)胞的比例下降,多呈桿狀,少數(shù)細(xì)胞呈不規(guī)則外形,相鄰細(xì)胞間的胞膜有接觸,排列具有方向性,逐漸相連呈肌管狀。誘導(dǎo)組在7d、14d、21d、28dMSCs的cTnT均呈陽性表達(dá),cTnT表達(dá)隨誘導(dǎo)培養(yǎng)時(shí)間延長表達(dá)逐漸增強(qiáng);未經(jīng)5-aza誘導(dǎo)MSCs中未見cTnT表達(dá)。
綜上所述,本研究從臍帶血中成功分離高純度和活性的MSCs,并采用5-aza定向誘導(dǎo)分化為心肌細(xì)胞,為進(jìn)一步應(yīng)用臍帶血MSCs治療心血管疾病實(shí)驗(yàn)奠定了基礎(chǔ),相關(guān)研究正在深入進(jìn)行中。
[1]Jin HJ,Park SK,Oh W.et al.Down-regulation of CD105is asso-ciated with multi-lineage differentiation in human umbilical cord blood-derived mesenchymal stem cells[J].Biochem Biophys Res Commun,2009,381(4):676.
[2]Iop L,Chiavegato A,Callegari A,et al.Different cardiovascular potential of adult-and fetal-type mesenchymal stem cells in a rat model of heart cryoinjury[J].Cell Transplant,2008,17(6):679.
[3]Shin M,Yoshimoto H,Vacanti JP.In vivo bone tissue engineering using mesenchymal stem cells on a novel electrospun nanofibrous scaffold[J].Tissue Eng,2004,10(1-2):33.
[4]趙文靜,陳亞潔,趙振國,等.肝病患者血清誘導(dǎo)人骨髓間充質(zhì)干細(xì)胞表達(dá)甲胎蛋白和白蛋白的的實(shí)驗(yàn)研究[J].中華肝臟病雜志,2006,14(4):300.
[5]張淑芹,葉東霞,劉淑榮.肝細(xì)胞生長因子誘導(dǎo)骨髓間充質(zhì)干細(xì)胞表達(dá)甲胎蛋白和白蛋白[J].中國組織工程研究與臨床康復(fù),2010,14(27):5041.
[6]Elliott P,Andersson B,Arbustini E,et al.Classification of the cardiomyopathies:aposition staement from the european society of cardiology working group on myocardial and pericardial diseases[J].Eur Heart J,2008,29(2):270.
[7]Petersen BE,Bowen WC,Patrene KD.et al.Bone marrow as a potential source of hepatic oval cells[J].Science,1999,284(5417):1168.
[8]Majumdar M K,Thiede MA,Haynesworth S E,et al.Human marrow-derived mesenchymal stem cells(MSCs)express hematopoietic cytokines and support long term hematopoiesis when differentiated toward stromal and osteogenic lineages[J].J Hematother Stem Cell Res,2000,9(6):841.
[9]Panteghini M.Present is sues in the determination of troponins and other markers of cardiac damage[J].Clin Biochem,2000,33(3):161.
[10]Moscoso I,centrno A,lopez E,et al.Differentiation“in vitro”of primary and immortalized porcine mesenchymal stem cells into cardiomyocytes for cell transplantation[J].Transplant Proc,2005,37(1):481.

