人TIM-1和TIM-3mRNA實時SYBR GreenⅠ定量RT-PCR檢測方法的建立
陳治中,卿吉琳,覃桂芳,胡麗華
(1.華中科技大學同濟醫學院附屬協和醫院 檢驗科,湖北 武漢430022;2.廣西壯族自治區人民醫院 檢驗科,廣西 南寧530021;3.廣西壯族自治區人民醫院 婦科,廣西 南寧530021)
最近一個新的T細胞表面受體家族-T淋巴細胞免疫球蛋白黏蛋白 (T cell immunoglobulin mucin)家族已經引起廣大研究者的興趣[1,2]。研究表明TIM家族與多種疾病如自身免疫病、哮喘等發病機制相關[2-4]。最新研究表明TIM基因家族可能是PS的一個新的受體家族,與PS結合介導凋亡細胞的識別與清除[5]。人TIM家族蛋白屬于I型膜蛋白,由 TIM-1、TIM-3和 TIM-4組成。研究表明TIM-1優先表達于人和鼠的Th2細胞表面,而TIM-3偏愛表達于人和鼠的Th1細胞表面,并且它們分別調節Th1與Th2細胞的免疫應答,可能對維持體內的Th1/Th2間的平衡起重要作用[2,6]。
通過對機體TIM-1和TIM-3mRNA表達水平的檢測,我們可以對機體內Th1與Th2細胞狀況作一分析,從而對機體免疫系統的活化程度進行初步評價。目前,檢測mRNA的方法有多種,由于實時熒光定量逆轉錄聚合酶鏈反應(Real-time quantitative,fluorescence-based reverse transcription polymerase chain reaction,real-time RT-PCR)具有高度敏感性、準確度高、動態監測和高通量等特點,已經在科研和臨床中得到廣泛應用,成為目前直接檢測機 體 mRNA 水 平 的 一 個 主 流 方 法[7,8]。SYBR Green I是熒光定量PCR最常用的DNA結合染料,與雙鏈 DNA(dsDNA)非特異性結合[7]。與TaqMan探針比較具有設計簡單、低成本和能夠進行熔點曲線分析檢驗擴增反應的特異性等優點[7,9]。因此,本研究旨在建立人 TIM-1和 TIM-3 mRNA實時 SYBR Green I定量 RT-PCR 檢測方法,為研究組織和細胞中的TIM-1和TIM-3mRNA的表達變化和它們在免疫調控中的作用提供一個技術平臺。
1 材料與方法
1.1 引物設計和合成
應用生物信息學知識,從Genbank中查閱出人TIM-1和TIM-3基因mRNA序列,根據引物設計原則,并利用Primer5.0設計軟件,自行設計人TIM-1和TIM-3基因克隆引物和 mRNA擴增引物,并由上海生物工程有限公司合成。
1.2 外周血單個核細胞(PBMC)的獲取及總RNA的提取與逆轉錄
采用Ficoll法外周血單個核細胞。依據Trizol試劑(Invitrogen)說明書提取總mRNA。人TIM基因的cDNA文庫按照逆轉錄說明書(Takara)合成。
1.3 PCR擴增及純化
用 TIM-1 基 因 的 克 隆 引 物,KTIM-1PF:5-CTAGCTAGCGCCACCATGCATCCTCAAGTGG TCATCT-3(含 Nhe I 位 點 )與 KTIM-1PR:5-GGGGTACCTTAGTCCGTGGCATAAAGACTA TTC-3(含 Kpn I位點);用 TIM-3基因的克隆引物, KTIM-3PF: 5-CCGCTCGAGGCCACCATGTTTTCACATCTTCCCTTTGAC-3(含 Xho I位點)與 KTIM-3PR:5-GGGGTACCGTTGGCATTGCAAAGCGACA-3(含 Kpn I位點),按 Prime-STAR HS DNA 聚合酶(Takara)說明書分別擴增人TIM-1和TIM-3全長片段,退火溫度為60℃。擴增產物分別按。按DNA純化回收試劑盒(天根,中國)使用說明書純化PCR產物。然后分別按加A反應試劑盒(Takara)說明書進行加A反應。
1.4 cDNA目的片段克隆
按照pMD18-T Simple載體說明書(Takara),連接上述人TIM-1和TIM-3加A的片段。并轉化感受態 DH5α(天根,中國),在含有 X-Gal、IPTG、Amp的L-瓊脂平板培養基上培養,按藍白斑實驗挑選幾個白色菌落,并用PCR菌液PCR證實。將PCR陽性菌液送上海生物工程有限公司測序證實。
1.5 重組質粒濃度測定及標準曲線的建立
采用質粒提取試劑盒(天根,中國)提純質粒,測定OD260/OD280分析純度,備用。根據重組質粒提取物OD260nm吸光度,并通過如下公式計算純化產物原液的濃度。并按下面公式計算:
DNA 模板濃度(copies/μl)=[A260×0.05×10-6g/μl×50 (稀釋倍數)/(660g/mol×堿基對數)]×6.02×1023。其中,1OD260=0.05g/L 雙鏈DNA;1對堿基平均分子量=660g/mol;TIM-1重組質粒3 810bp,TIM-3重組質粒3 620bp;6.02×1023為阿佛加德羅常數。
將備用的人TIM-1和TIM-3的質粒制備成1010copies/μl數量級的溶液作為標準品原液,貯于-80℃。將重組質粒標準品原液10倍梯度稀釋成1010-100copies/μl數量級的標準品,取107-103copies/μl數量級的標準品進行人 TIM-1和 TIM-3的實時熒光定量PCR檢測,每個樣品3次重復,根據臨界循環數(Threshold cycle,Ct)以及模板起始拷貝數制作標準曲線和標準方程。
1.6 實時熒光定量PCR檢測
在Lightcycler熒光PCR儀 (瑞士Roche公司)上擴增并檢測熒光。用TIM-1基因的mRNA引物 MTIM-1FP:5-AACTGTCTCTACCTTTGTTCCTCC-3 與 MTIM-1FR:5-GTTCTCTCCTTATTGCTCCCTG-3,用 TIM-3基因的 mRNA 引物 MTIM-3FP:5-CAGATACTGGCTAAATGGGGAT-3 與 MTIM-3FR:5-ACCTTGGCTGGTTTGATGAC-3擴增。Real-time PCR 反應體系:10×PCR緩 沖 液 2μl,25mmol/L Mg2+3.5μl,10 mmol/L dNTPs 0.4μl,10μmol/L引物各0.5μl,普通 Taq DNA 聚合酶 1U(1U/μl),質粒 DNA 1 μl,BSA(1mg/ml)2μl,SYBR Green I(20×)1 μl,滅菌 H2O 8.1μl.空白對照管加1.0μl滅菌DEPC水代替質粒DNA,蓋上蓋后瞬間離心,使樣品聚集在毛細管底部,然后上機擴增。擴增條件為:94℃2min,然后循環(94℃10sec;59℃(TIM-1)或者60℃(TIM-3)15sec;72℃15sec)40次,再分別進行熒光檢測,并做熔解曲線對PCR產物的特異性進行鑒定,最后反應冷卻至40℃。
1.7 重復性與精密度的測定
將1.0×105copies/μl的標準品平行操作8次或在8d內分別測定,獲取其批內與批間變異系數(CV)。
2 結果
2.1 人TIM-1和TIM-3基因片段的擴增與重組質粒的構建
采用特異性引物,以cDNA為模板進行PCR擴增,獲得了與各自預期片段大小一致目的條帶。對構建的重組質粒進行PCR和酶切鑒定,與預期結果一致(見圖1)。重組質粒DNA的測序結果表明,插入片段與原始片段的序列同源性為100%。
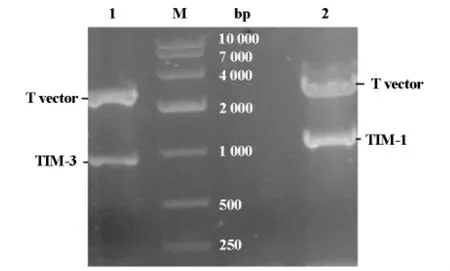
圖1 人TIM-1和TIM-3基因T載體雙酶切。1:TIM-3基因T載體XhoI/KpnI雙酶切;2:TIM-3基因T載體NheI/KpnI雙酶切;M:DNA Marker
2.2 人TIM-1和TIM-3Real-time RT-PCR標準曲線的建立
將含有目的基因片段的重組質粒進行10倍系列稀釋5個梯度(103-107拷貝/μl),進行 Real-time RT-PCR 擴增,獲得 TIM-1和 TIM-3的 Real-time RT-PCR標準曲線和直線回歸方程。標準曲線圖顯示,起始模板濃度與Ct值之間呈良好的線性關系;TIM-1和TIM-3標準曲線的線性回歸分析表明,相關系數 (Coefficient of correlation,r)分別為1.00和1.00,直線回歸方程分別為:TIM-1,y=-3.165x+37.56,誤差(error)=0.0724,Efficiency E:E=10-1/slope-1=1.070;TIM-3,y=-3.268x+37.55,誤差(error)=0.0452,Efficiency E:E=10-1/slope-1=1.023。由此推測試驗的過程和數據是非常可信的,可用于待測樣本初始模板含量的測定。
2.3 人TIM-1和TIM-3Real-time RT-PCR熔解曲線的分析
熔解曲線分析確認人TIM-1和TIM-3基因PCR產物的特異性。人TIM-1和TIM-3基因特異性產物都呈單一的熒光峰。峰值之前曲線平滑,未見其他明顯的非特異性熒光峰,可反映出擴增產物的特異性強。人TIM-1和TIM-3各自的熔解溫度(Tm)分別約為87℃和84.5℃。特異性產物經過2.5%的凝膠電泳,證實擴增特異性產物的片段大小與待擴增的片段大小一致(圖2)。
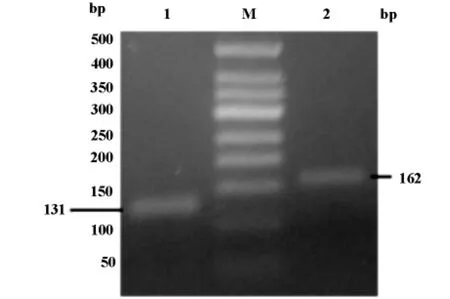
圖2 人TIM-1和TIM-3基因檢測mRNA的PCR產物凝膠電泳圖。1:人TIM-1的PCR產物;2:TIM-3的PCR產物;M:DNA Marker
2.4 重復性與精密度
SYBR GreenI實時定量PCR分別檢測人TIM-1和TIM-3基因1.0×105copies/μl標本的精密度。TIM-1基因批內與批間的CV分別為1.55%和2.20%,TIM-3基因批內與批間的CV分別為1.68%和2.01% (表1)
3 討論
目前研究表明新鑒定的TIM家族在免疫應答和免疫耐受中起重要作用[10-12]。鼠類由8個成員組成(Tim1~8),位于鼠類染色體11B1.1上;人類由3個成員組成(TIM-1、TIM-3和TIM-4),位于人類染色體5q33.2上[2]。TIM基因編碼一類具有共同基序的跨膜糖蛋白,其結構包括潛在的信號肽區、免疫球蛋白(IgV)樣區、黏蛋白樣區、跨膜區和胞內區五部分[2]。TIM-1優先表達于人和鼠的Th2細胞表面,作為一個潛在的共刺激分子調節T細胞的活化,是一個哮喘和過敏癥等的易感基因[2,13,14]。TIM-3偏愛表達于Th1細胞表面,與其配體半乳凝素-9(galectin-9)結合產生抑制信號,負調節 Th1免疫應答[15-18]。TIM-4在抗原提呈細胞上高表達,與其配體TIM-1結合調節T細胞增殖[19-21]。TIM 基因晶體結構顯示在其IgV區有一個特征性的FGCC'結構,可能是配體PS結合位點[22]。最新研究表明TIM基因家族可能是PS的一個新的受體家族,與PS結合介導凋亡細胞的識別與清除[5]。因此,TIM基因參與調節Th1和Th2細胞免疫應答,與自身免疫病、哮喘和過敏癥等疾病發病機制相關。
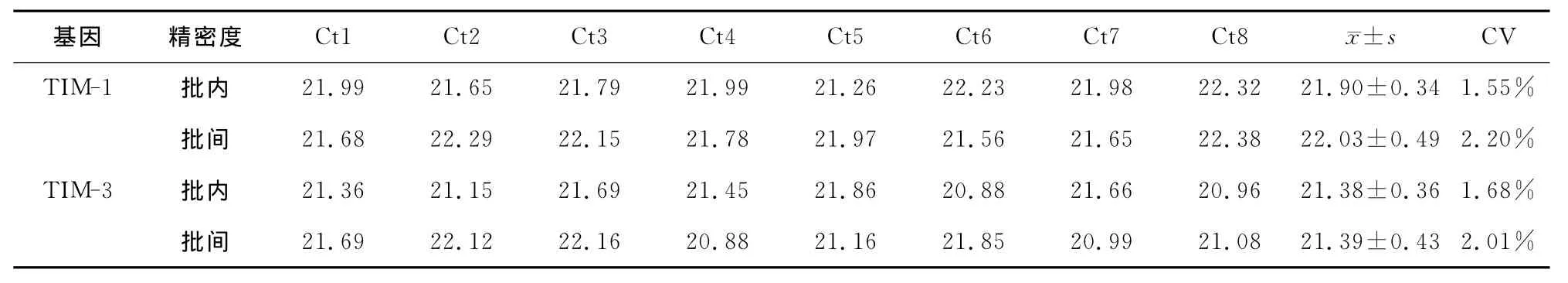
表1 人TIM-1和TIM-3基因標準品1.0×105copies/μl的批內與批間精密度檢測結果
實時熒光定量RT-PCR由于其具有高度敏感性和動態實時檢測等優勢而在科研和臨床中得到廣泛應用[9,23]。主要應用于定量分析各種基因的表達、基因分型和多態性分析、免疫組分分析、腫瘤研究和臨床疾病早期診斷與病原體檢測[24-26]。目前,實時熒光PCR的定量方法主要有為絕對定量和相對定量兩大類,各自具有優缺點[25]。定量PCR需要實時檢測反應中所形成的擴增產物,而目前多采用與DNA非特異性結合的熒光染料或者標記的序列特異性的探針來完成實時檢測[27]。與探針比較,熒光染料設計簡單、低成本、易操作和可以用熔解曲線分析特異性等優點[25]。SYBR Green I是熒光定量PCR最常用的DNA結合染料,與雙鏈DNA(ds-DNA)非特異性結合[27]。在本研究中我們利用構建的人TIM-1和TIM-3重組質粒,成功建立人TIM-1和TIM-3mRNA 實時SYBR Green I絕對定量RT-PCR檢測方法。結果表明建立的人TIM-1和TIM-3Real-time RT-PCR定量技術具有很好的敏感性、特異性、線性范圍,為研究組織和細胞中的TIM-1和TIM-3mRNA的表達變化和了解它們在免疫調控中的作用機制進一步奠定實驗基礎。
[1]Kuchroo VK,Umetsu DT,DeKruyff RH,et al.The TIM gene family:emerging roles in immunity and disease[J].Nat Rev Immunol,2003,3:454.
[2]Meyers JH,Sabatos CA,Chakravarti S,et al.The TIM gene family regulates autoimmune and allergic diseases[J].Trends Mol Med,2005,11:362.
[3]Umetsu DT,Umetsu SE,Freeman GJ,et al.TIM gene family and their role in atopic diseases[J].Curr Top Microbiol Immunol,2008,321:201.
[4]Anderson AC,Anderson DE.TIM-3in autoimmunity[J].Curr Opin Immunol,2006,18:665.
[5]Freeman GJ,Casasnovas JM,Umetsu DT,et al.TIM genes:a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity[J].Immunol Rev,2010,235:172.
[6]Su EW,Lin JY,Kane LP.TIM-1and TIM-3proteins in immune regulation[J].Cytokine,2008,44:9.
[7]Smith CJ,Osborn AM.Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology[J].FEMS Microbiol Ecol,2009,67:6.
[8]Bustin SA,Mueller R.Real-time reverse transcription PCR(qRT-PCR)and its potential use in clinical diagnosis[J].Clin Sci(Lond),2005,109:365.
[9]VanGuilder HD,Vrana KE,Freeman WM.Twenty-five years of quantitative PCR for gene expression analysis[J].Biotechniques,2008,44:619.
[10]Rodriguez-Manzanet R,DeKruyff R,Kuchroo VK,et al.The costimulatory role of TIM molecules[J].Immunol Rev,2009,229:259.
[11]Su EW,Lin JY,Kane LP.TIM-1and TIM-3proteins in immune regulation[J].Cytokine,2008,44:9.
[12]Kuchroo VK,Meyers JH,Umetsu DT,et al.TIM family of genes in immunity and tolerance[J].Adv Immunol,2006,91:227.
[13]McIntire JJ,Umetsu DT,DeKruyff RH.TIM-1,a novel allergy and asthma susceptibility gene[J].Springer Semin Immunopathol,2004,25:335.
[14]Umetsu SE,Lee WL,McIntire JJ,et al.TIM-1induces T cell activation and inhibits the development of peripheral tolerance[J].Nat Immunol,2005,6:447.
[15]Sanchez-Fueyo A,Tian J,Picarella D,et al.Tim-3inhibits T helper type 1-mediated auto-and alloimmune responses and promotes immunological tolerance[J].Nat Immunol,2003,4:1093.
[16]Monney L,Sabatos CA,Gaglia JL,et al.Th1-specific cell surface protein Tim-3regulates macrophage activation and severity of an autoimmune disease[J].Nature,2002,415:536.
[17]Sabatos CA,Chakravarti S,Cha E,et al.Interaction of Tim-3 and Tim-3ligand regulates T helper type 1responses and induction of peripheral tolerance[J].Nat Immunol,2003,4:1102.
[18]Zhu C,Anderson AC,Schubart A,et al.The Tim-3ligand galectin-9negatively regulates T helper type 1immunity[J].Nat Immunol,2005,6:1245.
[19]Meyers JH,Chakravarti S,Schlesinger D,et al.TIM-4is the ligand for TIM-1,and the TIM-1-TIM-4interaction regulates T cell proliferation[J].Nat Immunol,2005,6:455.
[20]Yang PC,Xing Z,Berin CM,et al.TIM-4expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy[J].Gastroenterology,2007,133:1522.
[21]Rodriguez-Manzanet R,Meyers JH,Balasubramanian S,et al.TIM-4expressed on APCs induces T cell expansion and surviv-al[J].J Immunol,2008,180:4706.
[22]Anderson AC,Xiao S,Kuchroo VK.Tim protein structures reveal a unique face for ligand binding[J].Immunity,2007,26:273.
[23]Bustin SA.Developments in real-time PCR research and molecular diagnostics[J].Expert Rev Mol Diagn,2010,10:713.
[24]Ratcliff RM,Chang G,Kok T,et al.Molecular diagnosis of medical viruses[J].Curr Issues Mol Biol,2007,9:87.
[25]Wong ML,Medrano JF.Real-time PCR for mRNA quantitation[J].Biotechniques,2005,39:75.
[26]Johnson VJ,Yucesoy B,Luster MI.Genotyping of single nucleotide polymorphisms in cytokine genes using real-time PCR allelic discrimination technology[J].Cytokine,2004,27:135.
[27]Bustin SA,Benes V,Nolan T,et al.Quantitative real-time RTPCR-aperspective[J].J Mol Endocrinol,2005,34:597.

