胃痛消痞方對肝郁脾虛型功能性消化不良大鼠血清及胃竇組織中NT、SP含量的影響
吳艷慧,于文靖,陳蘇寧
功能性消化不良(FD)是一組無胃腸道器質性病變,以持續性腹痛、腹脹、早飽、惡心嘔吐、噯氣、反酸、燒心、食道異物感等為表現的臨床癥候群,其發生與胃腸動力障礙密切相關。胃腸激素是影響胃腸動力的重要因素,神經降壓素(Neurotensin)對其具有抑制作用,P物質(P-substance)是胃腸運動重要的興奮性神經遞質。祖國醫學將FD歸屬于“胃脘痛”和“痞滿”等范疇,其主要病機是肝郁氣滯、脾胃虛寒。本實驗通過觀察胃痛消痞方對肝郁脾虛型FD大鼠血清及胃竇中NT、SP含量的影響,探討肝郁脾虛型FD的發病機制,旨在指導其臨床治療。
1 實驗材料
1.1 動物 健康SPF級Wistar雄性大鼠40只,12周齡,體質量為250~280 g。
1.2 藥物 胃痛消痞方由柴胡、白芍、延胡索、枳實、砂仁、炒麥芽、焦山楂、炒雞內金、黨參、炒白術、炙甘草組成,由深圳華潤三九醫藥集團提供免煎顆粒,用蒸餾水稀釋成濃度為0.5 g/mL的溶液,4℃冰箱保存;西沙必利片為上海滬源醫藥有限公司產品,給藥前用蒸餾水稀釋成0.02 g/mL的溶液。
1.3 試劑 NT、SP酶聯免疫吸附測定(Enzymelinked immunosorbent assay,ELISA)試劑盒由美國RD公司提供;NT、SP抗體由北京博奧森生物技術有限公司提供,SP免疫組化染色試劑盒由北京中杉金橋生物技術有限公司提供。
1.4 儀器 ELx808吸收光酶標儀、D-37520 Heraeus高速冷凍離心機、DH4000A電熱恒溫培養箱、TB-718D生物組織自動包埋機、Mettler-Tole-DO AL104型電子天平、TK-218型恒溫攤片烤片機、ZT-12M 生物組織自動脫水機、Microm HM340E半自動輪轉切片機、NIKON E800光學顯微鏡。
2 實驗方法
2.1 造模及給藥 將大鼠采用隨機數字表方法隨機分為4組,即胃痛消痞方(中藥)組、西沙必利(西藥)組、模型組、正常對照組,每組10只。除正常對照組外,其余3組均采用改良夾尾刺激法[1]制造FD肝郁脾虛模型,每次夾尾刺激持續30 min,2次/d,連續刺激21d。造模成功后,將胃痛消痞方、西沙必利依據人和鼠給藥劑量換算公式[2]dB=dARB/RA(WA/WB)1/3 進行計算,中藥組給予胃痛消痞方9 g/kg,1次/d,西藥組給予西沙必利2 mg/kg,模型組及正常對照組給予灌服等量蒸餾水,1次/d灌胃,持續21d。
2.2 實驗步驟
2.2.1 ELISA法檢測血清中NT含量 分別設空白孔、標準品孔、待測樣本孔,記錄各孔位置。在標準品孔中加標準品50 μL,待測樣品孔加入各組血清40 μL,然后各加入抗-NT 抗體10 μL、鏈霉素親和素-HRP50 μL,空白對照孔不加,蓋上封板膜,輕輕振蕩混勻,37℃溫育60 min。小心揭掉封板膜,棄去液體,吸水紙上拍干,每孔加滿洗滌液,靜置30 s,甩去洗滌液,吸水紙上拍干,如此重復洗板4次。每孔先加入顯色劑A液50 μL,再加入顯色劑B液50 μL,用手輕輕震蕩混勻30 s,37℃避光顯色15 min。每孔加終止液50 μL,終止反應,此時藍色立轉黃色。以空白孔調零,450 nm波長依序測量各孔的OD值。測定應在加終止液后15 min內進行,根據標準品的濃度及對應的OD值計算出標準曲線的直線回歸方程,再根據樣品的OD值在回歸方程上計算出對應的樣品濃度。
2.2.2 按“2.2.1”項方法檢測血清中SP含量。
2.2.3 免疫組化法測定胃竇組織中NT、SP含量標本固定后進行梯度脫水,石蠟包埋,切片厚度為5 μm,常規脫蠟至水。用3%H2O2室溫孵育10 min以滅活內源性酶,PBS洗3次。將切片浸入0.01 mol檸檬酸鈉緩沖液(pH值6.0),電爐加熱至沸騰后斷電,5 min后取出置室溫冷卻。冷卻后PBS洗滌3次,3 min/次。滴加正常山羊血清封閉液,室溫孵育20 min,甩出多余液體。滴加適當稀釋的一抗(分別為兔抗大鼠NT抗體和兔抗大鼠SP抗體),4℃ 冰箱過夜。取出后PBS洗3次,3 min/次。滴加生物素化山羊抗兔IgG,室溫孵育20 min,PBS洗3次,3 min/次。滴加試劑辣根酶標記鏈霉卵白素工作液,室溫孵育20 min,PBS洗3次,3 min/次。取1 mL蒸餾水,加DAB顯色試劑盒A、B、C試劑各1滴,混勻后加至切片,室溫顯色,鏡下控制反應時間30 s。蘇木素輕度復染1 min,脫水,透明,封片,晾干,用光學顯微鏡(10×40倍)觀察胃腸組織中NT、SP陽性產物的分布。用HUMIAS-2000醫學圖文分析系統,通過顯微攝像系統放大400倍,每張切片隨機選取5個無重疊視野,測定胃竇及十二指腸組織中NT、SP陽性纖維的平均灰度值,以此分別代表NT、SP的含量。
2.3 統計學方法 采用SPSS 16.0軟件進行統計學分析,計量資料以表示,P<0.05為差異有統計學意義。
3 結果
3.1 模型組血清、胃組織中NT含量明顯升高,與正常對照組比較,差異有統計學意義(P<0.01),說明造模成功。經治療后,中藥組、西藥組NT含量均明顯降低,與模型組比較,差異有統計學意義(P<0.01);中藥組和西藥組比較,差異有統計學意義(P<0.05)。見表1。

表1 大鼠血清、胃組織中NT含量(mg/L)
3.2 模型組血清、胃組織中SP含量明顯降低,與正常組比較,差異有統計學意義(P<0.01),表明造模成功。經治療后,中藥組、西藥組SP含量明顯升高,與模型組比較,差異有統計學意義(P<0.01);中藥組和西藥組比較,差異有統計學意義(P<0.05)。見表2。

表2 大鼠血清、胃組織中SP含量(mg/L)
3.3 每張切片于400倍光鏡下隨機選取5個視野,分別觀察其陽性產物的分布、染色情況,光鏡下,大鼠胃組織中NT、SP染色部位在胞漿,胞大而核圓,棕色或深黃色為強陽性,黃色為陽性,淡黃色為弱陽性。見圖1。
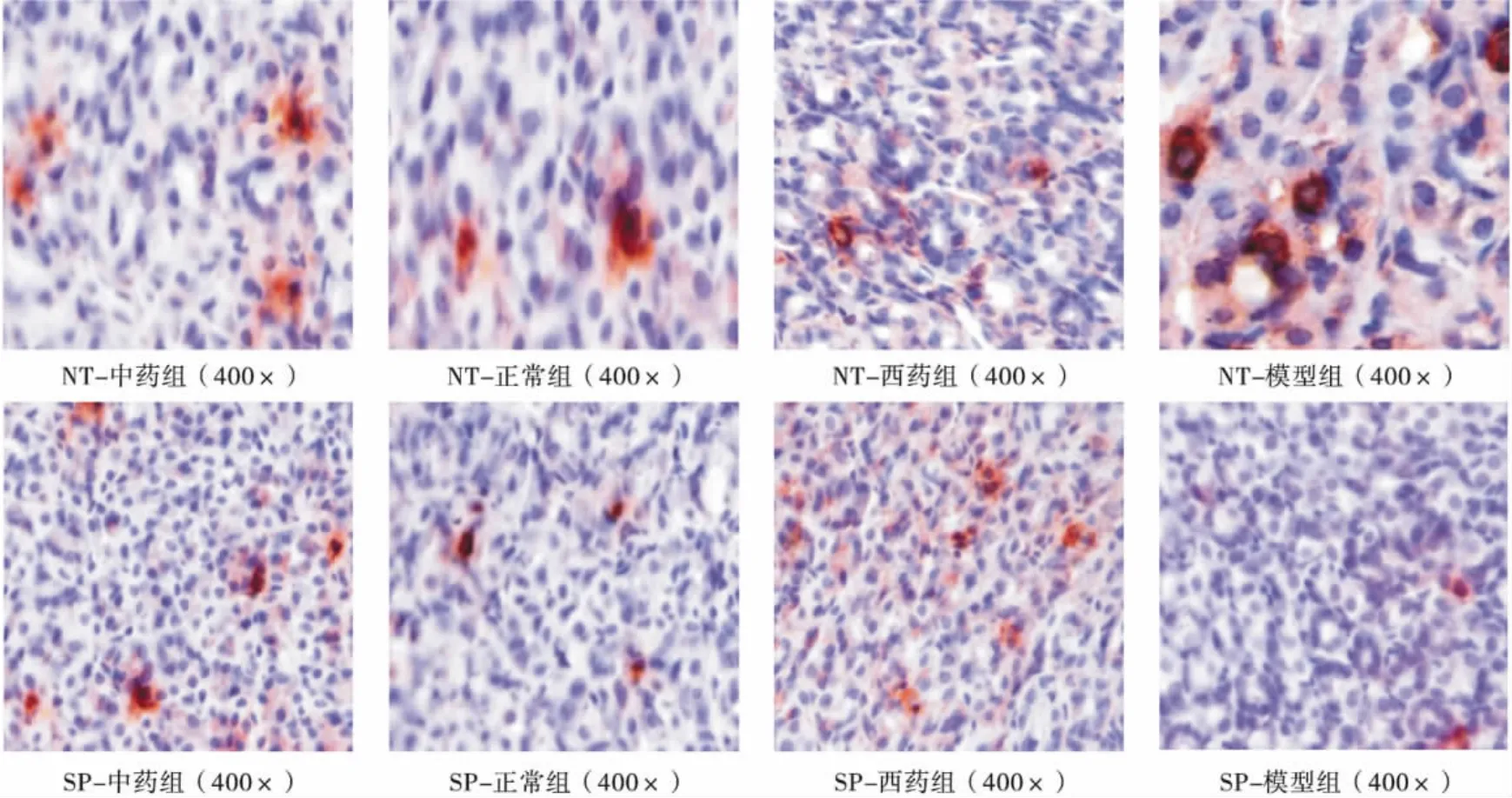
圖1 四組光鏡下NT、SP的分布及染色情況
4 討論
胃痛消痞方由柴胡、白芍、延胡索、炒枳實、砂仁、炒麥芽、焦山楂、炒雞內金、黨參、炒白術、炙甘草組成。柴胡可疏肝行氣解郁,配伍陳皮理氣降逆,共為君藥;厚樸、炒枳實、山楂、神曲、炒麥芽、炒白術、砂仁可燥濕除滿、理氣和中、消食,共為臣藥;白芍功善養血柔肝、補陰抑陽,為佐藥;甘草調和全方。諸藥共奏疏肝理氣、和胃健脾之功,使肝疏泄條達、脾升胃降得復,紊亂的消化功能得以恢復。本實驗采用夾尾法使大鼠激怒,進而肝氣不舒,肝郁犯脾,脾失健運,從而建立了肝郁脾虛型FD大鼠模型,治法當以疏肝健脾為主。
1975年Carraway等確定NT為13個氨基酸組成的直鏈多肽,由開放型的N細胞分泌,而約85%的N細胞存在于胃腸道。既往已有較多研究表明,NT 可抑制胃腸道運動,延緩胃排空[3-5]。Nightingale等[6]發現,回腸切除術后的患者,由于N細胞減少,血漿NT水平降低,從而導致液體在胃中排空加速。SP主要存在于中樞神經系統和腸道神經系統,小部分分布于腸嗜鉻細胞,是腸道感覺神經系統的重要組成部分,與痛覺傳導有關,可能參與各種內臟神經反射,能促進腸道平滑肌收縮和腸蠕動,促進胃排空[7-8],并且能刺激膽囊收縮。也有研究證明,SP是胃腸運動調節中主要的興奮性神經遞質,存在于腸肌神經叢內的SP神經細胞體發出神經纖維到腸壁各層,可能參與各種內臟神經反射,并通過特異的神經通路來促進胃腸道平滑肌收縮和腸蠕動,調節胃腸動力和排空功能[9]。
本研究結果顯示,模型組血清NT含量與正常對照組相比明顯升高,SP含量降低,模型組大鼠較正常組相比胃竇及十二指腸部NT陽性免疫產物增多,SP陽性免疫產物明顯減少,說明NT升高、SP降低均可能是引起FD的原因。治療后,中藥組、西藥組NT含量均明顯降低,SP含量明顯升高,亦證實了上述觀點,從而進一步驗證了神經降壓素及P物質是FD發病的神經生物學基礎。
綜上所述,本實驗結果為中藥胃痛消痞方的臨床應用及今后進一步研究提供了重要依據。
[1]郭海軍,林潔,李國成.功能性消化不良的動物模型研究[J].中國中西醫結合消化雜志,2001,9(3):141-142.
[2]孫敬方.動物實驗方法學[M].北京:人民衛生出版社,2001:357.
[3]Bardella MT,Fraquelli M,Peracchi M,et al.Gastric emptying and plasma neurotensin levels in untreated celiac patients[J].Scand J Gastroenterol,2000,35(3):269-273.
[4]Naslund E,Gryback P,Backman L,et al.Distal small bowel hormones:correlation with fasting antroduodenal motility and gastric emptying[J].Dig Dis Sci,1998,43(5):945-952.
[5]Sato F,Marui S,Inatomi N,et al.EM574,an erythromycin derivative,improves delayed gastric emptying of semi-solid meals in conscious dogs[J].Eur J Pharmacol,2000,395(2):165-172.
[6]Nightingale JM,Kamm MA,Van der Sijp JR,et al.Gastrointestinal hormones in short bowel syndrome.Peptide YY may be the‘colonic brake’to gastric emptying[J].Gut,1996,39(2):267-272.
[7]Lordal M,Theodorsson E,Hellstrom PM.Tachykinins influence interdigestive rhythm and contractile strength of human small intestine[J].Dig Dis Sci,1997,42(9):1940-1949.
[8]Wheatley JM,Hutson JM,Chow CW,et al.Slow-transit constipation in childhood[J].J Pediatr Surg,1999,34(5):829-833.
[9]Stark ME,Szurszewski JH.Role of nitric oxide in gastrointestinal and hepatic function and disease[J].Gastroenterology,1992,103(6):1928-1949.

