hTERT啟動子引導hNIS基因重組腺病毒介導放射性核素的裸鼠顯像
趙興業,李 瑋,譚 建,王 澎,李 寧
(天津醫科大學總醫院核醫學科,天津300052)
報告基因指其表達產物非常容易被檢測的基因。報告基因顯像則是通過將報告基因轉染給靶細胞后,通過檢測報告基因從而顯影的一種方法。現有的報告基因如熒光素酶、轉鐵蛋白、鈉碘轉運體(NIS)等,可以通過光學成像,核素顯像,MRI等方法進行檢測[1-2]。其中,NIS基因因為可將細胞外的碘轉運進入細胞內,所以可以方便地進行放射性核素顯像。在既往研究中已證明使用脂質體可在體外將NIS基因轉入大細胞肺癌細胞內,用篩選后的腫瘤細胞構建荷瘤裸鼠模型,進行放射性核素顯像[3]。但是,該研究存在脂質體不能進行體內轉染的問題。為解決以上問題,構建重組腺病毒Ad-hTERT-hNIS(hTERT啟動子引導hNIS基因表達的Adeasy系統重組腺病毒),并利用該重組腺病毒能實現體內靶向hNIS基因表達的特點對端粒酶陽性膠質瘤U87荷瘤裸鼠進行體內轉染及核素顯像。惡性膠質瘤是最常見的原發性中樞神經系統腫瘤,雖然可以通過手術、放療、化療、抗腫瘤藥物得到治療,但是遠期效果很差,致死率高,易發生轉移[4-5]。將hNIS基因作為報告基因的核素顯像技術應用于膠質瘤核素顯像,開拓了靶向性核素顯像的新思路。
1 材料與方法
1.1 材料與儀器 U87細胞系由本實驗室保存,并于37℃、5%CO2的培養箱中,使用含10%胎牛血清(fetalbovine serum,FBS)的達氏修正依氏培養液(Dulbecco’smodified Eagle’smedium,DMEM) 中培養。重組腺病毒Ad-hTERT-hNIS等均由本實驗室保存。BALB/c品系裸鼠購自中國醫學科學院中國協和醫科大學北京實驗動物中心,飼養于天津醫科大學實驗動物中心。SPECT(Discovery VH)為美國GE公司產品。
1.2 方法
1.2.1 重組腺病毒的擴增 將U87細胞接種于25 cm2培養瓶中,培養24 h至細胞達到60%融合。取病毒液Ad-hTERT-hNIS和Ad-CMV-EGFR感染U87細胞,待轉染7~10 d后,收集細胞并反復凍融,12 000 r/min離心后收集病毒上清。如此反復數次后,擴增病毒至所需滴度,即5×109PFU。
1.2.2 測定轉染后U87細胞攝碘率[6]將U87細胞在6孔板上培養至80%融合,Ad-hTERT-hNIS和Ad-CMV-EGFR按50感染復數(multiplicity of infection,MOI)的病毒梯度來轉染并孵育1 h后更換為10%FBS的新DMEM培養基,繼續培養24 h后,進行攝碘率測定。將18.5 kBq125I/孔U87細胞孵育40min,使用磷酸鹽緩沖溶液(phosphate buffered solution,PBS)沖洗2遍后,使用γ計數器測定每孔細胞的每分鐘放射性計數(countperminute,CPM)值。
1.2.3 Western blot檢測hNIS蛋白表達 提取細胞總蛋白,然后采用10%十二烷基硫酸鈉--聚丙烯酰胺凝膠電泳(SDS-PAGE),轉聚偏二氟乙烯(polyvinylidene fluioride,PVDF)膜,5%脫脂牛奶4℃封閉過夜。選取Santa cruz公司的sc-48055為NIS基因一抗,美國Santa cruz的sc-2004為NIS基因二抗。然后加入ECL化學發光反應液(美國Thermo),室溫1min。
1.2.4 膠質瘤荷瘤動物模型的構建 選取4周齡BALB/c雌性裸鼠每組4只,將1mL約5×106的U87膠質瘤細胞進行右肩胛皮下注射,當裸鼠皮下腫瘤長至直徑10mm(約注射后3周),將重組腺病毒 Ad-hTERT-hNIS和 Ad-CMV-EGFR(5×109PFU/50μLPBS)分別進行裸鼠瘤內注射。U87細胞接種裸鼠同時開始封閉甲狀腺,在裸鼠飲水中加入優甲樂(L-T4)5mg/L,持續至實驗結束,以減少甲狀腺攝碘量從而最大限度地增加轉染腫瘤的攝碘率。
2 結果
2.1 測定U87細胞攝碘率 轉染Ad-hTERT-hNIS的U87細胞系的攝125I活性為 10 569.3±203.2,轉染Ad-CMV-EGFR的U87細胞系的攝125I活性為480.0±25.7。轉染hNIS基因后的U87細胞攝碘能力較對照組提高約22倍左右(t=101.23,P<0.01),表明經重組腺病毒轉染后的hNIS基因具有攝碘功能;hTERT啟動子在腫瘤細胞內能夠有效地啟動hNIS基因表達。
2.2 Western blot檢測 使用 Western blot分析hNIS基因蛋白質表達水平。在U87細胞系中,hNIS蛋白在70 kDa有表達帶,見圖1。

3 討論
報告基因顯像是一種分子水平顯像方法。隨著研究的深入,人們逐漸發現了一些問題:如現有的報告顯像基因進入人體需要合適的載體。目前常用的載體有脂質體和病毒,但可惜的是,脂質體載體不能進行基因活體轉染;病毒載體中腺病毒等非逆轉錄病毒載體只能實現瞬時表達[8];慢病毒載體等逆轉錄病毒載體,雖能實現穩定表達,但因其安全性問題和出毒量低等問題,也不十分理想。
PET和SPECT等核醫學設備因具有高靈敏度更方便進行相關報告基因顯像[9]。NIS基因已經被證明具有作為報告基因的潛力。NIS基因能表達一種膜蛋白并將細胞外碘轉入細胞內,該蛋白能介導放射性核素進行顯像,如適用于SPECT的131I和123I,適用于PET的124I等。雖然NIS最重要的生理作用是轉運碘,但也能轉運其他結構類似的陰離子,如不僅與碘具有類似的理化性質,而且在放射性核素顯像中具有相似的生物分布,所以同樣可用于顯像[10]。NIS基因作為一種報告基因具有非免疫原性、生理性表達只限于特定組織器官的優點[11]。
hTERT啟動子等腫瘤特異性啟動子,用來在膠質瘤中誘導特定基因表達的基因治療已得到了證實[12]。如Takeuchi等[13]已證實使用hTERT啟動子系統誘導半胱天冬酶 (caspase)治療膠質瘤獲得成功等。hTERT啟動子在腫瘤目標性治療中是一個很有希望的腫瘤選擇性啟動子[14-15]。
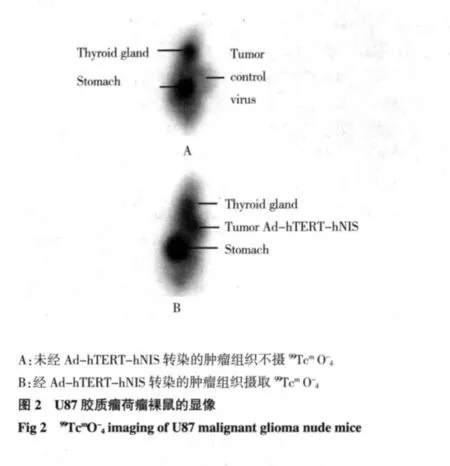
此次研究是利用重組腺病毒在端粒酶陽性的膠質瘤U87荷瘤裸鼠進行體內轉染及核素顯像的可能性進行的。在前期研究中已發現使用hTERT啟動子限制hNIS基因表達的腺病毒Ad-hTERT-hNIS,可以實現在端粒酶陽性的膠質瘤細胞中引導hNIS基因的表達,而在端粒酶陰性的MRC-5細胞中則不能達到表達hNIS基因的目的。通過進行體內顯像實驗,發現Ad-hTERT-hNIS轉染荷瘤裸鼠24 h后可以實現荷瘤裸鼠體內轉染和顯像,但因為載體本身的限制,顯像時間很有限,超過一定時間后就不再能進行顯像。因為正常甲狀腺組織具有選擇性攝取和濃聚99Tcm的能力,雖然事先對裸鼠的甲狀腺進行了左甲狀腺素屏蔽,但是屏蔽效果不理想,在裸鼠顯像中仍可看見裸鼠甲狀腺顯影。這都是在今后需要研究的問題。
[1]Kang JH,Chung JK.Molecular-genetic imaging based on reporter geneexpression[J]. JNuclMed,2008,49(Suppl2):S164
[2]Harney A S,Meade T J.Molecular imaging of in vivo gene expression[J].FutureMed Chem,2010,2(3):503
[3]鄭薇,譚建,李瑋,等.裸鼠模型的人鈉/碘轉運體基因轉染人大細胞肺癌介導放射性核素顯像[J].中國醫學影像技術,2009,25(1):7
[4]Omay S,Vogelbaum M.Current concepts and newer developments in the treatmentofmalignantgliomas[J].Indian JCancer,2009,46(2):88
[5]Lim SK,Llaguno SR,McKay RM,etal.Glioblastomamultiforme:a perspectiveon recent findings in human cancer andmousemodels[J].BMBRep,2011,44(3):158
[6]Kim K,Kang J,Chung J,etal.Doxorubicin enhances theexpression of transgene under control of the CMV promoter in anaplastic thyroid carcinoma cells[J].JNuclMed,2007,48(9):1553
[7]Ma X,Huang R,Kuang A.AFPpromoter enhancer increased specific expression of thehuman sodium iodide symporter(hNIS)for targeted radioiodine therapy of hepatocellular carcinoma[J].Cancer Invest,2009,27(6):673
[8]裴之俊,張永學.報告基因顯像監測干細胞治療的研究進展[J].國際放射學核醫學雜志,2010,34(2):73
[9]Liu H,Ren G,Liu S,etal.Optical imaging of reporter gene expression using a positron-emission-tomography probe[J].J Biomed Opt,2010,15(6):060505
[10]Zuckier LS,Dohan O,LiY,etal.Kineticsofperrhenateuptakeand comparativebiodistribution ofperrhenate,pertechnetate,and iodide by NaIsymporter-expressing tissues in vivo[J].JNuclMed,2004,45(3):500
[11]Tumeh P C,Radu C G,Ribas A.PET imaging of cancer immunotherapy[J].JNuclMed,2008,49(6):865
[12]Kim SH,Chung H K,Kang JH,etal.Tumor-targeted radionuclide imagingand therapy based on human sodium iodide symportergene driven by amodified telomerase reverse transcrip tase promoter[J].Hum Gene Ther,2008,19(9):951
[13]Takeuchi H,Kanzawa T,Kondo Y,et al.Combination of caspase transfer using the human telomerase reverse transcriptase promoter and conventional therapies formalignantglioma cells[J].Int JOncol,2004,25(1):57
[14]Carpentier C,Lejeune J,Gros F,et al.Association of telomerase genehTERTpolymorphism andmalignantgliomas[J].JNeurooncol,2007,84(3):249
[15]Riesco-Eizaguirre G,De la Vieja A,Rod rígu ez I,et al.Telomerase-driven expression of the sodium iodide symporter(NIS)for in vivo radioiodide treatment of cancer:A new broad-spectrum NIS-mediated antitumorapproach[J].JClin EndocrinolMetab,2011,96(9):E1435

