雙核鎳配合物[Ni2(Htda)2(H2O)6]·4H2O與DNA作用和細胞凋亡研究
武光磊, 湛 琳, 徐 進, 高恩軍
(沈陽化工大學配位化學研究室沈陽市無機分子基材料化學(國際)重點實驗室,遼寧沈陽 110142)
DNA是生物體中重要的一類生物大分子,對于生命遺傳密碼的翻譯、轉錄、復制起著非常重要的作用.順鉑(cis-DDP),奧沙利鉑、卡鉑等鉑配合物作為廣譜抗腫瘤藥物在臨床上的廣泛應用,促使很多研究者研究了大量金屬配合物與DNA的反應,探討金屬配合物與DNA作用的反應機理,進而研究金屬配合物的分子結構及與DNA反應機理的關系,為篩選出新的生物學研究工具,設計合成出具有應用前景的低毒、高效、抗菌、抗腫瘤藥物提供一定的科學研究基礎及理論根據[1-5].
1,2,3-三氮唑-4,5-二羧酸存在眾多配位原子,可分步失去質子,表現出靈活多變的配位方式.配體本身具有較好的水溶性,其氮氧原子易分別與親氮和親氧離子配位,其2-位氮原子還可提供氫鍵作用或配位作用.此外,基于Htda有機分子配體配合物性質的報道目前還很少,本文參照文獻[6]合成雙核鎳(Ⅱ)金屬配合物[Ni2(Htda)2(H2O)6]·4H2O.Barton 等人[7]提出[Ru(phen)3]2+與DNA作用時有插入和靜電作用2 種模式,Norden 等人[7]則認為[Ru(phen)3]2+與DNA 作用時只存在靜電作用1種模式[1,6].金屬配合物與DNA之間的作用機理與模式一直存在一定的爭議,針對此問題用紫外分光光度法、熒光分光光度法和凝膠電泳法對雙核鎳(Ⅱ)金屬配合物[Ni2(Htda)2(H2O)6]·4H2O與DNA之間的相互作用進行研究,研究結果顯示此配合物主要以靜電作用與DNA結合,但也存在一定的插入作用.此外,對配合物引發細胞凋亡的能力與順鉑做比較,結果顯示細胞凋亡效果明顯區別于順鉑.
1 實驗部分
1.1 儀器
PXJ21C數字顯示離子計,配丹麥2401B型Ag/AgCl復合電極;Nicolet IR2470型紅外光譜儀,KBr壓片;Bruker CCD晶體衍射儀;UV-240島津近紅外可見紫外分光光度計,日本島津;PerkinElmer熒光分光光度計,美國鉑金埃爾默;培清凝膠成像分析系統,上海培清.
1.2 試劑
小牛胸腺DNA,國藥集團產品;Hela細胞DNA,本實驗室自己提取,相對分子質量大于30 000,用前作進一步稀釋處理,純度以260 nm處吸光度與280 nm處吸光度的比值檢測(A260/A280=1.9);其他試劑均為分析純.
1.3 配合物的合成
按文獻[7]方法合成雙核鎳(Ⅱ)金屬配合物[Ni2(Htda)2(H2O)6]·4H2O,元素分析、單晶衍射和紅外吸收光譜與文獻[7]報道一致.
1.4 實驗過程
研究配合物與DNA的作用時,樣品均溶解在含5 mmol·L-1Tris(三羥甲基氨基甲烷)和50 mmol·L-1NaCl的二次蒸餾水緩沖液(pH=7.10)中,小牛胸腺DNA和Hela細胞DNA的濃度以ε260=6 600 L·mol-1·cm-1確定.
2 結果與討論
2.1 配合物的結構
從圖1可看出,2個金屬Ni(Ⅱ)原子分別與4個氧原子(3個來自水分子,1個來自Htda配體)和2個氮原子(分別來自2個Htda配體)配位螯合成2個五元環和1個六元環的近平面穩定結構.在配合物的單元分子中,存在4個游離水分子,為維系空間結構穩定性氫鍵的形成提供基石.在Ni(1)和Ni(2)兩個鎳原子形成的配位鍵中,Ni(1)—N(3)和Ni(1)—N(5)的鍵長分別 為 0.206 67 nm 和 0.205 03 nm,Ni(2)—N(2)和 Ni(2)—N(4)的鍵長分別為0.202 95 nm和0.206 19 nm,N(5)—Ni(1)—N(3)和N(2)—Ni(2)—N(4)的鍵角分別為96.000°和96.477°,二者都存在略微的差異,同樣Ni(1)和Ni(2)與氧原子之間的配位也存在略微的差別,但整個配合物近乎是一個對稱結構.水分子的體積忽略,則可看做一個大五元環六元環交錯的平面矩形.配合物的部分晶體數據如下:空間群:C2/c;F(000):2 504;衍射映像/獨特性:11 954/3 762[R(int)=0.029 2];完整性,%:99.6;擬合度 F2:1.058;數據/限制/參數:3 762/4/360;R最終指數(I>2σ(I)):R1=0.317,wR2=0.074 9;R指數(所有數據):R1=0.039 9,wR2=0.080 4.
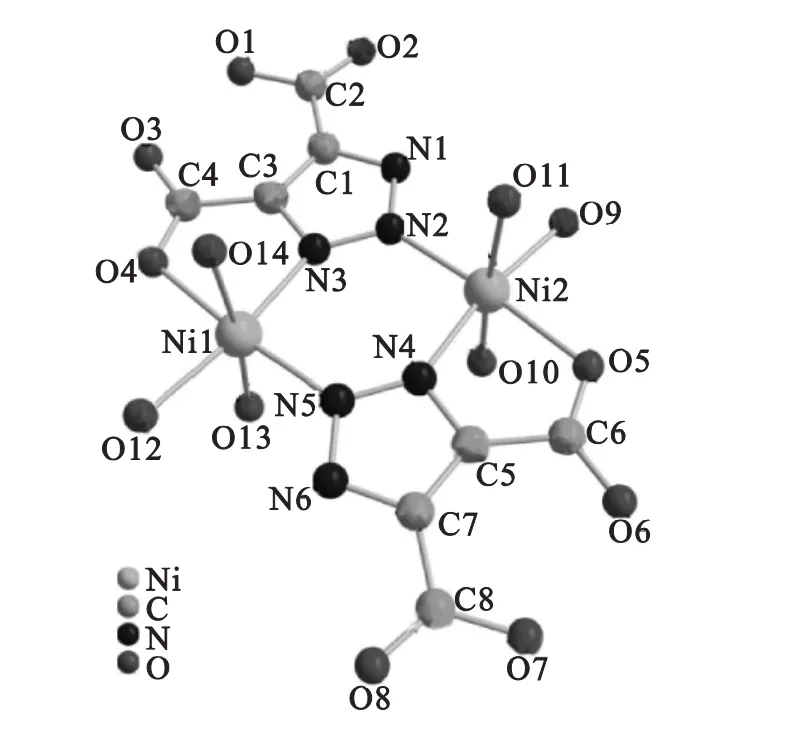
圖1 配合物單元結構(氫原子被省略)Fig.1 Complexes with structural(H atoms are omitted)
2.2 紫外光譜法研究雙核鎳(Ⅱ)配合物與小牛胸腺DNA作用
紫外光譜法是很多種檢測配合物與DNA作用的方法之一[8].含有堿基生色團的雙螺旋結構DNA分子,其UV/Vis吸收光譜在260 nm附近有一強吸收峰,當小分子與核酸結合后,對核酸或小分子吸收峰的吸收光譜都會引起變化,可根據相互作用前后DNA或其他分子的吸收譜帶的變化對金屬配合物與作用模式進行判斷.對于DNA的吸收光譜:如導致構象變化,則產生減色效應和紅移現象,且作用越強減色效應越明顯;如導致DNA雙螺旋結構的破壞,則產生增色效應[9].對于金屬配合物等小分子的特征吸收譜帶,當金屬配合物嵌插到DNA堿基對中,即發生插入作用時,將會發生減色效應,這是因為DNA堿基對與插入配體間發生π電子堆積,使后者的π*空軌道上也有一定的電子填充,從而使電子從金屬轉移到配體上躍遷(MLCT躍遷)的幾率減少.減色效應的強弱,能夠反映插入能力的大小,插入能力越強,減色效應越強.與DNA發生插入作用后的配合物,插入配體與DNA堿基對間發生π電子堆積后,配合物的配體共軛性加強,產生紅移現象,紅移程度反映出插入能力的大小.插入能力強的配合物,紅移較大,插入能力弱的配合物,紅移較小[10].
配合物與小牛胸腺DNA作用的紫外光譜圖見圖2.配合物在波長為210~360 nm的紫外范圍內有明顯的特征吸收峰,為芳香氮堿配體內的n-π*電子躍遷形成,DNA的摻入使配合物各特征吸收峰在波長發生明顯的減色效應,DNA濃度越大,趨勢越明顯,并有等色點生成.說明配合物與DNA之間建立了新的平衡關系,生成新的化合物物種.配合物以靜電方式與DNA螺旋堿基對結合,發生孤對電子靜電吸引作用,配體上孤對電子數目減少,使n-π*躍遷幾率減小,產生減色效應.

圖2 配合物與DNA作用的紫外光譜圖Fig.2 UV spectra of complex with DNA
2.3 熒光光譜法研究雙核鎳(Ⅱ)配合物與小牛胸腺DNA的作用
溴化乙錠(EB)具有共軛芳香環的平面結構,能專一平行地嵌入DNA雙鏈的配對堿基之間.在水溶液中,其本身熒光極弱,而DNA分子幾乎沒有熒光.但當溴化乙錠插入雙鏈DNA分子之后,溴化乙錠分子借助其與堿基之間的堆積作用而能平行地“固定”在DNA分子內部,從而使溴化乙錠分子平面剛性增加,碰撞淬滅減小,發出的熒光強度大概提高了10倍[11].溴化乙錠不能插入單鏈DNA中,而只能插入雙螺旋DNA分子中,因為它與DNA的插入作用是通過堿基間堆積而產生的.因而溴化乙錠是一種能與DNA雙鏈發生專一插入作用,且選擇性好,靈敏度高的熒光探針.
如果配合物是以插入方式與DNA結合,那么就能與DNA發生類似EB的插入作用,從而競爭EB與DNA結合的位點,釋放出EB,使EB/DNA復合體系熒光減弱:M+EB·DNA=M·DNA+EB.根據經典斯特恩-沃爾默(Stern-Volmer)方程[12]:I0/I=1+Ksq·r. 其中:I和 I0分別代表復合物(配合物/EB/DNA)中存在和不存在配合物時的熒光強度;r為復合物中配合物與小牛胸腺DNA的濃度比;Ksq表示斯特恩-沃爾默(Stern-Volmer)淬滅常數,其可以定量描述配合物與DNA的作用強弱.從Ksq值的大小就可以定量地比較幾個化合物在相同條件下與DNA作用的強弱程度,Ksq值越大,作用強度越大,結合能力越強.
配合物與DNA作用的熒光光譜圖見圖3.

圖3 配合物對DNA-EB體系熒光強度的影響Fig.3 Emission spectrum of EB bound to DNA in the presence of the complex
從圖3可以看出,隨著配合物濃度的增加,DNA-EB復合物的體系熒光強度逐漸減弱,且發生了一定程度的淬滅,并且濃度越大,熒光猝滅逐漸趨于平衡.當配合物的濃度逐漸增加到最大時,配合物把DNA-EB復合物體系的熒光強度約由135淬滅到115,下降幅度為20.由斯特恩-沃爾默(Stern-Volmer)方程作圖,見圖4.配合物的斯特恩-沃爾默淬滅常數值(Ksq)為0.053 0.這一現象說明配合物與DNA發生了一定程度的插入作用,但作用微弱,說明配合物分子與DNA結合主要以靜電模式,同時存在一定的插入作用.

圖4 配合物對DNA-EB體系作用的stern圖Fig.4 Interaction with the DNA-EB system
2.4 凝膠電泳技術研究雙核鎳(Ⅱ)配合物對Hela細胞DNA的切割作用
在外電場作用下,帶電荷物質會向著與其所帶電荷電性相反的電極移動.DNA中存有親水性的磷酸基團,在高于其等電點的緩沖溶液中帶負電荷,從而使DNA在電場中通過凝膠介質向正極泳動.影響DNA在凝膠介質中移動的因素主要有電荷效應、凝膠介質的分子篩效應.在電荷相同的條件下,凝膠介質的分子篩效應至關重要,其與相對分子質量大小及構型有關;相對分子質量越小,空間構型產生的空間位阻越小,遷移位置就越靠前,而DNA帶間的距離也就越大.當共價閉環型DNA的一條鏈上出現一個缺口時,超螺旋結構解開,形成開環型結構;若2條鏈在同一位置發生斷裂時,則成為線形分子.某些能插入DNA雙螺旋堿基對之間的試劑如EB、放線菌素D可以改變DNA的超螺旋狀態,使負超螺旋減少,以至完全松開形成單鏈開環結構,甚至形成正超螺旋,進而能通過凝膠電泳實驗表現出來[13-14].基于上述原理及前面的熒光法實驗結果,以凝膠電泳實驗來研究配合物對DNA的切割作用.
配合物的凝膠電泳實驗結果見圖5.在圖5中,Lane 0是純的 DNA,Lane 1~4分別為10 μmol/L、5 μmol/L、2.5 μmol/L、1.25 μmol/L 的配合物與DNA在有氧條件下反應2 h的電泳圖像.隨著配合物濃度的增大,配合物使質粒DNA的超螺旋帶(FormⅠ)和開環帶(FormⅡ)沒有明顯增多,而且無線性帶(FormⅢ)出現.此結果可以看出,配合物對DNA的切割能力比較微弱,這個結果與上述的熒光淬滅實驗中的趨勢相一致,原因很有可能是 1,2,3-三氮唑-4,5-二羧酸是一個富電子的小平面結構配體,配合物與DNA結合模式主要以靜電作用為主,插入作用相對較弱.

圖5 配合物對Hela DNA切割作用的電泳圖Fig.5 Cleavage of Hela DNA in the presence of complex
2.5 雙核鎳(Ⅱ)配合物對Hela細胞的形態學影響研究
細胞凋亡[15-17],又稱細胞程序性死亡,是指細胞在一定的生理和病理條件下,遵循自身的程序,自己結束其生命的過程.細胞凋亡不同于細胞壞死,是程序性死亡過程的一種主要形式,強調的是形態學上的改變.將處理好的爬片放在光學顯微鏡下進行觀察、拍照.從圖6(a)可以看出,正常Hela細胞在染色后呈不規則的多角形,細胞與細胞間連接緊密,細胞核完整,染色體均勻淡藍色,屬正常生長狀態.圖6(b)是順鉑作用下Hela細胞凋亡的形態,細胞間隙增大,細胞變圓,變小,胞核深染,胞質濃縮,染色質成團塊狀,細胞表面有出芽現象,并伴有凋亡小體.配合物作用過的細胞也發生了類似的變化(見圖6(c)),可明顯地觀察到凋亡的形態學特征.由此看出,Hela細胞在配合物的作用下發生了一定程度上的凋亡,但引起細胞凋亡的作用效果明顯沒有順鉑強烈.

圖6 Hela細胞培養48 h后經染色在顯微鏡下的形態Fig.6 The shape of the staining of HeLa cells under the microscope after 48 h
3 結論
經過對配合物與DNA作用的研究,表明雙核鎳(Ⅱ)配合物[Ni2(Htda)2(H2O)6]·4H2O對DNA具有一定的結合能力,結合的作用模式主要以靜電作用為主,同時存在插入作用,是二者共同作用的結果.通過配合物對細胞形態學影響的研究,發現此配合物可以引起細胞一定程度上的程序性死亡,但細胞凋亡效果明顯沒有順鉑強烈.
[1] Gao En-jun,Wang Lei,Zhu Ming-chang,et al.Synthesis,Characterization,Interaction with DNA and Cytotoxicity in Vitro of the Complexes[M(dmphen)(CO3)]H2O[M=Pt(Ⅱ),Pd(Ⅱ)][J].Eur.J.Med.Chem.,2010,45(1):311-316.
[2] Barton Jacqueline K,Goldberg Jonathan M,Kumar Challa V,et al.Binding Modes and Base Specificity of Tris(phenanthroline)ruthenium(Ⅱ)Enantiomers with Nucleic Acids:Tuning the Stereoselectivity[J].J.Am.Chem.Soc.,1986,108(8):2081-2088.
[3] Gao En-jun,Zhu Ming-chang,Liu Lei,et al.New PH-dependent Complexes,from Mononuclear Pd(Ⅱ)Monomer to Heteronuclear[Pd(Ⅱ),K(Ⅰ)]Polymer:DNA Cleavage and Cytotoxicity in Vitro[J].Eur.J.Med.Chem.,2010,45:3261-3270.
[4] Gao En-jun,Wang Ke-hua,Zhu Ming-chang,et al.Hairpin-shaped Tetranuclear Pallad Ium(Ⅱ)Complex:Synthesis,Crystal Structure,DNA Binding and Cytotoxicity Activity Studies[J].Eur.J.Med.Chem.,2010,45:2784-2790.
[5] Bakalova Adriana,Varbanov Hristo,Buyukliev Rossen,et al.Synthesis,Characterization and Biological Activity of Pt(Ⅱ)and Pt(Ⅳ)Complexes with 5-methyl-5(4-pyridyl)-2,4-imidazolidenedione[J].Eur.J.Med.Chem,2008,43(5):958-965.
[6] Pyle A M,Rehmann J P,Meshoyrer R,et al.Mixedligand Complexes of Ruthenium(Ⅱ):Factors Governing Binding to DNA[J].J.Am.Chem.Soc.,1989,111(8):3051-3058.
[7] Zhou Xin-hui,A Dinuclear Ni(Ⅱ)Complex[Ni2(Htda)2(H2O)6]·4H2O:Synthesis,Crystal Structure and Properties[J].China.J.Inorg.Chem.,2010,26(5):801-806.
[8] Gao En-jun,Sun Tie-dong.Synthesis,Characterization,Interaction with DNA and Cytotoxicity in Vitro of Novel Pyridine Complexes with Zn(Ⅱ)[J].Eur.J.Med.Chem.,2010,45(10):4534-4536.
[9] 吳紅星,李風華,林華寬,等.二胺橋聯鄰菲啰啉衍生物的合成及其與DNA相互作用研究[J].無機化學學報,2005,21(1):117-122.
[10]李紅,樂學義,吳建中,等.銅(Ⅱ)鄰菲咯啉蛋氨酸配合物與 DNA相互作用研究[J].化學學報,2003,16:245-250.
[11] Holder A A,Swavey S.Design Aspects for the Development of Mixed-metal Supramolecular Complexes Capable of Visible Light Induced Photocleavage of DNA[J].Inorg.Chem.,2004,43(1):303-308.
[12]張黔玲,劉劍洪,任祥忠,等.新型雙核配合物的形成與DNA的作用機制及熒光性質研究[J].化學學報,2006,64(10):968-974.
[13]王得寶,祁國榮.核酸:上冊[M].北京:科學出版社,1987:55.
[14]袁彩霞.DNA斷裂劑的合成與識別基寡聚脫氧核苷酸的偶聯及其作用機理[D].太原:山西大學,2004.
[15] Wu Kuang-shi,Liu Ji-hua,Johnson Russell N,et al.Drug-free Macromolecular Therapeutics:Induction of Apoptosis by Coiled-coil-mediated Cross-linking of Antigens on the Cell Surface[J].Angew.Chem.Int.Ed.,2010,49:1451-1455.
[16] Jung Jongjin,Solanki Aniruddh,Memoli Kevin A,et al.Selective Inhibition of Human Brain Tumor Cells Through Multifunctional Quantum-dot-based SiRNA Delivery[J].Angew.Chem.Int.Ed.,2010,49:103-107.
[17]彭黎明,王曾禮.細胞凋亡的基礎與臨床[M].北京:人民衛生出版社,2000:184-186.

