基因FoxM1介導DFOG抑制人乳腺癌細胞生長和誘導凋亡的研究
劉莉萍,歐陽取長,曹建國,向紅琳,全梅芳
(1.湖南省腫瘤醫院乳腺內科,湖南長沙,410013;2.湖南師范大學醫學院藥物工程實驗室,湖南長沙,410013)
乳腺癌成為婦女發病率最高的惡性腫瘤之一[1]。目前,化學藥物治療雖在化學綜合治療中占據重要地位,但因其嚴重的毒副作用及容易產生耐藥性,其臨床應用價值極大地減少。因此,研制高效低毒的乳腺癌靶向藥物具有重大現實意義和廣闊的臨床應用前景。叉頭盒轉錄基因M1(FoxM1)是叉頭盒轉錄因子家族成員之一[2],已被證明能調控細胞周期G1/S期和G2/M期運轉關鍵基因的轉錄,包括細胞分裂周期蛋白基因(cdc25A,cdc25B),細胞周期蛋白(cyclin B,cyclin D1,p21蛋白和p27蛋白)[3-5]。研究[6]表明,FoxM1信號網絡在人類乳腺癌中存在FoxM1高表達。因此FoxM1可能成為抗乳腺癌藥物作用新標靶。7-二氟甲氧基-5,4′-二-正辛烷氧基金雀異黃素(DFOG)是本研究對金雀異黃素(GEN)進行化學改造獲得的新化學實體。Wang等[7]研究提示FoxM1可能是GEN抗胰腺癌的新靶標。此外,本組最近研究表明[8]DFOG通過調控FoxM1信號途徑發揮抗卵巢癌作用,較先導化合物GEN抗腫瘤活性更強。本研究旨在探討DFOG抑制人乳腺癌MCF-7和MDA-MB-453細胞生長和誘導凋亡作用及其抗乳腺癌作用的分子機制。
1 材料與方法
1.1 藥品與試劑
DFOG(分子量:544,性狀:黃色粉末,純度:98%)參照文獻[9]方法制備;碘化丙啶(PI,Sigma公司);GEN(美國 Sigma公司);小鼠抗人FoxM1、CDK1、cyclin B、p27kip1和 β-actin 一抗以及辣根過氧化物酶標記山羊抗小鼠IgG抗體;ECL Western blot檢測試劑盒;脂質體2000轉染試劑盒。
1.2 細胞培養
人乳腺癌MCF-7和MDA-MB-453細胞購于中國典型培養物保藏中心,將其放入含10%小牛血清的DMEM培養基,加入青霉素100 U/mL+鏈霉素100 U/mL,于37℃及5%CO2飽和濕度培養箱條件下培養。
1.3 平皿集落形成法
取對數生長期細胞,調節細胞密度為1×103/mL。以每孔 900 μL接種于 24孔板。待細胞貼壁后,分別加入 100 μL配制好的各濃度DFOG(終濃度分別為 10.0 、20.0、40.0 μ mol/L)和GEN(終濃度為 80 μ mol/L)培養基 ,并且設立空白對照組和溶媒對照組[加入含0.1%二甲基亞砜(DMSO)],每個濃度設2個復孔,加藥的培養基每隔2 d換1次,置CO2培養箱中培養6 d,經固定、染色后倒置顯微鏡下記錄細胞形成的克隆集落數,集落抑制率IR%=(1-處理組集落均數/對照組集落均數)×100%,實驗重復3次。
1.4 PI染色流式細胞術(FCM)分析
按照文獻[10]的方法進行,用EPICS XL型流式細胞儀測定細胞的DNA含量,并用SYSTEM II軟件分析細胞凋亡率。
1.5 Western Blot分析
按照先前文獻[10]描述的方法完成。小鼠抗人FoxM1 、CDK1、cyclin B 、p27kip1和 β-actin 用于一抗,山羊抗小鼠IgG抗體作為二抗反應。用增強型ECL蛋白質印跡分析系統檢測目的條帶信號。
1.6 FoxM1 siRNA轉染
FoxM1 siRNA購自美國Santa Cruz公司,人乳腺癌MCF-7細胞轉染采用脂質體2000轉染試劑盒,按照試劑盒操作說明進行。
1.7 逆轉錄PCR(RT-PCR)檢測FoxM1基因表達
收集各組細胞,TRlzol提取總RNA和逆轉錄cDNA的合成按試劑盒說明書操作。引物設計、反應體系及條件按文獻[8]方法進行,所得產物經1%瓊脂糖凝膠電泳驗證。
2 結 果
2.1 DFOG對乳腺癌細胞集落形成的影響
經不同濃度DFOG(10.0、20.0、40.0μ mol/L)作用6 d后,乳腺癌細胞克隆形成數逐漸減少,克隆形成率逐漸下降,MCF-7細胞的集落抑制率分別26.7%、61.6%和84.9%,MDA-MB-453細胞為22.4%、51.3%、72.4%,均明顯低于溶媒對照組(P<0.05),GEN對照組對乳腺癌MCF-7與MDA-MB-453細胞的克隆形成抑制率分別為55.8%、44.7%。表明DFOG以濃度依賴的方式顯著抑制MCF-7與MDA-MB-453細胞生長。見圖1。
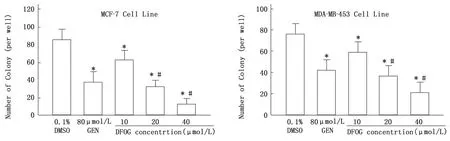
圖1 DFOG對MCF-7與MDA-MB-453細胞集落形成的影響(,n=3)
2.2 DFOG對乳腺癌MCF-7與MDA-MB-453細胞周期分布的影響
FCM分析發現,與溶媒對照組比較,DFOG(10.0、20.0 、40.0 μ mol/L)處理 24 h,隨藥物濃度增大MCF-7與MDA-MB-453細胞系G2期細胞百分率逐次增加;同時,G1和S期細胞百分率逐漸減少,見圖 2。DFOG將 MCF-7與MDAMB-453細胞阻滯于G2/M期。
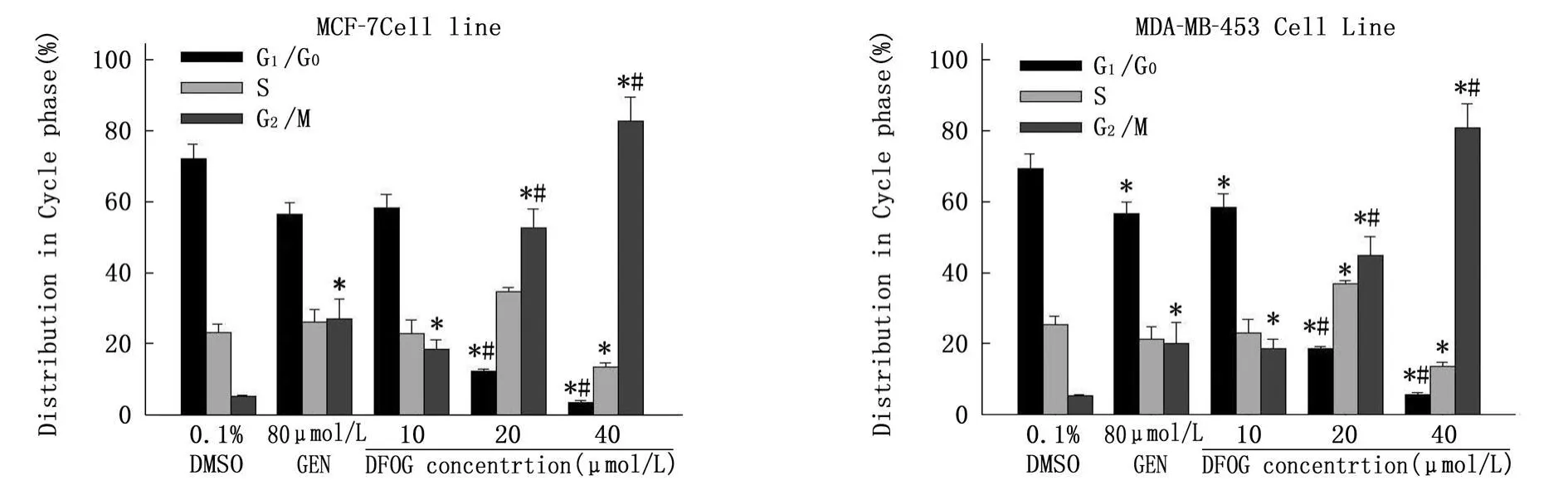
圖2 DFOG對MCF-7與MDA-MB-453細胞周期的影響(,n=3)
2.3 DFOG對乳腺癌細胞凋亡率的影響
PI染色FCM 分析結果表明,DFOG(10.0、20.0 和 40.0 μ mol/L)處理 48 h,DFOG 按照濃度依賴的方式顯著誘導MCF-7和MDA-MB-453細胞凋亡率增加,見圖3。
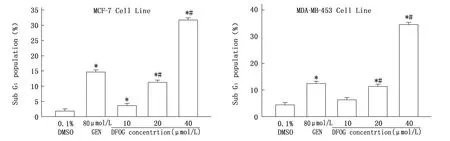
圖3 DFOG對MCF-7與MDA-MB-453細胞凋亡率的影響(,n=3)
2.4 DFOG對乳腺癌細胞FoxM1及其下游基因產物表達的影響
Western blotting分析結果顯示,DFOG以濃度依賴的方式下調MCF-7與MDA-MB-453細胞FoxM1及其下游蛋白 CDK1、cyclin B、survivin 表達,上調p27kip1蛋白表達,見圖4。
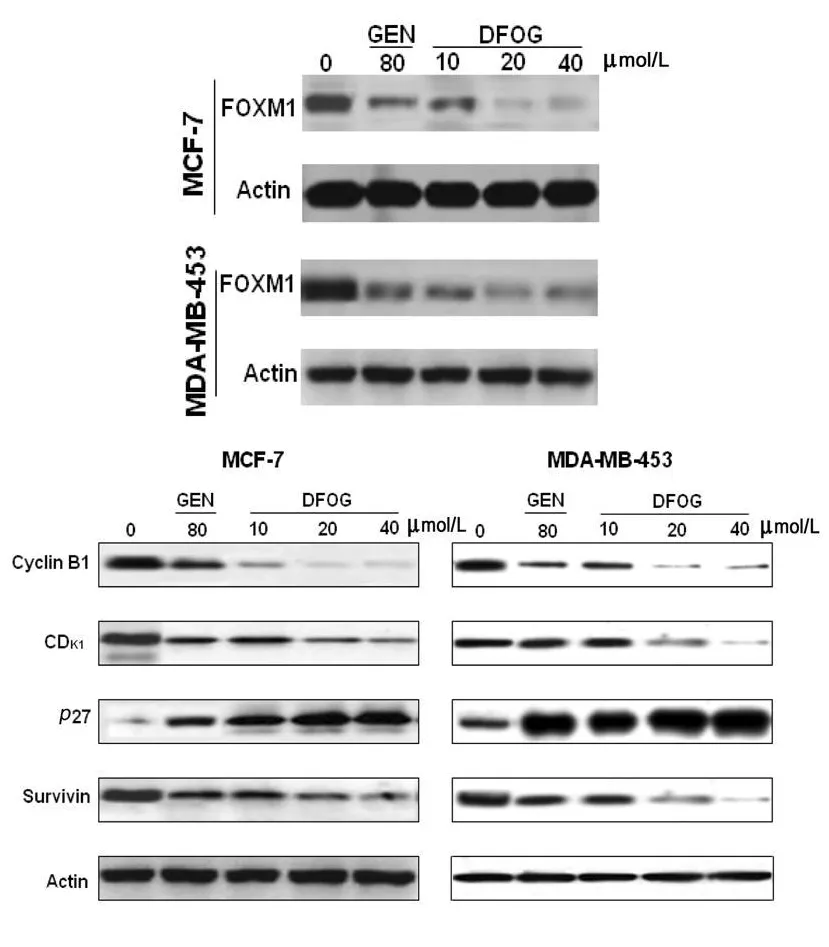
圖4 DFOG對MCF-7和MDA-MB-453細胞FoxM1及其下游基因產物表達的影響
2.5 抑制FoxM1基因表達對MCF-7細胞凋亡率的影響
Western blotting結果表明,與溶媒對照組相比,FoxM1 siRNA轉染細胞FoxM1蛋白表達水平明顯下調。同時,FCM分析結果顯示:FoxM1 siRNA轉染能可使DFOG誘導人乳腺癌細胞凋亡率的增加(P<0.05),見圖5。這些結果充分說明下調FoxM1蛋白表達是DFOG誘導人乳腺癌細胞凋亡的機制之一。
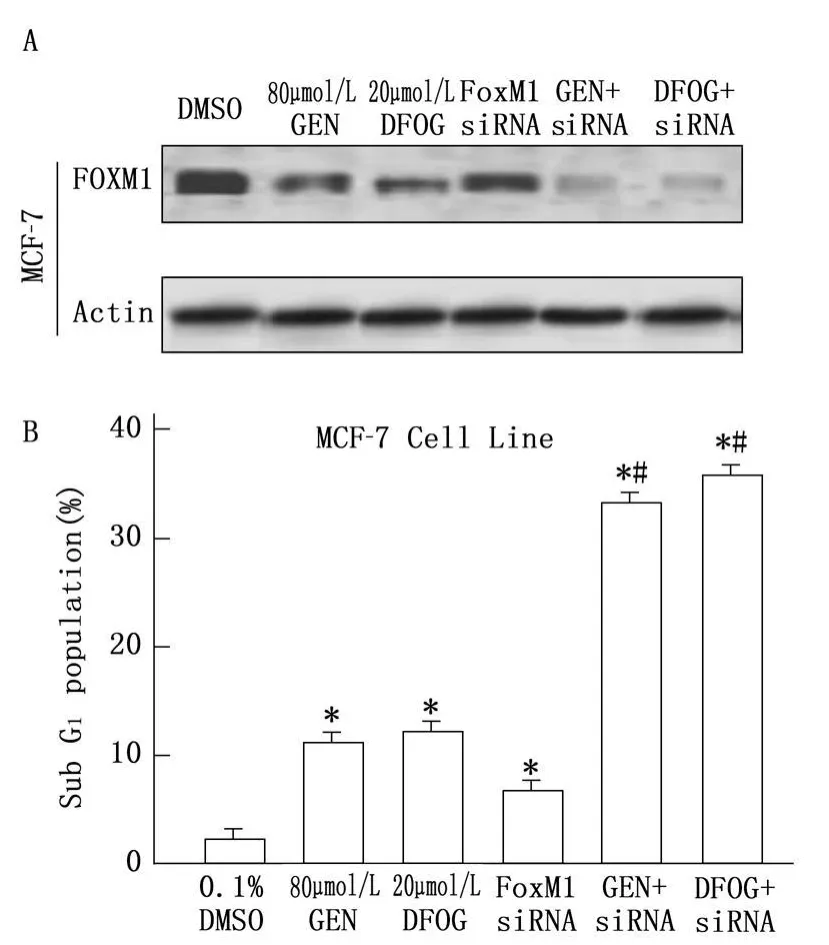
圖5 抑制FoxM1基因表達對MCF-7細胞凋亡率的影響
3 討 論
轉錄因子FoxM1是Forkhead Box轉錄因子家族成員之一,與細胞增殖、胚胎發育、衰老、再生和腫瘤等許多病理生理過程密切相關。研究[11]表明,FoxM1信號在細胞發育途徑中起著重要的作用,包括維持細胞增殖和凋亡之間的動態平衡,所以FoxM1基因的非正常激活已成為癌變組織的重要特征之一。目前發現,在人類大多數腫瘤中FoxM1都具有較高的表達水平[12-13]。FoxM1在細胞中的特殊功能以及與腫瘤的密切關系,使之成為腫瘤治療的新靶點。研究[6-7,14]表明,thiostrepton、Gen和gefitinib等多種藥物對FoxM1的表達具有抑制作用。
本文的研究結果表明,DFOG及其先導化合物GEN以濃度依賴的方式抑制人乳腺癌MCF-7和MDA-MB-453細胞生長和誘導凋亡,并且伴隨G2/M期細胞周期阻滯。DFOG能下調FoxM1及其下游靶標分子CDK1、cyclin B、survivin表達,上調p27kip1蛋白表達。眾所周知,CDK1、cyclin B和p27蛋白均為調控細胞周期G2向M期運轉的關鍵因子[15],因此,這些結果充分說明FoxM1通過調節細胞周期相關蛋白CDK1、cyclin B和CDK抑制因子p27的表達影響人乳腺癌細胞的細胞周期分布并抑制細胞生長。另一方面,survivin是凋亡抑制蛋白家族的成員,表達于大多數腫瘤組織中,而在正常組織中未見有表達。survivin主要表達于細胞周期的G2/M期,它可直接抑制細胞凋亡下游終端效應器Caspase-3、Caspase-7的活性,從而阻斷細胞的凋亡過程[16]。綜上所述,DFOG和GEN介導的細胞生長抑制和誘導凋亡作用可能與FoxM1信號途徑的抑制有關。
本研究將FoxM1 siRNA轉染MCF-7細胞,以便進一步證明FoxM1是否介導DFOG誘導人乳腺癌細胞凋亡,Western blotting結果表明,與溶媒對照組相比,FoxM1 siRNA轉染細胞FoxM1蛋白表達水平明顯下調。同時,FoxM1 siRNA轉染能可使DFOG誘導人乳腺癌細胞凋亡率的增加。這些結果充分說明下調FoxM1蛋白表達是DFOG誘導人乳腺癌細胞誘導凋亡的機制之一。
總之,DFOG具有抑制人乳腺癌MCF-7和MDA-MB-453細胞生長和誘導凋亡的作用,其誘導細胞凋亡機制涉及下調細胞內FoxM1表達水平。
[1]Hadjeri M,Barbier M,Ronot X,et a1.Modulation of P-glycopretein mediated multidrog resistanceby flavonoid derivatives and analogues[J].Med Chem,2003,46(11):2125.
[2]Wierstra I,Alves J.FOXM 1,a typical proliferation-associated transcription factor[J].Biol Chem 2007,388(12):1257.
[3]Costa R H.FoxM 1 dances with mitosis[J].Nat Cell Biol,2005,7(2):108.
[4]Petrovic V,Costa R H,Lau L F,et al.FoxM1 regulates growth factor-induced expression of kinase-interacting stathmin(KIS)to promote cell cycle progression[J].J Biol Chem,2008,283(1):453.
[5]Chen Y J,Dominguez-Brauer C,Wang Z,et al.A conserved phosphorylation site within the forkhead domain of FoxM 1B is required for its activation by cyclin-CDK1[J].J Biol Chem,2009,284(44):30695.
[6]Kwok J M,Myatt S S,MarsonC M,et al.Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box M1 expression[J].Mol Cancer Ther,2008,7(7):2022.
[7]Wang Z,Ahmad A,Banerjee S,et al.FoxM1 is a novel target of a natural agent in pancreatic cancer[J].Pharm Res,2010,27(6):1159.
[8]Ning Y,Li Q,Xiang H,et al.Apoptosis induced by 7-di-fluoromethoxyl-5,4′-di-n-octyl genistein via the inactivation of FoxM1 in ovarian cancer cells[J].Oncol Rep,2012.[Epub ahead of print].
[9]Fu XH,Wang L,Zhao H,et al.Synthesis of genistein derivatives and determination of their protective effects against vascular endothelial cell damages caused by hydrogen peroxide[J].Bioorg Med Chem Lett,2008,18(2):513.
[10]Xie Z H,Quan M F,Liu F,et al.5-allyl-7-gen-difluoromethoxy chrysin enhances TRAIL-induced apoptosis in human lung carcinoma A549 cells[J].BMC Cancer,2011,11:322.
[11]Laoukili J,Stahl M,M edema R H.FoxM1:at the crossroads of ageing and cancer[J].Biochim Biophys Acta,2007,1775(1):92.
[12]Francis R E,Myatt S S,Krol J,et al.FoxM1 is a downstream target and marker of HER2 overexpression in breast cancer[J].Int J Oncol,2009,35(1):57.
[13]Gemenetzidis E,Bose A,Riaz A M,et al.FOXM1 upregulation is an early event in human squamous cell carcinoma and it is enhanced by nicotine during malignant transformation[J].PLoS One,2009,4(3):e4849.
[14]M cGovern U B,Francis R E,Peck B,et al.Gefitinib(Iressa)represses FOXM 1 expression via FOXO3a in breast cancer[J].Mol Cancer Ther,2009,8(3):582.
[15]Zhou B B,Bartek J.Targeting the checkpoint kinases:chemosensitization versus chemoprotection[J].Nat Rev Cancer,2004,4(3):216.
[16]Cheung C H,Chen H H,Kuo C C,et al.Survivin counteracts the therapeutic effect of microtubule de-stabilizers by stabilizing tubulin polymers[J].Mol Cancer,2009,8:43.

