無血清培養聯合化療藥物對人結腸癌干細胞作用的初步研究
蘇 沐,張全安
(江蘇省南京市第二醫院腫瘤二科,江蘇南京,210003)
腫瘤細胞中存在一群生長、轉移和復發特點與干細胞基本特性十分相似的細胞,這些細胞被稱為腫瘤干細胞或腫瘤起源細胞,具有自我更新和無限增殖的能力,對腫瘤的存活、增殖、轉移及復發有著重要作用[1-3]。在研究腦膠質瘤腫瘤干細胞的過程中,有學者[4]發現,人腦膠質瘤細胞能在無血清培養基中形成細胞球,這種細胞球由于富集腫瘤干細胞而被稱之為腫瘤干細胞球,這種富集腫瘤干細胞的方法之后被廣泛用于其他實體瘤腫瘤干細胞的研究中。這一類為數極少的細胞群數量極少,但卻能瘤性克隆生長,被認為是治療后復發的重要原因之一。因此,研究腫瘤干細胞有利于進一步了解腫瘤復發、轉移及耐藥機制,為更合理的制定治療方案奠定基礎。結腸癌是一種常見的消化道惡性腫瘤,約有40%~50%的患者因為復發需要行放療或/和化療,因此研究結腸癌腫瘤干細胞可一定程度上為臨床針對性用藥提供依據,具有現實意義。
1 材料與方法
1.1 材料
無血清培養基(SFM)為不含牛血清的DMEM/F12(1∶1)培養基,并在其中加入重組表皮生長因子(EGF)(20 μg/L,PeproTech)、堿性成纖維生長因子(bFGF)20 μg/L(PeproTech公司)、白血病抑制因子(LIF)20 μg/L(PeproTech 公司)、L-谷氨酰胺 2 mmol/L(Sigma公司)、尼克酰胺10 mmol/L(Sigma公司)、羥乙基哌嗪乙硫磺酸(HEPES)5 mmol/L、青霉素G 105 U/L和鏈霉素100 mg/L。其他試劑及儀器包括:四甲基偶氮唑藍(MTT)、Hoechst33342(Sigma公司)、Trizol裂解液、Musashi-1及CD133抗體(B&D 公司)、逆轉錄-聚合酶鏈反應(RT-PCR)試劑盒(TaKaRa公司)、光學顯微鏡、CO2恒溫箱細胞培養、生物超凈工作臺、酶標儀、流式細胞分析(FCM)儀,聚合酶鏈反應(PCR)儀。
1.2 方法
1.2.1 原代結腸癌細胞的培養:新鮮手術切除的結腸癌組織,在6孔板中用含青霉素及鏈霉素的DMEM/F12(1∶1)后的腫瘤組織置于含有Ⅱ型膠原酶400 U/mL的無血清培養基的培養瓶中,培養箱中消化3 h,300×g離心3次,徹底去除膠原酶,用DMEM/F12(1∶1)培養基洗滌。SFM 法培養分離獲得的結腸癌細胞,當細胞生長到80%融合時,傳代。培養的前4代細胞在傳代時每次都保留部分細胞凍存于液氮中。
1.2.2 SFM條件下原代人結腸癌細胞的培養:原代培養獲得的人結腸癌細胞,經5-氟尿嘧啶(5-Fu)25 mg/L、鹽酸伊立替康(CPT-11)50 mg/L、奧沙利鉑(L-OHP)50 mg/L及培美曲塞50 mg/L處理后的原代結腸癌細胞分別在無血清培養基中培養7 d,觀察腫瘤干細胞球的形成過程,計數腫瘤干細胞球(>60 μ m)數目,并計算細胞球形成率(細胞球數目/接種細胞數×100%)。
1.2.3 FCM檢測側群(SP)細胞比例:將每組細胞均分置于A、B 2管中,以800 r/min的轉速離心5 min;2管中均加入 5 μg/mL Hoechst33342染色液及無血清DMEM/F12(1∶1)培養液;再將50μ mol/L維拉帕米加入B管內,37℃水浴90min,后置于4℃環境中,檢測SP細胞比例。SP細胞比例=A管中Hoechstlo比例-B管中Hoechstlo比例。1.2.4 FCM檢測細胞表面分子CD133的表達:將細胞 800 r/min離心 5 min,分別加入 20 μL CD133單克隆抗體(4℃,30 min),使用冰磷酸鹽緩沖液(PBS)洗滌1次,于FCM 上檢測CD133+細胞比例。
1.2.5 RT-PCR半定量檢測 Musashi-1 mRNA表達:采用Trizol法提取細胞的RNA,瓊脂糖凝膠電泳初步評價RNA質量,分光光度儀測定總RNA純度。將每組RNA調至每個反應體系中含1 μg。Musashi-1引物上游序列為5′-GGCT TCGTCACT TACATGGACCAGGCG-3′,下游引物序列為5′-GGAAACTGGTAGGTGTAG-3′;擴增產物為542 bp;內參為GAPDH,產物為216 bp。瓊脂糖電泳RT-PCR產物,數字成像系統進行拍照分析。
1.2.6 Western-Blot檢測Musashi-1蛋白的表達:細胞加入RIPA裂解液,提取總蛋白質,BCA法測定蛋白濃度,分裝后-80℃保存。配制濃度6%、12%的分離膠和5%的濃縮膠。蛋白上樣,SDSPAGE電泳后,使用PVDF膜轉膜。將PVDF膜浸置于含5%脫脂奶粉的磷酸鹽吐溫緩沖液(PBST液)中封閉2 h,封閉后孵育小鼠抗人ABCG2,4℃,過夜,次日用PBST液充分洗滌后,室溫下辣根酶標記山羊抗小鼠IgG孵育2 h,PBST洗滌后,使用ECL發光試劑盒,在Bio-Rad凝膠成像儀下,對PVDF膜進行圖像采集分析。取等量的蛋白樣品,通過Western-Blot測量各組細胞中β-actin的表達量,以此作為蛋白表達的內參。
2 結 果
2.1 腫瘤干細胞球的形成及形成率
原代培養獲得的人結腸癌細胞在無血清培養基生長1周,大部分不貼壁,少部分形成大小不等的細胞球,形狀較規則,球內折光性較好,球內細胞數增多,細胞間連接致密,難以區分細胞間的分界。經5-Fu、CPT-11、L-OHP及培美曲塞處理后的原代人結腸癌細胞在無血清的培養基中生長1周,亦有少部分形成腫瘤干細胞球,其細胞球形成率有差別。與空白對照組比較,經5-Fu、CPT-11、L-OHP及培美曲塞處理后的人結腸癌細胞在SFM中形成腫瘤干細胞球的比例增加(P<0.01);每2種藥物之間比較均存在一定差異,但培美曲塞組與其他各組間最為差異明顯(P<0.01)。見表1。
2.2 化療藥物聯合SFM培養對SP細胞的影響
與空白對照組比較,經5-Fu、CPT-11、L-OHP及培美曲塞處理后的SP細胞均顯著增加(P<0.01);每2種藥物之間比較均存在一定差異,但培美曲塞組與其他各組間差異最為明顯(P<0.01)。各組SP細胞比例見圖1、表1。
表1 各組人結腸癌細胞在SFM中腫瘤干細胞球形成率及SP細胞比例(n=5,,%)
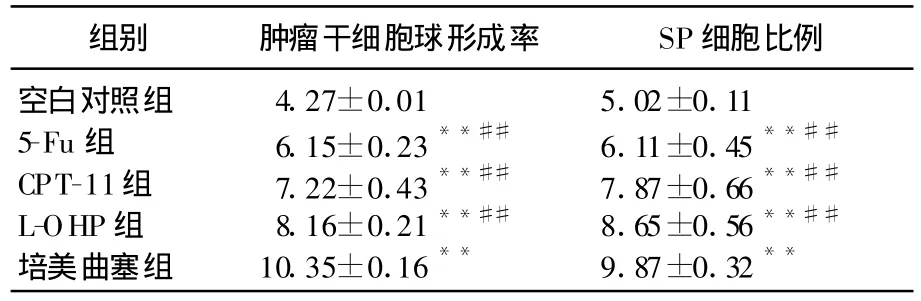
表1 各組人結腸癌細胞在SFM中腫瘤干細胞球形成率及SP細胞比例(n=5,,%)
與空白對照組比較,**P<0.01;與培美曲塞組比較,##P<0.01。
組別 腫瘤干細胞球形成率 SP細胞比例空白對照組 4.27±0.01 5.02±0.115-Fu組 6.15±0.23**## 6.11±0.45**##CPT-11組 7.22±0.43**## 7.87±0.66**##L-OHP組 8.16±0.21**## 8.65±0.56**##培美曲塞組 10.35±0.16** 9.87±0.32**
圖1 各組SP細胞比例
2.3 化療藥物聯合SFM培養對Musashi-1表達的影響
2.3.1 各組Musashi-1 mRNA的表達:通過圖像處理系統上分析得出Musashi-1和GAPDH的光密度,以GAPDH的光密度為參照物,得到Musashi-1 mRNA表達的半定量結果。與空白對照組比較,經5-Fu、CPT-11、L-OHP及培美曲塞處理后的 Musashi-1 mRNA表達均增加(P<0.01);每2種藥物之間比較均存在一定差異,但培美曲塞組與其他各組間差異最為明顯(P<0.01)。見表2。
2.3.2 各組Musashi-1蛋白的表達:與空白對照組比較,經5-Fu、CPT-11、L-OHP及培美曲塞處理后Musashi-1蛋白的表達增加,培美曲塞組最為明顯,見圖 2。

圖2 各組Musashi-1蛋白的表達
2.4 化療藥物聯合SFM培養對CD133+表達的影響
與空白對照組比較,經 5-Fu、CPT-11、L-OHP及培美曲塞處理后的人結腸癌細胞CD133+細胞比例增加(P<0.01);每2種藥物之間比較均存在一定差異,但培美曲塞組與其他各組間差異最為明顯(P<0.01)。見表2。
表2 各組人結腸癌細胞Musashi-1 mRNA的表達及CD133+細胞比例(n=5,)

表2 各組人結腸癌細胞Musashi-1 mRNA的表達及CD133+細胞比例(n=5,)
與空白對照組比較,**P<0.01;與培美曲塞組比較,##P<0.01。
組別 Musashi-1/GAPDH CD133+細胞比例(%)空白對照組 0.226±0.023 6.61±0.20365-Fu組 0.301±0.005**## 11.98±0.0198**##CPT-11組 0.425±0.040**## 12.33±0.2014**##L-OHP組 0.478±0.047**## 11.88±0.5891**##培美曲塞組 0.695±0.025** 14.86±0.1069**
3 討 論
腫瘤干細胞被認為是惡性腫瘤發生、發展、治療后復發和轉移的根源,其數量少,分離困難,成為影響腫瘤干細胞研究的重要因素之一。最早是在血液腫瘤中發現了腫瘤干細胞,近10余年先后在乳腺癌、腦膠質瘤、大腸癌、肺癌、腎癌、前列腺癌[4-8]等實體腫瘤中發現腫瘤干細胞。通過流式細胞儀篩選細胞表面標記物[5]及SP細胞分選法[9]廣泛用于腫瘤干細胞的分選,但這2種分選法在分選過程均會對細胞造成傷害。多種人腫瘤細胞,如腦腫瘤、乳腺癌、視神經母細胞瘤等,在無血清培養基中能形成具有干細胞特征的細胞球,其成為富集腫瘤干細胞的有效方法,給腫瘤干細胞培養的理論研究和實踐帶來了新的啟示。
腫瘤干細胞理論認為[1],腫瘤干細胞大多數處于休眠狀態,停滯于細胞周期中的G0期,其多數耐藥蛋白高表達,因此對化療不敏感,而成為腫瘤復發的根源。無血清培養的懸浮培養可使細胞維持在未分化的狀態[10]。在無血清培養條件下,未分化的腫瘤細胞較已分化的細胞能耐受無血清條件而免于凋亡,并可以在添加生長因子的的情況下增殖形成細胞球[10-11]。
本實驗小組之前的研究發現,5-Fu可富集人結腸癌細胞株SW480中的腫瘤干細胞;后在原代培養的人結腸癌細胞的無血清培養的研究中發現5-Fu有類似地富集腫瘤干細胞的作用。因此,本研究將臨床上常用于結腸癌治療的化療藥物與無血清懸浮培養法相結合,對原代人結腸癌細胞進行研究。結果表明,經5-Fu、L-OHP、CPT-11及培美曲塞處理后的人結腸癌細胞在SFM中形成干細胞球的能力增強;且與空白對照組相比,SP細胞比例、Musashi-1及CD133表達均有增加。有理由認為,與單純SFM培養比較,聯合化療藥物可有效進一步富集人結腸細胞中的腫瘤干細胞,但是除培美曲塞組與其他化療藥物的作用差異較為顯著外,其余藥物之間腫瘤干細胞的富集作用不十分明顯,其原因有待于進一步的研究。
本研究再次用SFM培養法富集了原代培養獲得的人結腸癌細胞中的腫瘤干細胞,且發現與化療聯合可強化富集作用,不同藥物存在一定的差別,為進一步研究腫瘤干細胞在腫瘤復發、耐藥機制中的作用奠定基礎。
[1]Prud′homme G J.Cancer stem cells and novel targets for antitumor strategies[J].Curr Pharm Des,2012,18(19):2838.
[2]Martin-Belmonte F,Perez-Moreno M.Epithelial cell polarity,stem cells and cancer[J].Nat Rev Cancer,2011,12(1):23.
[3]O′Brien C A,Kreso A,Dick J E.Cancer stem cells in solid tumors:an overview[J].Semin Radiat Oncol,2009,19(2):71.
[4]Lee C,Dunn S E,Yip S.Stem cells in brain tumour development and therapy-two-sides of the same coin[J].Can J Neurol Sci,2012,39(2):145.
[5]Mbeunkui F,Metge B J,Shevde L A,et al.Identification of differentially secreted biomarkers using LC-MS/MS in isogenic cell lines representing a progression of breast cancer[J].J Proteome Res,2007,6(8):2993.
[6]Li C,Heidt D G,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030.
[7]Zhang S,Balch C,Chan M W,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311.
[8]Suvà M L,Riggi N,Stehle J C,et al.Identification of cancer stem cells in Ewing′s sarcoma.Cancer Res,2009,69(5):1776.
[9]Hiraga T,Ito S,Nakamura H.Side population in MDA-MB-231 human breast cancer cells exhibits cancer stem cell-like properties without higher bone-metastatic potential[J].Oncol Rep.2011,25(1):289.
[10]Hwang-Verslues W W,Kuo W H,Chang P H,et al.Multiple lineages of human breast cancer stem/progenitor cells identified by profiling with stem cell markers[J].PLoS One,2009,4(12):e8377.
[11]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111.
[12]蘇 沐,張全安.無血清懸浮法篩選人結腸癌肝細胞樣亞群的初步研究[J].實用臨床醫藥雜志,2011,15(24):46.

