冷水泳浴對高尿酸血癥模型大鼠誘發痛風性關節炎的影響
時 樂,徐 立,尹 蓮,曾凡偉,梅 琦
(南京中醫藥大學1.藥學院臨床藥學系,2.藥物安全性評價中心,江蘇南京 210046)
痛風是由于嘌呤代謝紊亂和(或)尿酸排泄障礙所致的疾病。由于結締組織特別是軟骨和滑膜尿酸鹽結晶沉積而引起痛風性急性關節炎反復發作,導致關節畸形,并且常累及腎和心臟,并引起多臟器損傷。隨著生活水平的不斷提高,痛風性關節炎發病率增加,防治痛風性關節炎已經成為備受關注的研究課題。本實驗室曾對嚙齒類動物高尿酸血癥模型進行系統的研究,成功地建立了小鼠和大鼠急性高尿酸血癥模型及大鼠持續性高尿酸模型[1-4]。但是由于臨床上并非所有高尿酸血癥患者均發生痛風性關節炎,且對誘發關節炎的因素尚不清楚,所以對痛風性關節炎動物模型的研究一直在摸索中。臨床上痛風性關節炎的發生有多種因素,如過量攝取高脂高蛋白飲食、食用豆制品或海鮮、喝啤酒及受寒冷潮濕等。飲食和飲酒等因素均為引發高尿酸血癥的直接因素,而根據痛風性關節炎發作特點來看,患者多在夜間發作,可見低溫對高尿酸血癥誘發痛風性關節炎有一定的影響。本研究通過對持續性高尿酸血癥模型大鼠附加冷水泳浴條件,觀察冷水泳浴對高尿酸血癥大鼠誘發痛風性關節炎的影響,為嚙齒類動物痛風性關節炎模型的制備提供實驗依據。
1 材料與方法
1.1 動物、試劑和儀器
清潔級SD大鼠,雄性,體質量250~290 g,由上海斯萊克實驗動物有限責任公司提供,動物許可證號:SCXK(滬)2007-0005。氧嗪酸鉀,購自 Sigma-Aldrich公司,用羊毛脂與液體石蠟按質量比3∶2在70℃下混合而成的溶劑配制;次黃嘌呤(hypoxanthine,HX),購自南京鼎潤生物技術有限公司;尿酸測定試劑盒,購自上海復星長征醫學科學有限公司;液體石蠟,購自上海凌鋒化學試劑有限公司;羊毛脂,購自國藥集團化學試劑有限公司;甲醛溶液,購自汕頭市西隴化工廠有限公司;水合氯醛,購自國藥集團化學試劑有限公司。7020全自動生化分析儀(日本日立公司);多普勒激光微循環測定儀,美國Biopac公司。
1.2 動物分組與處理
將大鼠隨機分為正常對照組(n=8)、冷水泳浴組(n=8)、高尿酸血癥模型組(n=8)、高尿酸血癥+冷水泳浴組(n=30)。參照文獻[4]復制持續性高尿酸血癥大鼠模型。禁食24 h后,正常對照組和冷水泳浴組喂飼普通飼料,高尿酸血癥模型組和高尿酸血癥+冷水泳浴組喂飼含HX 100 g·kg-1飼料。次日早晨,sc給予氧嗪酸鉀1 ml·kg-1,每隔 48 h 注射1次,連續6次。從造模的第1天開始,每天9:00時,將冷水泳浴的大鼠放入10~12℃的水中10 min,每天1次,共12 d。
1.3 大鼠后肢腫脹率及腫脹發生率的測定
造模前,用足容積測定儀測量各組大鼠左、右后肢容積。造模期間,從大鼠后肢關節出現腫脹次日起至實驗結束,每天使用足容積測定儀測量各組大鼠雙側后肢容積,計算足容積均數作為造模后該大鼠后肢平均容積。關節腫脹率(%)=(造模后雙后肢容積-造模前雙后肢容積)/造模前雙后肢容積×100%。
1.4 微循環測定儀測定足面單位面積紅細胞矢量和血灌流單位(blood perfusion unit,BPU)
造模12 d后,將大鼠以10%水合氯醛麻醉后,仰位固定于鼠板上,穩定1 min后,用多普勒微循環測定儀測大鼠右后肢足面單位面積紅細胞矢量和BPU,測定時間為2 min。
1.5 大鼠血清尿酸濃度的測定
分別于造模前和造模6和12 d后,各組大鼠于眼眶靜脈叢取血,每只0.5 ml,離心,取血清,全自動生化分析儀測定尿酸濃度。
1.6 大鼠踝關節尿酸濃度的測定
處死所有大鼠,剔除右側踝關節周圍肌肉,打開關節腔,用0.2 ml生理鹽水反復沖洗關節腔5次,測定踝關節液中尿酸濃度。
1.7 大鼠踝關節組織病理學觀察
取左側踝關節,10%甲醛溶液固定,經15%EDTA脫鈣后,常規取材,脫水,石蠟包埋,切片厚4μm,HE染色,光學顯微鏡下觀察組織病理變化。
1.8 統計學分析
2 結果
2.1 冷水泳浴對高尿酸血癥大鼠腫脹發生率及后肢關節腫脹率的影響
12 d實驗結束時,高尿酸血癥+冷水泳浴組大鼠死亡12只,其中有5只已經出現關節腫脹,且腫脹部位有紅腫、破潰和感染的癥狀,具體死亡原因有待進一步探討。該組大鼠關節腫脹發生率為76.7%(23/30);其余各組均未見關節腫脹及死亡。
高尿酸血癥+冷水泳浴組大鼠造模后第4天,肉眼即可觀察到后肢關節開始出現紅腫;第5天起,該組大鼠出現關節腫脹的例數增加并出現腫脹高峰,且一直維持至第8天,腫脹部位有紅腫、破潰的癥狀;第10天起,約半數腫脹大鼠紅腫自行緩解或消失。至實驗結束時,各組大鼠后肢平均關節腫脹率見表1,提示高尿酸血癥和冷水泳浴共同作用可引起大鼠后肢關節腫脹。
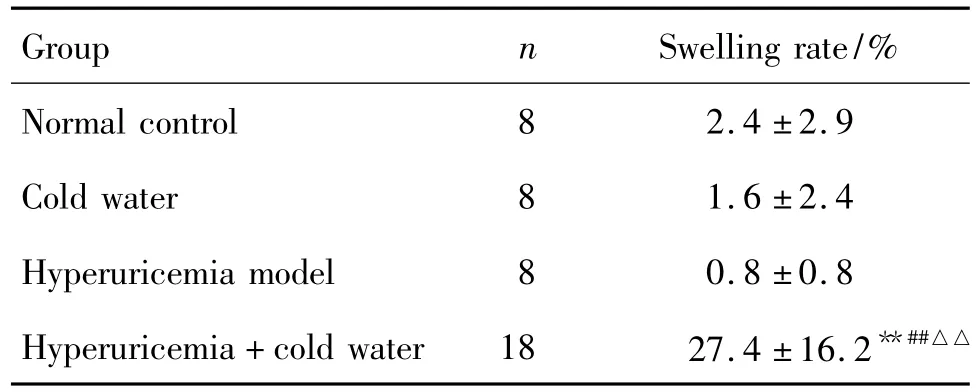
Tab.1 Effect of swimming in cold water on swelling in hind limbs of hyperuricemia rats
2.2 冷水泳浴對高尿酸血癥大鼠后肢足面微循環的影響
造模12 d后,與正常對照組比較,其余各組大鼠后肢微循環均表現為不暢(P<0.01);其中高尿酸血癥+冷水泳浴組與冷水泳浴組和高尿酸血癥模型組比較,微循環阻滯更加明顯(P<0.01)(表2);提示高尿酸血癥和冷水泳浴均可降低大鼠末梢微循環,兩種因素共同作用可導致更加嚴重的微循環障礙。
2.3 冷水泳浴對高尿酸血癥大鼠血清尿酸濃度的影響
造模6和12 d后,各組大鼠血清尿酸水平的變化見表3。與正常對照組比較,冷水泳浴組無明顯變化,高尿酸血癥模型組和高尿酸血癥+冷水泳浴組明顯升高(P<0.01)。高尿酸血癥+冷水泳浴組與高尿酸血癥模型組比較無明顯變化,與冷水泳浴組比較顯著升高(P<0.01),提示冷水泳浴對大鼠血清尿酸水平無直接影響。
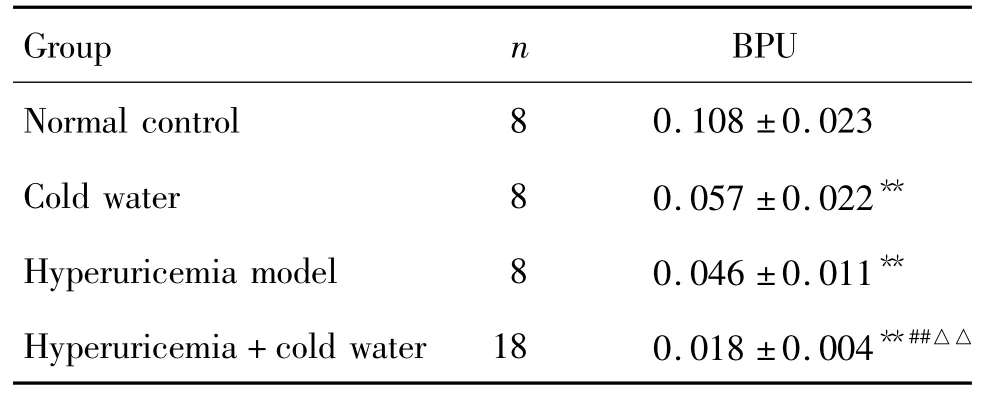
Tab.2 Effect of swimming in cold water on blood perfusion unit(BPU)in foot microcirculation of hyperuricemia rats
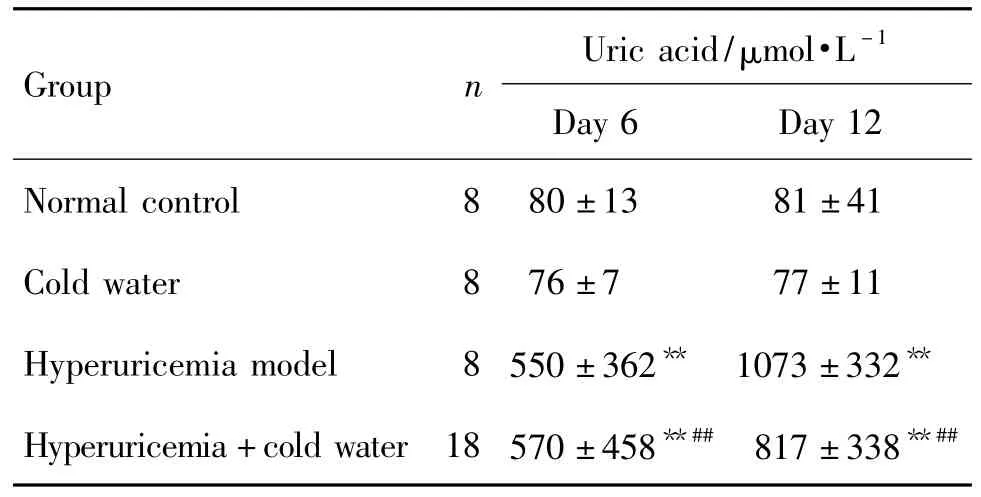
Tab.3 Effect of swimming in cold water on serum uric acid concentration in hyperuricemia rats
2.4 冷水泳浴條件對高尿酸血癥大鼠右踝關節腔尿酸濃度的影響
表4結果顯示,造模12 d后,與正常對照組比較,其余各組大鼠踝關節腔中尿酸濃度均明顯升高(P<0.01);高尿酸血癥+冷水泳浴組明顯高于冷水泳浴組和高尿酸血癥模型組(P<0.01);提示高尿酸血癥和冷水泳浴均可增加大鼠踝關節腔尿酸濃度;當兩種因素同時存在時,其交互作用可增加大鼠踝關節腔尿酸鹽的沉積。
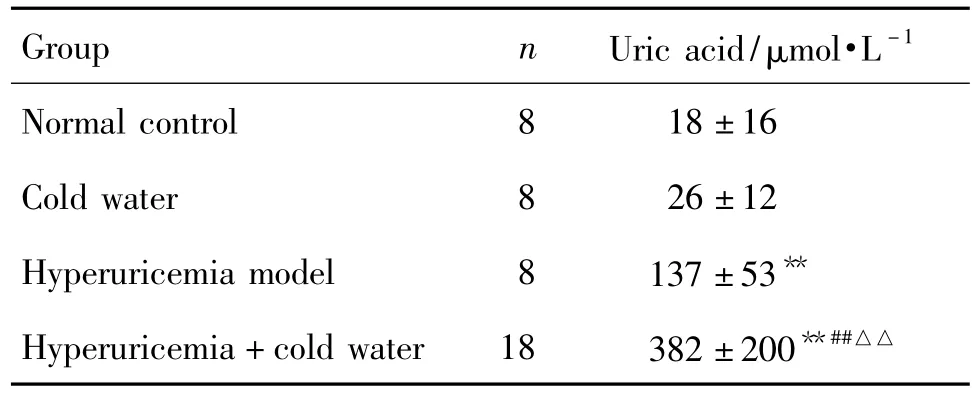
Tab.4 Effect of swimming in cold water on uric acid concentration in joint cavity of hyperuricemia rats
2.5 冷水泳浴對高尿酸血癥大鼠左側踝關節組織病理變化的影響
由圖1結果表明,正常對照組踝關節無明顯腫脹,滑膜完整、無增生,細胞排列整齊,無充血水腫,無炎癥細胞浸潤,關節腔內無積液,關節軟骨完整,無破壞(圖1A)。冷水泳浴組踝關節無異常改變(圖1B)。高尿酸血癥模型組有1例滑膜內血管擴張充血,少許淋巴細胞和中性粒細胞浸潤,周圍軟組織血管擴張充血(圖1C)。高尿酸血癥+冷水泳浴組約76.7%的踝關節腫脹,鏡下可見滑膜內血管擴張充血明顯,個別滑膜細胞輕度增生,伴有少量的炎癥細胞(有淋巴細胞、漿細胞、中性粒細胞和巨噬細胞)浸潤,周圍軟組織血管擴張充血,間質水腫,伴有類似的炎癥細胞浸潤(圖1D)。
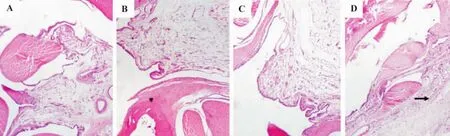
Fig.1 Effect of swimming in cold water on histopathological changes in ankle joints of hyperuricemia rats(HE ×40).A:normal control group;B:cold water group;C:hyperuricemia model group;D:hyperuricemia+cold water group.Arrows showed inflammatory cells invasion.
3 討論
目前國內外制備痛風性關節炎動物模型主要采用將尿酸鹽直接注入動物關節腔的方法[5-6],但上述方法所致腫脹僅為一種非特異性炎癥反應,不同于臨床因代謝障礙而形成的痛風性關節炎,對于痛風的病理生化基礎——高尿酸血癥并未涉及,所以不能準確評價抗痛風藥物的作用和作用機制。為此許多學者試圖通過不同的方法建立一種符合臨床的、由嘌呤代謝紊亂所致的大鼠高尿酸血癥痛風性關節炎動物模型,但目前均未見有成功的報道。
高尿酸血癥是發生痛風性關節炎的基礎,但是臨床上并非所有高尿酸血癥患者均發生痛風性關節炎,可能存在其他誘發痛風性關節炎的因素。為了進一步探討這個問題,本實驗室曾經考察了溫度對尿酸鹽結晶沉積的影響,結果顯示低溫有利于尿酸鹽結晶的形成[7-8]。
本研究曾選取0℃水浴研究,結果大鼠死亡數較多,且凍傷嚴重。通過預實驗,本研究最終選擇在高尿酸血癥大鼠模型基礎上附加大鼠可以耐受的適宜水溫10~12℃冷水泳浴。實驗結束時,僅高尿酸血癥+冷水泳浴組大鼠發生了后肢關節腫脹,腫脹發生率約76.7%,組織病理學檢查主要表現為輕度的滑膜炎和周圍軟組織炎癥,關節腔中尿酸濃度明顯升高,并且受試大鼠后肢關節腫脹的過程與臨床痛風性關節炎發病過程相似。上述結果表明,對高尿酸血癥模型大鼠附加冷水泳浴條件可誘發痛風性關節炎的發生。后期還將考察不同水溫對造模成功率的影響。
此外,本研究結果表明,冷水泳浴可使大鼠后肢微循環受阻,其受阻程度以合并高尿酸血癥大鼠尤為顯著,高尿酸血癥和冷水泳浴因素的加和是增加大鼠后肢關節腫脹發生率的主要因素。這可能是因為寒冷刺激使局部微血管收縮使局部血流減慢,從而使高尿酸血癥患者的關節局部出現尿酸大量的聚集,關節局部pH降低刺激微血管,毛細血管和關節囊外層纖維結締組織通透性增加,致使尿酸得以向關節腔轉移和聚集,最終引發痛風性關節炎。由此提示,高尿酸血癥大鼠肢體微循環障礙可能是導致尿酸鹽聚集于關節并引起關節炎癥的重要原因之一。
[1]Xu L,Shi L.A preliminary study on the establishment of a mouse model of hyperuricemia[J].Chin J Comp Med(中國比較醫學雜志),2006,16(1):1-4.
[2]Xu L,Shi L,Zhong WX.Exploratory development of uricase inhibitor for replicating acute animal model of hyperuricemia on rat[J].Chin J Comp Med(中國比較醫學雜志),2007,17(3):142-146.
[3]Xu L,Shi L,Zhao F,Tan QW,Yao JL.A preliminary study on the establishment of rat model with acute hyperuricemia[J].Chin Pharmacol Bull(中國藥理學通報),2007,23(7):976-978.
[4]Xu L,Shi L.A preliminary study on the replication of continuity hyperuricemia rat model by administration and fed with hypoxanthine[J].Chin Pharmacol Bull(中國藥理學通報),2008,24(12):1671-1673.
[5]Chen WZ,Jiang H,Liu YL,Lin J,Jin C,Gu RS.The experimental study of anti-inflammation and analgesia effect of TFN on acute gout[J].Chin J Tradit Med Traumatol Orthop(中國中醫骨傷科雜志),1999,7(4):1-3.
[6]Ishimaru JI,Ogi N,Mizuno S,Goss AN.Quantitation of chondroitin-sulfates,disaccharides and hyaluronan in normal,early and advanced osteoarthritic sheep temporomandibular joints[J]. Osteoarthritis Cartilage,2001,9(4):365-370.
[7]Pan Y,Xu L,Shi L,Yin L,Duan JA,Zeng FW.Effect of different PH and different temperature on the formation of urate crystals[J].J Liaoning Univ Tradit Chin Med(遼寧中醫藥大學學報),2010,12(4):67-69.
[8]Xu L,Liu RN,Shi L,Pan Y,Yin L,Zeng FW,et al.Effects of temperature on the deposition of urate crystal in vitro[J].Pharmacol Clin Chin Mater Med(中藥藥理與臨床),2011,27(2):123-124.

