法舒地爾對(duì)高糖培養(yǎng)的腎小管上皮細(xì)胞轉(zhuǎn)分化的抑制作用
倪連松,高 倩,顧玲佳
(溫州醫(yī)學(xué)院附屬第一醫(yī)院內(nèi)分泌科,浙江溫州 325000)
法舒地爾是最早發(fā)現(xiàn)的Rho相關(guān)卷曲螺旋形成的蛋白絲氨酸/蘇氨酸激酶(Rho-associated coiledcoil forming protein serine/threonine kinase,ROCK)選擇性抑制劑之一[1]。已有研究表明,在糖尿病動(dòng)物模型中法舒地爾可以減少尿蛋白、腎小球系膜外基質(zhì)堆積以及減輕腎小球硬化[2-5]。近年來(lái),越來(lái)越多的證據(jù)表明,糖尿病時(shí)腎小管間質(zhì)病變的嚴(yán)重程度與蛋白尿排泄量和腎功能的進(jìn)行性下降密切相關(guān)[6],然而法舒地爾對(duì)糖尿病性腎小管間質(zhì)病變的保護(hù)作用尚未見(jiàn)報(bào)道。Rho家族蛋白是Ras超家族中小分子G蛋白的成員之一,具有GTP酶活性,故又稱Rho GTP酶,其中對(duì)Rho A,Rac1和Cdc42研究得最為廣泛。Rho A分子存在著與GTP結(jié)合激活態(tài)和與GDP結(jié)合失活態(tài)兩種,在兩種形式相互轉(zhuǎn)換過(guò)程中轉(zhuǎn)導(dǎo)信號(hào),行使其生理功能。ROCK又稱Rho激酶,是Rho A下游的主要效應(yīng)因子。近來(lái)人們發(fā)現(xiàn),腎中Rho A/ROCK信號(hào)通路具有重要的功能,Rho A/ROCK介導(dǎo)了腎小管細(xì)胞、系膜細(xì)胞及足細(xì)胞的細(xì)胞支架的重構(gòu);促成了上皮細(xì)胞間質(zhì)轉(zhuǎn)分化,因而在腎纖維化中起著重要的作用[7]。細(xì)胞在某些生理或病理情況下發(fā)生細(xì)胞形態(tài)、結(jié)構(gòu)和功能的改變稱為細(xì)胞表型轉(zhuǎn)化,其中上皮細(xì)胞在某些條件下轉(zhuǎn)分化為肌成纖維細(xì)胞的現(xiàn)象稱為上皮細(xì)胞肌成纖維細(xì)胞轉(zhuǎn)分化(epithelial-myofibroblast transition,EMT)[8],表現(xiàn)為丟失上皮細(xì)胞標(biāo)志物上皮鈣黏素[9],以及表達(dá)肌成纖維細(xì)胞標(biāo)志物α-平滑肌肌動(dòng)蛋白(α-smooth muscle actin,α-SMA)。已有研究顯示,糖尿病性腎病時(shí)腎小管上皮細(xì)胞可發(fā)生轉(zhuǎn)分化,并且該轉(zhuǎn)分化過(guò)程在糖尿病性腎病的發(fā)生發(fā)展中起重要作用[10],尋找新的干預(yù)措施逆轉(zhuǎn)該轉(zhuǎn)分化過(guò)程將是治療糖尿病性腎病的新策略。
為進(jìn)一步探究法舒地爾對(duì)糖尿病性腎病的保護(hù)作用機(jī)制,根據(jù)前期實(shí)驗(yàn)結(jié)果,選擇在安全濃度范圍內(nèi)的最大濃度20μmol·L-1作為法舒地爾的實(shí)驗(yàn)濃度,探討其對(duì)高糖培養(yǎng)腎小管上皮細(xì)胞轉(zhuǎn)分化影響,同時(shí)檢測(cè)其對(duì)轉(zhuǎn)化生長(zhǎng)因子β1(transforming growth factor,TGF-β1)的影響,以探討其作用機(jī)制并為其進(jìn)一步的臨床應(yīng)用提供理論依據(jù)。
1 材料與方法
1.1 細(xì)胞、試劑及儀器
人腎小管上皮細(xì)胞(HK-2)購(gòu)自武漢大學(xué)中國(guó)典型培養(yǎng)物保藏中心,CCTCC編號(hào):GDC152。法舒地爾購(gòu)自天津紅日藥業(yè)股份有限公司產(chǎn)品,批號(hào):091114。DMEM培養(yǎng)液和胎牛血清為Gibco公司產(chǎn)品。Rho A配體結(jié)合沉淀試劑盒購(gòu)自Millipore公司。鼠抗人Rho A一抗,鼠抗人上皮鈣黏素一抗和鼠抗人α-SMA購(gòu)自Sant Cruz公司,F(xiàn)ITC標(biāo)記羊抗鼠IgG抗體購(gòu)自聯(lián)科生物公司。HRP標(biāo)記羊抗鼠IgG抗體和碘化丙啶(propidium iodide,PI)購(gòu)于碧云天公司。激光共聚焦儀器為Olympus公司,酶標(biāo)儀為T(mén)hermo公司,Imaglab凝膠成像系統(tǒng)為Bio-Rad公司,ELISA試劑盒購(gòu)自上海西唐公司。
1.2 HK-2細(xì)胞培養(yǎng)及分組處理
HK-2細(xì)胞常規(guī)培養(yǎng)在含10%胎牛血清和葡萄糖5.5 mmol·L-1的 DMEM 培養(yǎng)液中,置 37℃、5%CO2孵箱中培養(yǎng),2~3 d換液1次。細(xì)胞依次分別加入葡萄糖 5.5 mmol·L-1、葡萄糖 5.5 mmol·L-1+甘露醇 54.5 mmol·L-1、葡萄糖 60 mmol·L-1及葡萄糖 60 mmol·L-1+ 法舒地爾 20 μmol·L-1。
1.3 配體結(jié)合沉淀法檢測(cè)Rho A活性
HK-2細(xì)胞接種在10 cm細(xì)胞培養(yǎng)皿中,細(xì)胞培養(yǎng)貼壁生長(zhǎng)至100%融合后,無(wú)血清培養(yǎng)液靜止培養(yǎng)24 h后用葡萄糖60 mmol·L-1的高糖培養(yǎng)液干預(yù),分別于0,0.5,1,3,7,12 和24 h收集細(xì)胞,裂解細(xì)胞后,收集的細(xì)胞,于4℃時(shí),17949×g離心30 min,取50μl上清用于Total-RhoA檢測(cè),余上清加入10μl Rhotekin Rho結(jié)合域瓊脂糖 (Rhotekin Rho binding domain agarose,Rhotekin RBD-agarose),4℃振搖過(guò)夜以沉淀GTP-Rho A,變性后取50μl樣本行12%SDS-PAGE電泳,Western印跡法檢測(cè) GTPRhoA的表達(dá),同時(shí)取50μl總蛋白樣品檢測(cè)總Rho A的表達(dá)。Imagelab軟件分析結(jié)果,以所測(cè)得的各條帶的積分吸光度(integrated absorbance,IA)與相應(yīng)總Rho A的IA比值作為Rho A活性值。
1.4 免疫熒光細(xì)胞化學(xué)技術(shù)檢測(cè)上皮鈣黏素表達(dá)
收集培養(yǎng)72 h的各分組細(xì)胞爬片,4%多聚甲醛溶液固定和0.1%TritonX-100溶液穿孔細(xì)胞后用10%正常羊血清37℃封閉1 h,滴加上皮鈣黏素一抗(1∶100),4℃孵育過(guò)夜,次日清洗后滴加FITC標(biāo)記的二抗(1∶200)避光37℃孵育30 min,后行PI染色30 min,清洗后用抗熒光淬滅封片劑封片,立即用激光共聚焦顯微鏡觀察并拍片,每組隨機(jī)選3個(gè)視野用圖像分析軟件進(jìn)行分析,IA與視野總面積的比值表示上皮鈣黏素表達(dá)量。
1.5 Western印跡法檢測(cè)α-SMA的表達(dá)
1.5.1 細(xì)胞培養(yǎng)及分組
HK-2細(xì)胞接種于10 cm細(xì)胞培養(yǎng)皿中,細(xì)胞培養(yǎng)貼壁生長(zhǎng)至70%融合后,更換為無(wú)血清培養(yǎng)液靜止24 h,按實(shí)驗(yàn)分組換為不同的培養(yǎng)液,分別于72 h提取細(xì)胞蛋白。
1.5.2 細(xì)胞總蛋白提取與定量
收集細(xì)胞后,冰上裂解細(xì)胞30 min,收集裂解液5 min,4℃,17 949×g離心后收集上清用BCA蛋白濃度測(cè)定法測(cè)定蛋白濃度,操作按說(shuō)明書(shū)。5×上樣緩沖液變性蛋白后-20℃保存。
1.5.3 細(xì)胞內(nèi)α-SMA蛋白量的檢測(cè)
取60μg總蛋白上樣,用10%濃度的SDS-PAGE膠進(jìn)行電泳。恒流將蛋白轉(zhuǎn)至PVDF膜,5%脫脂奶粉室溫?fù)u床封閉2 h,分別加入 α-SMA(1∶200),GAPDH(1∶1000)一抗,4℃過(guò)夜。清洗后分別加入相應(yīng)的HRP標(biāo)記的Ig G(1∶1000)二抗,室溫?fù)u床孵育1 h,洗膜后分別取等量ECL試劑盒溶液A和B液混合后加于PVDF膜,避光反應(yīng)1 min,Molecular Imager ChemiDocTMXRS和成像系統(tǒng)自動(dòng)曝光掃描并用Imagelab軟件分析結(jié)果,以所測(cè)得的各條帶的A與內(nèi)參照GAPDH A的比值作為α-SMA的半定量值。
1.6 ELISA法檢測(cè)細(xì)胞培養(yǎng)上清TGF-β1含量
收集培養(yǎng)24 h和48 h細(xì)胞上清液4℃,4142×g離心3 min后ELISA法檢測(cè)TGF-β1,具體操作按試劑盒說(shuō)明書(shū)。收集細(xì)胞冰上裂解后離心,收集上清用BCA蛋白濃度測(cè)定法測(cè)定蛋白濃度,操作按說(shuō)明書(shū),以矯正ELISA結(jié)果。
1.7 統(tǒng)計(jì)學(xué)分析
2 結(jié)果
2.1 高糖對(duì)HK-2細(xì)胞Rho A活性的影響
圖1結(jié)果顯示,與未刺激前(0 min)比較,高糖60 mmol·L-1培養(yǎng)3 ~24 h后 HK-2 細(xì)胞 Rho A 活性明顯升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),其中3 h為最高,是為刺激前的4.5倍,提示在一定時(shí)間范圍內(nèi),高糖可以刺激HK-2細(xì)胞Rho A分子活化。
2.2 法舒地爾對(duì)高糖培養(yǎng)HK-2細(xì)胞上皮鈣黏素表達(dá)的影響
如表1和圖2結(jié)果顯示,與正常對(duì)照組比較,高糖60 mmol·L-1培養(yǎng)72 h后HK-2細(xì)胞內(nèi)上皮鈣黏素蛋白表達(dá)明顯減少(P<0.01),高張組區(qū)別不具統(tǒng)計(jì)學(xué)意義,提示高糖可成功誘導(dǎo)HK-2細(xì)胞表型轉(zhuǎn)換,高張并不能引起HK-2細(xì)胞表型轉(zhuǎn)換。與高糖組比較,法舒地爾20μmol·L-1同步干預(yù)72 h后上皮鈣黏素蛋白表達(dá)量增多,但仍低于正常對(duì)照組,提示法舒地爾20μmol·L-1不能完全抑制高糖誘導(dǎo)的HK-2細(xì)胞轉(zhuǎn)分化。
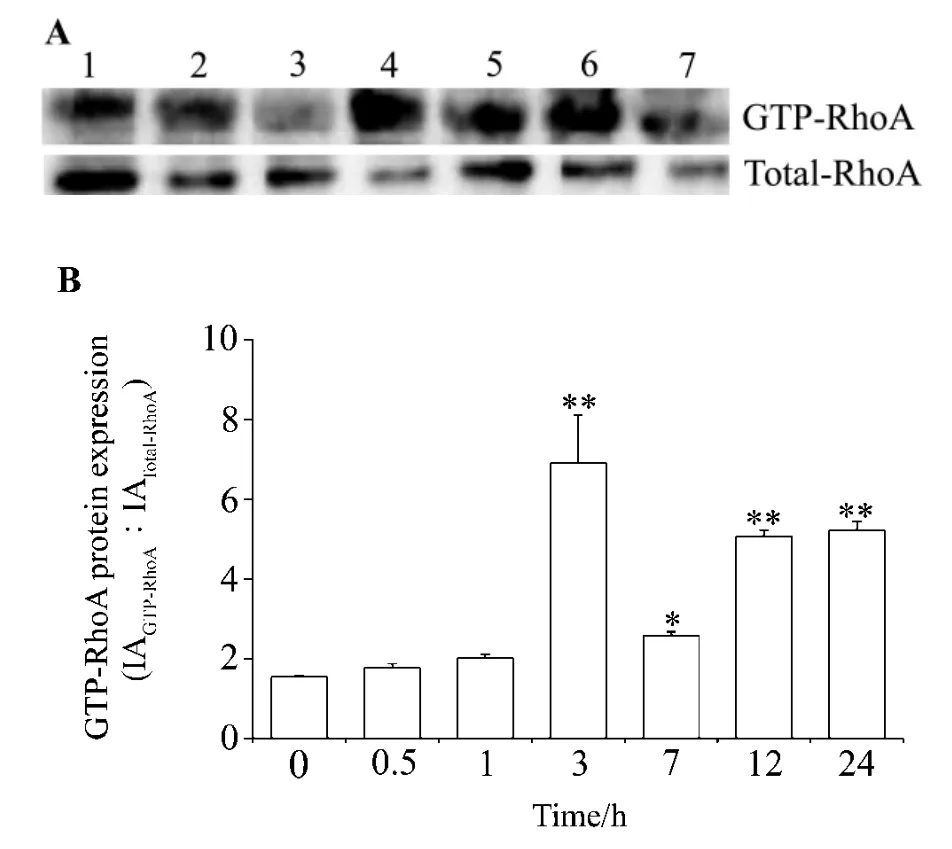
Fig.1 Effect of high glucose on Rho A activity of HK-2 cells.B was the semiquantitative result of A.Lanes 1-7 were HK-2 cells cultivated with glucose60 mmol·L-1 for 0,0.5,1 ,3 ,7 ,12 and 24 h,respectively.±s,n=3.*P<0.05,**P<0.01,compared with 0 min group.
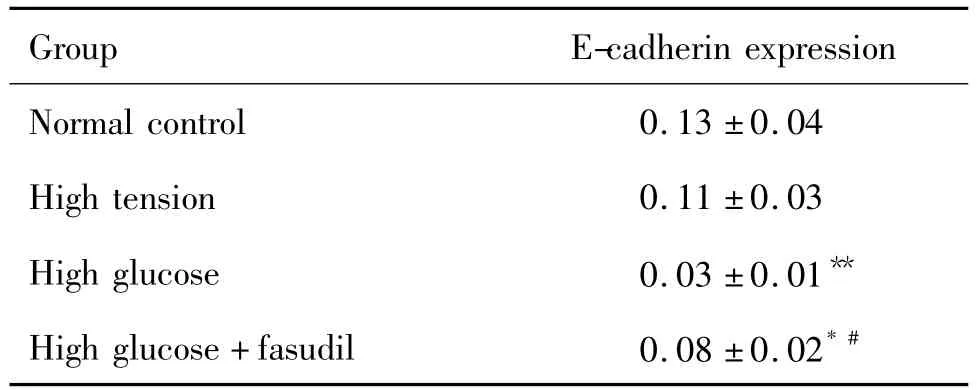
Tab.1 Effect of fasudil on E-cadherin expression of HK-2 cells cultivated in high glucose
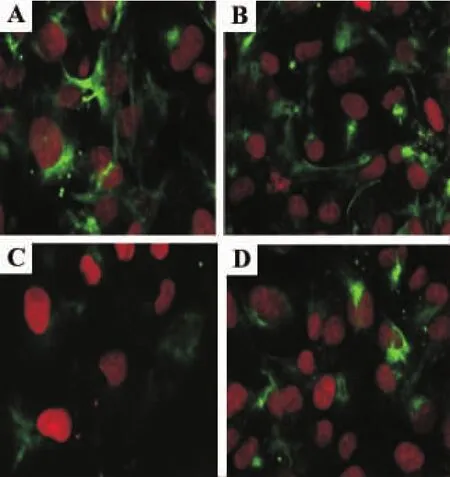
Fig.2 Effect of fasudil on E-cadherin expression of HK-2 cells cultivated in high glucose detected by confocal laser scanning microscopy(PI×400).See Tab 1 for the treatment.A:normal control group;B:high tension group;C:high glucose group;D:high glucose+fasudil group.
2.3 法舒地爾對(duì)高糖培養(yǎng)HK-2細(xì)胞α-SMA表達(dá)的影響
如圖3結(jié)果顯示,與正常對(duì)照組比較,高糖60 mmol·L-1培養(yǎng)HK-2 細(xì)胞72 h 后,細(xì)胞 α-SMA 蛋白表達(dá)量明顯增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),高張組差異不具有統(tǒng)計(jì)學(xué)意義,提示是高糖可以誘導(dǎo)HK-2細(xì)胞向肌成纖維細(xì)胞轉(zhuǎn)化,而高張培養(yǎng)不能誘導(dǎo)其轉(zhuǎn)化。與高糖組比較,法舒地爾20μmol·L-1同步干預(yù)72 h后HK-2細(xì)胞α-SMA表達(dá)量明顯減少,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),提示高糖誘導(dǎo)HK-2細(xì)胞向肌成纖維細(xì)胞轉(zhuǎn)化作用能被法舒地爾抑制。
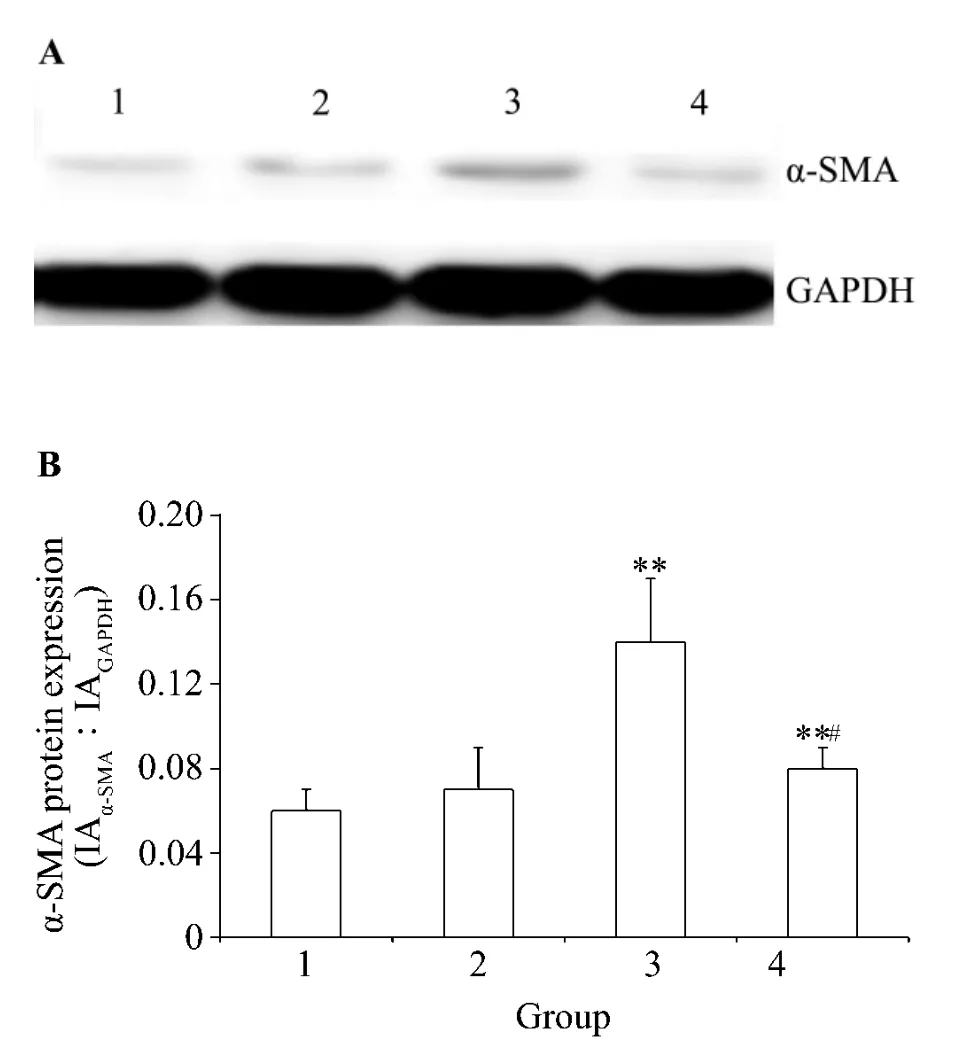
Fig.3 Effect of fasudil on α-smooth muscle actin(α-SMA)expression of HK-2 cells cultivated in high glucose detected by Western blotting.See Tab.1 for the treatment.B was the semiquantitative result of A.1-4 were normal control group,high tension group,high glucose group and high glucose+fasudil group,respectively.±s,n=3.**P<0.01,compared with normal control group;#P <0.05,compared with high glucose group.
2.4 法舒地爾對(duì)高糖培養(yǎng)HK-2細(xì)胞TGF-β1分泌的影響
表2結(jié)果顯示,與正常對(duì)照組比較,高糖60 mmol·L-1培養(yǎng)24或48 h可增加HK-2細(xì)胞上清液中TGF-β1的合成,且隨著時(shí)間的延長(zhǎng)而增加(P <0.01)。法舒地爾20 μmol·L-1同步干預(yù)24 或48 h后,對(duì)高糖刺激HK-2細(xì)胞TGF-β1的合成作用具有明顯抑制作用,但法舒地爾同步干預(yù)24 h不能完全抑制高糖的刺激作用。

Tab.2 Effect of fasudil on transforming growth factor-β1(TGF-β1)secretion of HK-2 cells cultivated in high glucose
3 討論
本實(shí)驗(yàn)發(fā)現(xiàn),HK-2細(xì)胞在高糖60 mmol·L-1條件下培養(yǎng)72 h后,上皮鈣黏素表達(dá)下降,α-SMA表達(dá)升高,發(fā)生EMT,與 Zhou等[11]的研究結(jié)果一致。本實(shí)驗(yàn)首次發(fā)現(xiàn)高糖60 mmol·L-1能激活HK-2細(xì)胞Rho A活性,表現(xiàn)為GTP-Rho A與總Rho A的比值增加,進(jìn)一步補(bǔ)充了Massey等[12]關(guān)于糖尿病實(shí)驗(yàn)動(dòng)物腎皮質(zhì)存在Rho A的活化的研究結(jié)果,為研究法舒地爾對(duì)高糖培養(yǎng)的腎小管上皮細(xì)胞轉(zhuǎn)分化的作用提供了理論依據(jù)。
本研究結(jié)果發(fā)現(xiàn),高糖 60 mmol·L-1誘導(dǎo)的HK-2細(xì)胞轉(zhuǎn)分化,能部分被法舒地爾抑制,表現(xiàn)為經(jīng)法舒地爾同步干預(yù)后,細(xì)胞上皮鈣黏素表達(dá)增加,α-SMA表達(dá)下降,證實(shí)了法舒地爾對(duì)糖尿病性腎小管間質(zhì)病變的保護(hù)作用,也進(jìn)一步闡明了法舒地爾的糖尿病性腎病保護(hù)作用機(jī)制,但是本研究還發(fā)現(xiàn),法舒地爾不能完全抑制EMT,法舒地爾干預(yù)組與正常糖濃度培養(yǎng)組表型標(biāo)志物表達(dá)量存在的差異具有統(tǒng)計(jì)學(xué)意義,提示高糖可能還通過(guò)Rho A/ROCK通路以外的信號(hào)通路誘導(dǎo)EMT。Lee等[13]就曾報(bào)道PI3K/Akt在高糖誘導(dǎo)的腎小管上皮細(xì)胞EMT中起重要作用。
TGF-β1是公認(rèn)致纖維化的細(xì)胞因子,在糖尿病性腎病的發(fā)生和發(fā)展中起重要作用。有研究顯示TGF-β1可以導(dǎo)致腎小管上皮細(xì)胞發(fā)生 EMT[14]。本研究顯示HK-2細(xì)胞在高糖60 mmol·L-1培養(yǎng)條件下培養(yǎng)24和48 h,HK-2細(xì)胞上清液中TGF-β1明顯增多,且隨著刺激時(shí)間的延長(zhǎng)而增多,因此高糖刺激HK-2細(xì)胞發(fā)生EMT可能與TGF-β1介導(dǎo)有關(guān)。本研究發(fā)現(xiàn),經(jīng)法舒地爾同步干預(yù)后,HK-2細(xì)胞上清中的TGF-β1明顯減少,表明法舒地爾抑制腎小管上皮轉(zhuǎn)分化可能部分是通過(guò)抑制TGF-β1的產(chǎn)生而介導(dǎo)的。法舒地爾對(duì)正常糖濃度培養(yǎng)的HK-2細(xì)胞TGF-β1分泌的影響尚有待研究。
總之,本研究結(jié)果顯示,高糖能誘導(dǎo)培養(yǎng)HK-2細(xì)胞發(fā)生EMT,并能激活Rho A分子;Rho A/ROCK通路抑制劑法舒地爾能明顯抑制該轉(zhuǎn)分化過(guò)程;法舒地爾抑制腎小管上皮轉(zhuǎn)分化的作用可能部分是通過(guò)抑制TGF-β1生成而介導(dǎo)的。
[1]Liao JK,Seto M,Noma K.Rho kinase(ROCK)inhibitors[J].J Cardiovasc Pharmacol,2007,50(1):17-24.
[2]Gojo A,Utsunomiya K,Taniguchi K,Yokota T,Ishizawa S,Kanazawa Y,et al.The Rho-kinase inhibitor,fasudil,attenuates diabetic nephropathy in streptozotocin-induced diabetic rats[J].Eur J Pharmacol,2007,568(1-3):242-247.
[3]Peng F,Wu D,Gao B,Ingram AJ,Zhang B,Chorneyko K,et al.RhoA/Rho-kinase contribute to the pathogenesis of diabetic renal disease[J].Diabetes,2008,57(6):1683-1692.
[4]Kikuchi Y, Yamada M, Imakiire T, Kushiyama T,Higashi K,Hyodo N,et al.A Rho-kinase inhibitor,fasudil,prevents development of diabetes and nephropathy in insulin-resistant diabetic rats[J].J Endocrinol,2007,192(3):595-603.
[5]Kolavennu V,Zeng L,Peng H,Wang Y,Danesh FR.Targeting of RhoA/ROCK signaling ameliorates progression of diabetic nephropathy independent of glucose control[J].Diabetes,2008,57(3):714-723.
[6]Gilbert RE,Cooper ME.The tubulointerstitium in progressive diabetic kidney disease:more than an aftermath of glomerular injury[J]?Kidney Int,1999,56(5):1627-1637.
[7]Hayashi K,Wakino S,Kanda T,Homma K,Sugano N,Saruta T.Molecular mechanisms and therapeutic strategies of chronic renal injury:role of rho-kinase in the development of renal injury[J].J Pharmacol Sci,2006,100(1):29-33.
[8]Yang J,Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J].J Am Soc Nephrol,2002,13(1):96-107.
[9]Cheng HX,Yang XP,Zhao J.E-cadherin and renal interstitial fibrosis[J].J Clin Exp Med(臨床和實(shí)驗(yàn)醫(yī)學(xué)雜志),2010,15(9):1184-1187.
[10]Li J,Qu X,Bertram JF.Endothelial-myofibroblast transition contributes to the early development of diabetic renal interstitial fibrosis in streptozotocin-induced diabetic mice[J].Am J Pathol,2009,175(4):1380-1388.
[11]Zhou L,Xue H,Yuan P,Ni J,Yu C,Huang Y,et al.Angiotensin AT1 receptor activation mediates high glucose-induced epithelial-mesenchymal transition in renal proximal tubular cells[J].Clin Exp Pharmacol Physiol,2010,37(9):e152-e157.
[12]Massey AR, Miao L, Smith BN, Liu J,Kusaka I,Zhang JH,et al.Increased RhoA translocation in renal cortex of diabetic rats[J].Life Sci,2003,72(26):2943-2952.
[13]Lee YJ,Han HJ.Troglitazone ameliorates high glucoseinduced EMT and dysfunction of SGLTs through PI3K/Akt,GSK-3β,Snail1,and β-catenin in renal proximal tubule cells[J].Am J Physiol Renal Physiol,2010,298(5):1263-1275.
[14]Lan HY.Tubular epithelial-myofibroblast transdifferentiation mechanisms in proximal tubule cells[J].Curr Opin Nephrol Hypertens,2003,12(1):25-29.

