牛耳楓生物堿F21對HepG-2細胞的抑制作用及機制
曹志然,王永麗,戎瑞雪,王 蓓,王 海
(河北大學基礎醫學院免疫學系,河北保定 071000)
牛耳楓(Daphniphyllum calycinum Benth)是交讓木科(Daphniphyllaceae)交讓木屬(Daphniphyllum)植物,以根、葉入藥,其味苦澀,其功效為清熱解毒,活血舒筋。牛耳楓的葉和種子中均含有生物堿,且結構復雜、形式多變,目前有關牛耳楓生物堿藥理作用的研究主要集中在抗膽堿酯酶活性及殺蟲作用方面,而對于其在抗腫瘤方面的研究報道甚少[1-2]。本課題組采用各種色譜方法從牛耳楓莖葉乙醇浸提物中分離提取到12種生物堿,采用MTT體外抗腫瘤活性的篩選發現生物堿F21在體外對人肝癌細胞株(HepG-2)、人宮頸癌細胞(HeLa)、人肺腺癌細胞(A549)、人神經膠質瘤細胞(U-251)和人乳腺癌細胞株(MCF-7)等均具有一定的抑制作用,其中對HepG-2的抑制作用最強。通過波譜技術及理化性質鑒定 F21化學結構與 deoxycalyciphylline B相似[3]。本研究選擇最敏感的HepG-2作為研究對象,通過腫瘤細胞的形態學變化、瓊脂糖凝膠DNA電泳分析、膜聯蛋白(Annexin)Ⅴ/碘化丙啶(propidium iodide,PI)雙染流式細胞術以及胱天蛋白酶抑制劑阻斷實驗等手段研究F21抗HepG-2的作用及作用機制,為該化合物的開發利用提供實驗依據。
1 材料與方法
1.1 細胞株、試劑及儀器
F21是從牛耳楓的莖葉乙醇浸提物中采用正相硅膠,反相材料(C18,MCI)以及凝膠(Sephadex LH-20,Toyopearl HW-40C)分離得到,獲取率為1.6 mg·kg-1,并運用薄層色譜及層析法純化,其純度為99%;HepG-2細胞株購自中國科學院藥物研究所;RPMI 1640培養基購自美國Gibco公司;胎牛血清購自杭州四季青生物工程材料有限公司;1∶250胰蛋白酶購自北京Solarbio公司;磷酸鹽緩沖液PBS購自北京金杉金橋生物技術有限公司;噻唑藍(MTT)購自Amresco公司;二甲亞砜(DMSO)購自北京Solarbio公司;瑞姬氏染料購自美國Amresco公司;細胞凋亡-DNA Ladder抽提試劑盒、DNA標志物(BeyoRed)、胱天蛋白酶抑制劑Z-VAD-FMK和星形孢菌素(staurosporine,STS)均購自碧云天生物技術研究所;PI購自美國Sigma公司。
潔凈工作臺(SW-CJ-2FD),蘇州安泰空氣技術有限公司;二氧化碳培養箱(HF90),上海力申科學儀器有限公司;倒置顯微鏡(CKX41SF),日本Olympus Corporation;ELX-800全自動酶標儀(ELISA Reader),美國寶特有限公司;臺式高速離心機,美國Sigma公司;DYY-11B電泳儀,北京市六一儀器廠;流式細胞儀,美國BD FACScalibur;HH-4數顯恒溫水浴鍋,國華電器有限公司。
1.2 細胞培養
RPMI 1640完全培養液(含10%熱滅活胎牛血清、0.2%NaHCO3、青霉素 100 kU·L-1、鏈霉素100 mg·L-1),在 37℃、飽和濕度、5%CO2的環境下培養HepG-2細胞,當細胞融合達到70% ~80%時,用胰酶2.5 g·L-1消化成單個細胞接種傳代。取對數生長期的細胞用于實驗。
1.3 MTT法檢測HepG-2細胞存活率
取對數生長期的HepG-2細胞,制備2×107L-1單細胞懸液,以每孔90μl接種于96孔培養板,置于37℃、5%CO2培養箱內培養24 h,細胞貼壁后按照分組分別加入10μl待測樣品,F21終濃度分別為100,50,25,12.5 和 6.25 mg·L-1;溶劑對照組每孔加10μl與待測樣品相應濃度DMSO的培養液,各組均設3個復孔,每塊板均設3個空白對照孔(僅加培養液,無細胞)。置培養箱中繼續培養,分別于20,44和 68 h取出培養板,每孔加 10μl MTT 10 g·L-1,4 h 后終止培養,棄上清,加 DMSO 100 μl振蕩5 min待結晶物充分溶解后,在490 nm波長下測定各孔吸光度值(absorbance,A),計算腫瘤細胞增殖抑制率(IR),IR(%)=(1-A藥物/A溶劑對照) ×100%。改良寇氏法計算半數抑制濃度[4]。
另按每孔8×103個HepG-2細胞接種于96孔板,37℃培養24 h細胞貼壁后進行實驗。設正常對照組、STS50 mol·L-1組、STS+Z-VAD-FMK 組、F21 10 mg·L-1組、F21 10 mg·L-1+Z-VAD-FMK 20 μmol·L-1組、F21 30 mg·L-1組及 F21 30 mg·L-1+Z-VAD-FMK 20 μmol·L-1組,作用 48 h。每個組均設3個復孔,MTT法測定細胞增殖能力并計算各組細胞的增殖抑制率。實驗重復3次。
1.4 瑞姬氏染色觀察細胞形態
取對數生長期的HepG-2細胞,調整細胞密度為1×108L-1,接種于蓋玻片上;37℃恒溫恒濕、5%CO2的培養箱中孵育24 h后,F21組換以含終濃度為10,30和100 mg·L-1的 RPMI 1640培養液,正常對照組加入等體積 RPMI 1640完全培養液,分別繼續培養48 h;瑞姬氏染色并于光鏡下觀察。
1.5 DNA瓊脂糖凝膠電泳
分別取l×106個對數生長期的HepG-2細胞接種于100 ml培養瓶中,置于37℃恒溫恒濕、5%CO2的培養箱孵育24 h;棄上清液,按照分組分別加入含F21 10,30和100 mg·L-1的RPMI 1640培養液,正常對照組加等體積RPMI 1640培養液,繼續培養48 h;細胞收集后按試劑盒說明進行DNA抽提和電泳。
1.6 流式細胞儀檢測HepG-2細胞凋亡率
取對數生長期的HepG-2細胞,調整細胞密度為2×108L-1,置于37℃恒溫恒濕、5%CO2的培養箱孵育24 h;按照分組分別加入含 F21 10,30和100 mg·L-1的RPMI 1640培養液,正常對照組只加入RPMI 1640培養液,繼續培養48 h,收集細胞、PBS緩沖液洗滌后,FITC-Annexin-Ⅴ/PI雙染流式細胞儀檢測。
1.7 統計學分析
2 結果
2.1 F21對HepG-2細胞存活的影響
表1結果顯示,F21對人腫瘤細胞HepG-2有顯著的抑制作用,且其抑制作用具有較好的時效(F=65.59,P <0.05)和量效(F=232.39,P < 0.05)關系,在 24,48 和 72 h 的 IC50值分別為 5.3 ±0.1,1.3 ±0.1和(0.13 ±0.1)mg·L-1。
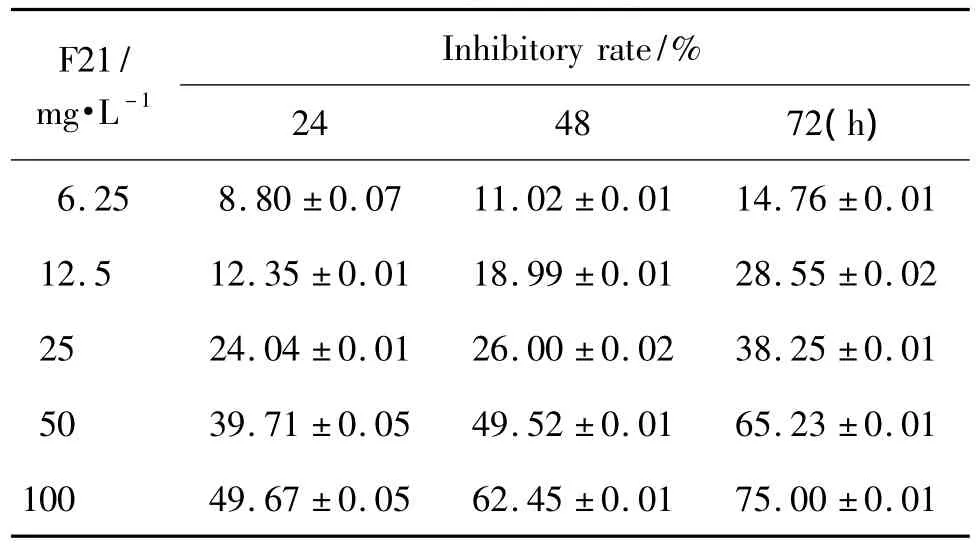
Tab.1 Effect of F21 on HepG-2 cell porliferation
2.2 F21對HepG-2細胞形態的影響
正常對照組細胞膜完整,胞漿呈藍色,胞質均勻,細胞核完整,染成紫紅色,核仁明顯(圖1A)。F21 10 mg·L-1處理48 h后,表現為細胞體積增大,胞質內細胞核周圍出現大量空泡,且密度降低,但細胞膜及細胞核保持完整(圖1B)。F21 30 mg·L-1處理后,細胞膜完整性破壞,胞漿內有空泡形成,細胞核破碎,且密度降低(圖1C)。F21 100 mg·L-1處理后細胞破壞嚴重,細胞形態消失(圖1D)。
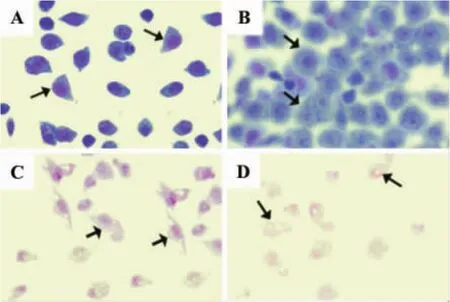
Fig.1 Effect of F21 on HepG-2 cell morphology(Wright-Giemsa ×20).A:normal control group;B:F21 10 mg·L-1 group;C:F21 30 mg·L-1 group;D:F21 100 mg·L-1 group.Arrow shows typical morphological changes.
2.3 F21對HepG-2細胞凋亡的影響
2.3.1 DNA 瓊脂糖凝膠電泳
如圖2所見,正常對照組未見明顯的DNA降解片段,F21 10,30 和 100 mg·L-1處理 HepG-2 細胞48 h后,均未見特征性的DNA梯狀條帶。
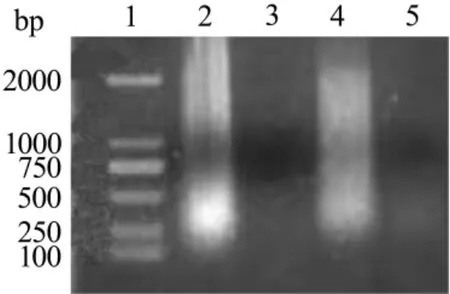
Fig.2 Effect of F21 on HepG-2 cell apoptosis by agarose gel electrophoresis.Lane 1:DNA ladder marker;lane 2:normal control group;lane 3:F21 10 mg· L-1 group;lane 4:F21 30 mg·L-1 group;lane 5:F21 100 mg·L-1 group.
2.3.2 流式細胞術
圖3 結果顯示,F21 10,30 和100 mg·L-1處理細胞48 h后,HepG-2細胞晚期凋亡率分別為(17.34±0.01)%,(25.45 ±0.01)% 和(43.67 ±0.03)%,與正常對照組比較,均有顯著差異(P<0.05),且隨濃度增加,其凋亡率也增加(P<0.05)。
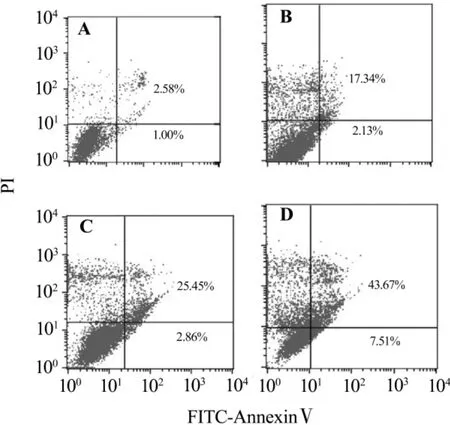
Fig.3 Effect of F21 on HepG-2 cell apoptosis by flow cytometry.A:normal control group;B:F21 10 mg·L-1 group;C:F21 30 mg·L-1 group;D:F21 100 mg·L-1 group.
2.4 Z-VAD-MFK對F21抑瘤活性的影響
表2結果顯示,與正常對照相比,單獨F21 10和 30 mg·L-1及 STS 50 mol·L-1處理 12 h 后,細胞活力明顯降低(P<0.05),F21+Z-VAD-FMK聯用組細胞存活率也明顯降低(P<0.05);與單用F21細胞相比,F21+Z-VAD-FMK組細胞存活率無顯著差異;與單用STS組相比,F21+Z-VAD-FMK組細胞存活率增加(P<0.05)。此結果表明F21對HepG-2細胞殺傷不被胱天蛋白酶抑制劑阻斷,即其殺傷腫瘤細胞的作用機制并非與胱天蛋白酶激活通路有關。
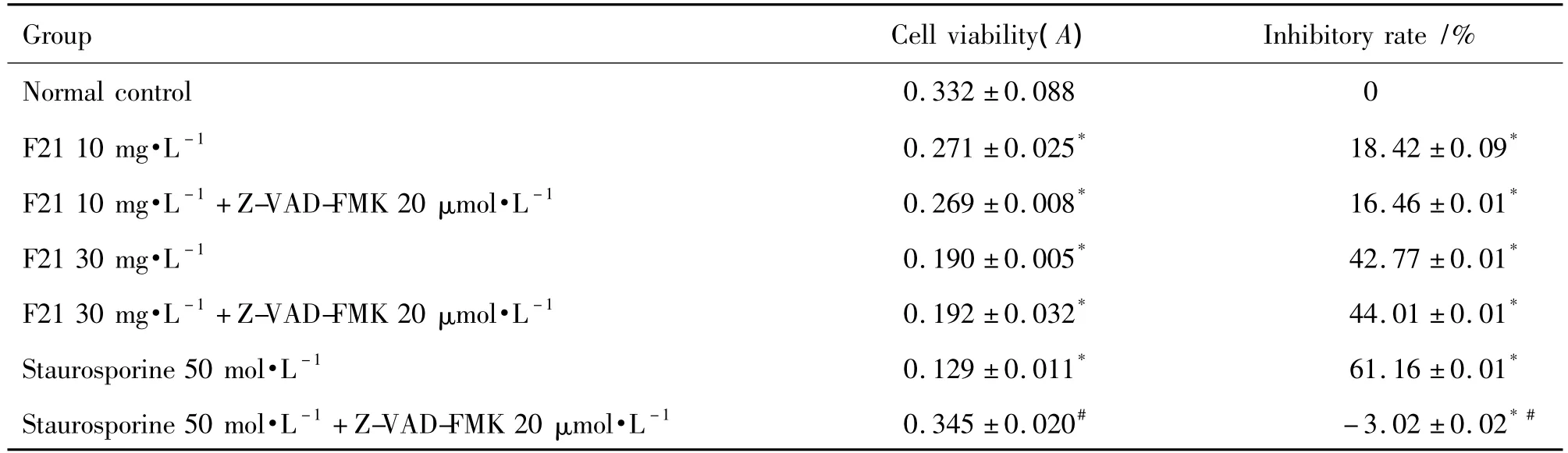
Tab.2 Effect of Z-VAD-FMK on proliferation of Hep G-2 cells
3 討論
自第一個植物來源的生物堿類抗腫瘤藥長春堿1960年8月在美國上市以來,生物堿類抗腫瘤藥的發展十分迅速。特別是紫杉醇和喜樹堿的出現,成為抗腫瘤藥具有劃時代意義的藥物。研究表明生物堿抗腫瘤作用主要通過:① 作用于細胞微管,抑制其解聚或聚合;②抑制拓撲異構酶Ⅰ活性;③ 誘導細胞凋亡;④誘導腫瘤細胞分化和抑制腫瘤細胞增殖;⑤ 作用于細胞膜等[5-6]。
本研究結果表明牛耳楓生物堿F21可明顯抑制HepG-2細胞的增殖,且有明顯的時效和量效關系,形態學實驗結果表明,F21可使細胞出現明顯的形態學變化,隨著劑量的增加細胞膜完整性開始遭到破壞,最終致細胞核破碎,且伴隨著整個細胞的密度大幅降低,表明F21可通過引起細胞死亡而發揮抗腫瘤作用。
一般認為細胞死亡的方式主要有細胞壞死和細胞凋亡[7],最新研究發現一種新的非凋亡性程序性死亡稱為 paraptosis[8]。Paraptosis在形態學上與凋亡不同,不具有凋亡的典型特征,即缺少染色質的新月形凝集和凋亡小體。它是以胞漿空泡的形成為特征,在整個過程中胞漿和胞核密度增加,線粒體腫脹,但細胞膜和細胞器仍保持完整;無階梯狀DNA梯帶;paraptosis過程為胱天蛋白酶非依賴性的,而細胞凋亡典型的形態學變化為核固縮,有凋亡小體形成,DNA出現階梯帶變化,細胞凋亡過程為胱天蛋白酶依賴性[10-12]。本研究結果顯示小劑量的F21(10 mg·L-1)引起的細胞死亡從形態上看既不同于細胞壞死又不同于細胞凋亡,而類似于paraptosis。
本研究的瓊脂糖凝膠電泳中沒有出現典型的凋亡梯帶。3次重復試驗結果發現不同劑量F21作用后出現了不同的DNA梯帶,關于造成此實驗結果的機制有待于進一步研究。流式細胞儀檢測顯示F21可誘導HepG-2細胞死亡,且隨濃度增加,其死亡率也增加。實驗結果未出現明顯的早期凋亡,表明F21誘導HepG-2細胞死亡方式不同于典型的細胞凋亡。此外,凋亡抑制試驗表明F21誘導的細胞死亡不被胱天蛋白酶抑制劑Z-VAD-FMK所抑制,即F21誘導的細胞死亡沒有發生胱天蛋白酶的活化。
綜上所述,根據形態學觀察以及各種凋亡檢測方法的進一步分析表明,F21可能通過類似于paraptosis的方式引起HepG-2細胞的死亡并發揮抗腫瘤作用,有可能發展成一種新的抗腫瘤藥物,其確切作用機制尚待進一步研究。
[1]Rao GW.The study on the Daphniphyllum calycinum Benth alkaloids and activity of anticholinesterase[D].Hangzhou:Zhejiang Industrial Univerisity,2009.
[2]Liu W, Xiao T, Du L, Xue CB,Yang F,Luo WC.Inhibitory effects of two compounds extracted from Daphniphyllum calycinum on phenoloxidase of Spodoptera exigua[J].Sci Agric Sin(中國農業科學),2009,42(10):3720-3725.
[3]Zhu WL,Luo DQ,Liu ZY.Alkaloids from Daphniphyllum calycinum Benth[J].Nat Prod Res Dev(天然產物研究與開發),2010,22(6):1024-1027.
[4]Yam J,Reer PJ,Bruce RD.Comparison of the up-anddown method and the fixed-dose procedure for acute oral toxicity testing[J].Food Chem Toxicol,1991,29(4):259-263.
[5]Nagappan T,Ramasamy P,Wahid ME,Segaran TC,Vairappan CS.Biological activity of carbazole alkaloids and essential oil of Murraya koenigi against antibiotic resistant microbes and cancer cell lines[J].Molecules,2011,16(11):9651-9664.
[6]Lü CX,Fan TJ,Hu GB,Cong RS.Apoptosis-inducing factor and apoptosis[J].Acta Biochim Biophys Sin(生物化學與生物物理學報),2003,35(10):881-885.
[7]Sperandio S,Poksay K,de Belle I,Lafuente MJ,Liu B,Nasir J,et al.Paraptosis:mediation by MAPkinases and inhibition by AIP-1/Alix[J].Cell Death Differ,2004,11(10):1066-1075.
[8]Br?ker LE,Kruyt FA,Giaccone G.Cell death independent of caspases:a review[J].Clin Cancer Res,2005,11(9):3155-3162.
[9]Chen TS,Wang XP,Sun L,Wang HY,Wang LX.Real time fluorescence analysis of Taxol induced human lung denocarcinoma(ASTC-a-1)PCD[J].J Optoelectronics Laser(光電子·激光),2008,19(12):1706-1709.
[10]Chen TS,Wang XP,Sun L,Wang HY,Wang LX.Fluorescence analysis of taxol induced paraptosis like independent of caspase 3 activation[J].Spectroscopy Spectral Analysis(光譜學與光譜分析),2008,28(11):2623-2627.
[11]Leng YF,Jin HY.Paraptosis forms of programmed cell death presentin sensory neurons at spinal cord dorsal horn after chronic constriction injury of the sciatic nerve inrats[J].Chin J Pain Med(中國疼痛醫學雜志),2009,15(1):23-26.
[12]Xie ST. Antimicrobial and antitumor activity of trichokonins from Trichoderma k?ningii SMF2[D].Jinan:Shandong University,2007.

