三七總皂苷腸溶膠囊在比格犬體內的藥代動力學
秦艷娥,劉華鋼,賴 玲,陸仕華,文 麗,陳 明,劉冠萍
(1.廣西醫科大學藥學院,廣西南寧 530021;2.廣西中醫學院,廣西南寧 530001;3.廣西梧州制藥(集團)股份有限公司,廣西梧州 543000)
三七總皂苷(Panax notoginseng saponins,PNS)是中藥三七的主要成分,具有擴張血管、降低心肌耗氧量和抑制血小板凝集等藥理作用,目前主要應用于心腦血管系統疾病[1]。其中,三七皂苷R1、人參皂苷Rb1和Rg1是PNS的主要活性成分。PNS在臨床上的給藥途徑主要為注射和口服,據資料記載[2-3],口服制劑的生物利用度不高。本實驗通過研究自制的PNS腸溶膠囊在比格犬體內的藥代動力學,與市售的血栓通膠囊對照,旨在研制生物利用度較高的PNS口服制劑。
1 材料與方法
1.1 藥物和試劑
三七皂苷R1對照品(批號110745-200415)、人參皂苷Rg1對照品(批號110704-200318)、人參皂苷Rb1對照品(批號110703-200424)、淫羊藿苷(icariin)對照品(批號110737-200413)由中國藥品生物制品檢定所提供。血栓通膠囊(批號20101014)哈爾濱珍寶制藥有限公司。甲醇(色譜純)購自美國Fisher Scientific公司,乙腈(色譜純)購自美國Tedia公司,PNS由梧州制藥集團股份有限公司惠贈。
1.2 動物
比格犬,雄性,體質量8~10 kg;由廣州醫藥工業研究院提供,動物生產許可證:SCXK(粵)2008-0007。
1.3 儀器
高效液相色譜儀(LC-10AT泵,SPD-10A紫外檢測器)(日本島津公司);Sartorius電子天平;BS224S電子天平;DT-230A柱溫箱;SK-1旋渦混合器(蘇州威爾實驗用品有限公司);TGL-16G-A高速冷凍離心機(上海安亭科學儀器廠);101AS-2數顯電熱恒溫干燥箱(上海浦東榮豐科學儀器有限公司)。
1.4 比格犬給藥方案和血樣采集
采用雙周期自身對照交叉實驗設計方法進行實驗,將6只成年健康的比格犬隨機分為2組,每組3只。每組犬禁食12 h(自由飲水)后,分別喂飼PNS腸溶膠囊(受試制劑)13顆(折合犬給R1,Rg1,Rb1的量分別為 8.2,46.8,31.5 mg·kg-1)或者血栓通膠囊(參比制劑)20顆(折合犬給R1,Rg1,Rb1的量分別為 10.5,57.9,43.4 mg·kg-1)。分別于藥后 0.5,1,1.5,2,2.5,3,3.5,4,6 和 8 h 前肢靜脈采血4 ml,血樣置于肝素化Eppendorf(ep)管中,800×g離心10 min,分離血漿置于-20℃冰箱保存備用。間隔7 d后交叉服藥。
1.5 血漿中PNS的測定
1.5.1 PNS儲備液和內標儲備溶液的配置
分別精密稱取 R12.4 mg,Rb113.6 mg,Rg19.2 mg,加甲醇溶解,定容至 10 ml,濃度分別為237.3,1363.1,917.5 mg·L-1作為 PNS 對照品貯備液。精密稱取內標淫羊藿苷1.8 mg,加甲醇溶解,定容至100 ml作為內標溶液。
1.5.2 血漿樣品預處理
精密量取比格犬血漿樣品2 ml,精確加入20μl內標(internal standard,IS)淫羊藿苷溶液18 mg·L-1和甲醇∶乙腈 =1∶1的混合液 6 ml,漩渦混合 2 min,以800×g離心10 min。吸取上層混合液于ep管中,40℃水浴吹干混合液后,殘渣用0.20 ml甲醇溶解,漩渦混合1 min,800×g離心10 min。
1.5.3 色譜條件
色譜柱為Welchrom-C18柱(4.6 mm×250 mm,5μm);流動相為乙腈-水,線性梯度洗脫:0 min(V/V,21∶79)~15 min(V/V,40∶60)~18 min(V/V,45∶55)~20 min(V/V,21∶79)~25 min(V/V,21∶79);流速:1.0 ml·min-1;進樣量:20 μl;紫外檢測波長:203 nm;柱溫:30℃。
1.5.4 標準曲線的繪制
在離心管中分別加入不同體積的PNS對照品溶液,40℃水浴吹干甲醇后,分別加入空白血漿0.2 ml,配制成含不同濃度PNS的生物樣品。按前述1.5.2項方法進行操作,在上述色譜條件下測定PNS中R1,Rg1,Rb1與內標的峰面積之比為縱坐標,以濃度為橫坐標,進行線性回歸。
1.6 基于曲線下面積(area under curve,AUC)自定義權重系數(ωj)的PNS整合藥動學模型的建立[4]
根據PNS給藥后測得的血藥濃度-時間數據,應用3P97實用藥動學計算機程序,獲得R1,Rb1和Rg1的AUC0→∞數據,根據各成分在 3種成分總AUC0→∞中所占比值自定義各成分在綜合濃度中的(ωj),將每一時間點下3種單體成分的血藥濃度賦以各自的權重系數,求算PNS的綜合濃度,進一步進行整合藥動學參數的研究。PNS各成分自定義權重系數及綜合濃度的計算公式如下:
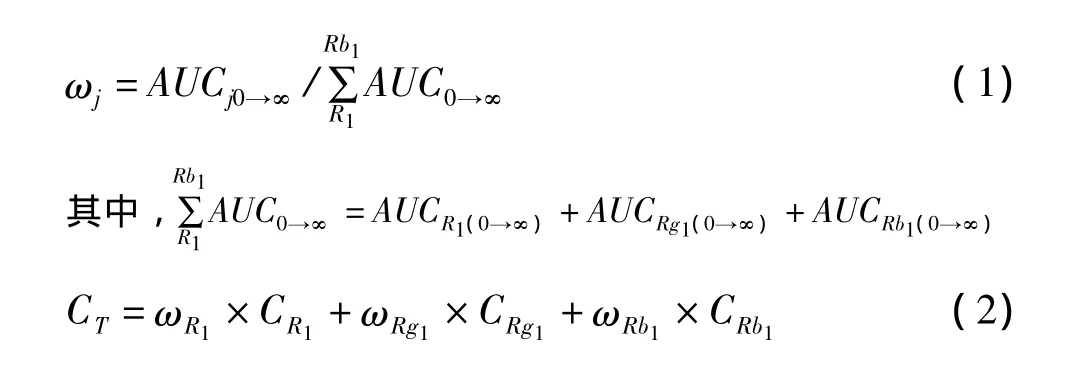
式中,j分別代表R1,Rb1和Rg1;ωj表示上述成分AUC在3種成分總AUC中的比值;CT為自定義權重系數校正后PNS在犬體內的綜合濃度。
2 結果
2.1 血漿中PNS質量濃度的方法學確認
2.1.1 方法專屬性
按前述色譜條件和血漿處理方法處理和檢測空白血漿、加藥血漿和血漿樣品見圖1。R1,Rg1,Rb1與內標淫羊藿苷的保留時間分別為12.5,13.7,21.0及17.5 min,峰形良好,分離完全,無雜質干擾。
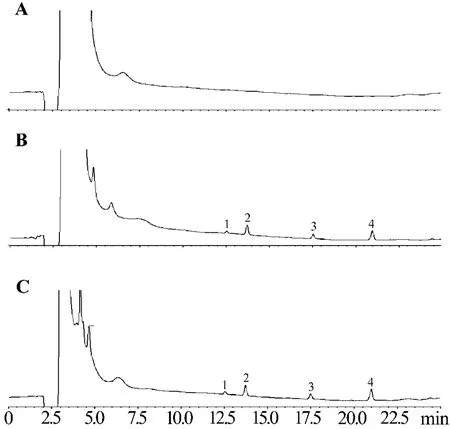
Fig.1 Chromatograms of Panax notoginseng saponins(PNS)by HPLC.A:blank plasma;B:plasma spiked with R1,Rg1,icariin and Rb1(1.1,4.4,3.6 and 3.2 mg·L -1)standard;C:plasma sample of PNSenteric-coated capsules in dogs after po 86.2 mg·kg-1 for 1.5 h.1:notoginsenoside R1;2:ginsenoside Rg1;3:icariin;4:ginsenoside Rb1.
2.1.2 標準曲線
R1,Rg1和Rb1的校正標準曲線方程分別為:Y=22.266X -2.4731(r=0.9981);Y=24.95X -30.463(r=0.9965)以及 Y=31.886X -14.511(r=0.9983)。R1,Rg1和 Rb1線性范圍分別為 1.0 ~79.1 mg·L-1,0.9 ~ 90.9 mg·L-1和0.9 ~91.8 mg·L-1;檢測限分別為0.1,0.2和0.2 mg·L-1;定量限分別為 0.3,0.4 和0.4 mg·L-1。
2.1.3 回收率
由表1可見,在實驗濃度范圍內,R1,Rg1,Rb1在血漿中的提取回收率均大于50%,完全符合生物樣品分析的要求[5]。
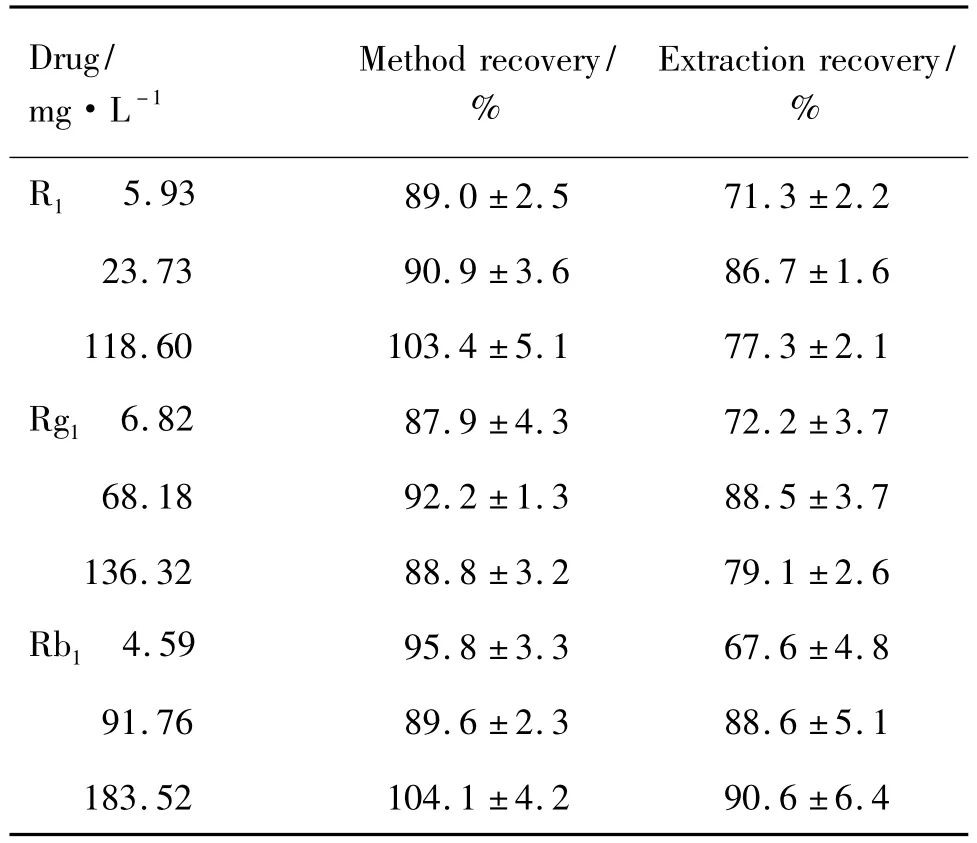
Tab.1 Method recovery and extraction recovery of HPLC assay
2.1.4 精密度和穩定性
測得 R1,Rg1和 Rb1的日內相對標準偏差(RSD)均小于2.0%,日間RSD均小于3.0%。24 h內樣品在常溫及4℃冰箱中的質量濃度沒有明顯的變化(RSD <1.9%)。
2.2 犬體內藥代動力學
受試制劑、參比制劑和整合后的平均血藥濃度-時間曲線見圖2。應用3P97實用藥物動力學計算機程序,根據殘差平方和(SUM)、Akaike(AIC)法、擬合度法(r2)等房室模型判斷標準進行選擇,以一室模型,權重為1/C2時,效果最好,主要藥動學參數計算結果見表2。
經劑量換算后,R1,Rb1,Rg1和各成分的AUC整合后PNS的相對生物利用度分別為248.41%,107.19%,152.94%和155.31%。所得到的 PNS 在犬體內整合血藥濃度-時間曲線符合經典的藥動學特征,可用經典的房室模型進行整合藥動學參數的求算。基于AUC0-∞自定義ωj的PNS整合藥動學參數見表3。
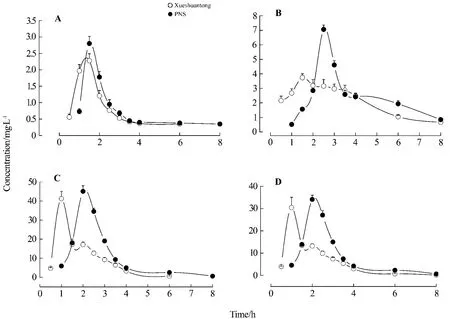
Fig.2 Plasma concentration-time profiles of PNS after PNS enteric-coated capsules and Xueshuantong capsule given to Beagle dogs.A:notoginsenoside R1;B:ginsenoside Rg1;C:ginsenoside Rb1;D:plasma concentration-time profiles of PNSafter integration.±s,n=6.
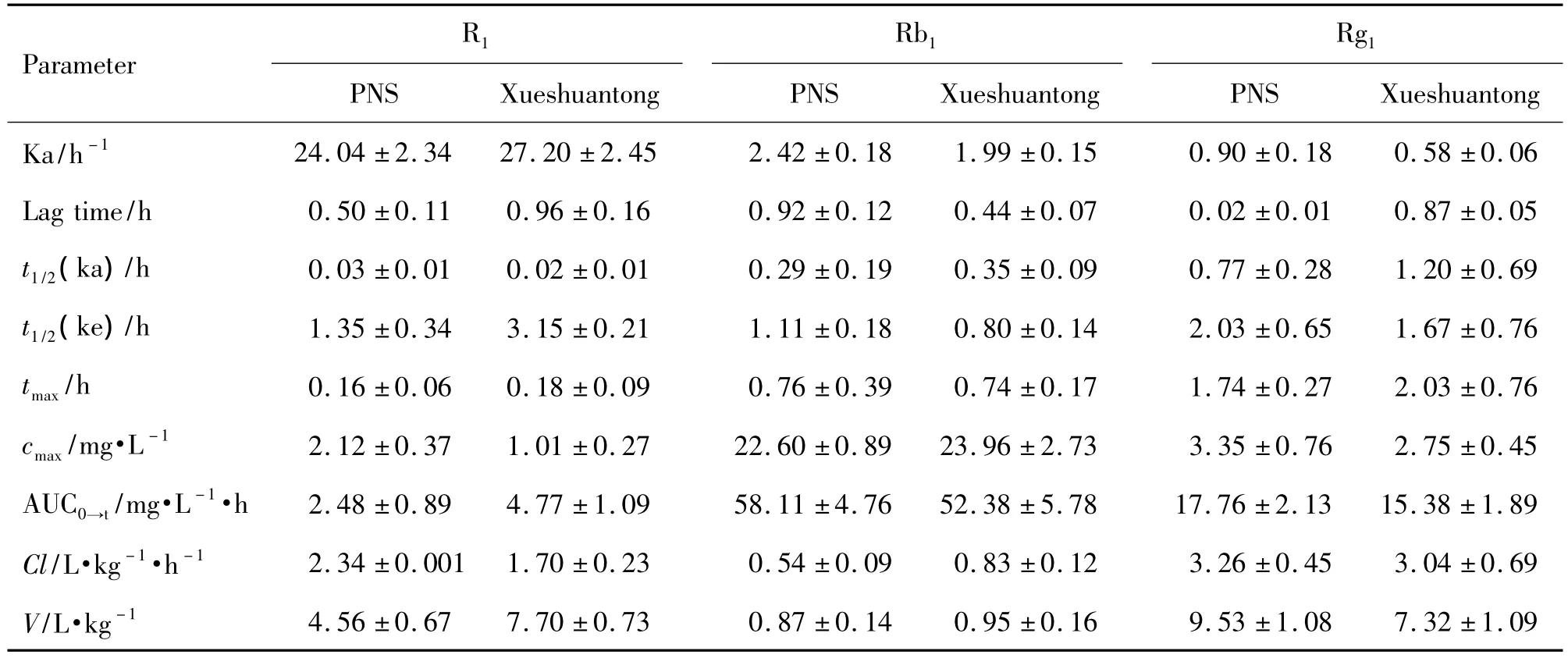
Tab.2 Main pharmacokinetic parameters of PNS enteric-coated capsules and Xueshuantong capsule in dogs
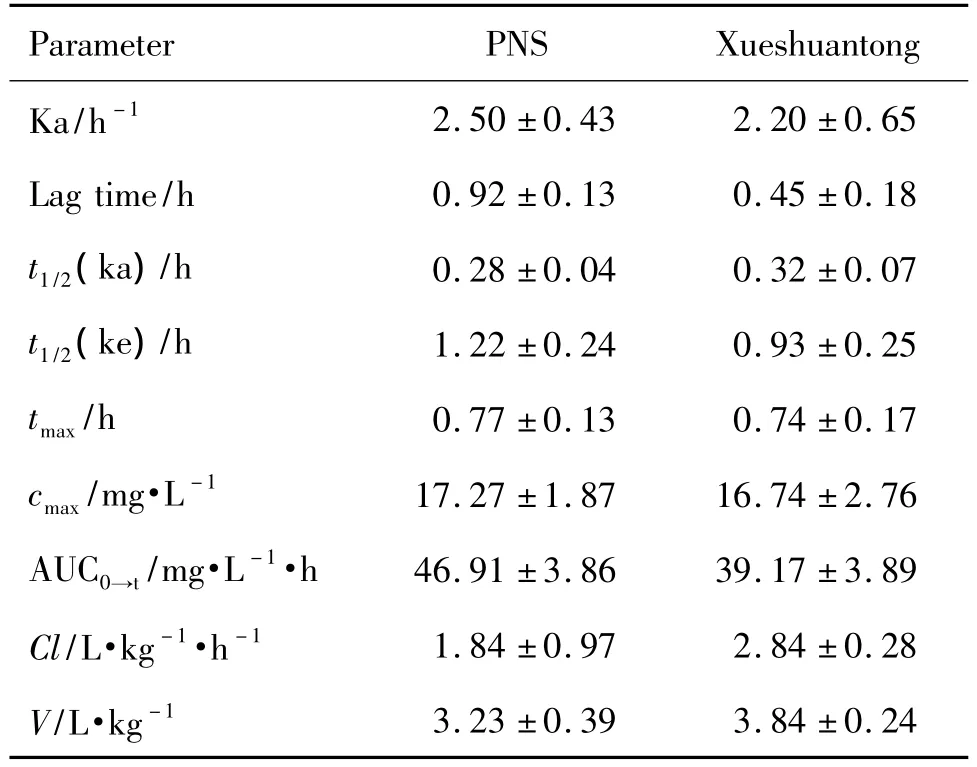
Tab.3 Main pharmacokinetic parameters of PNS entericcoated capsule and Xueshuantong capsule in dogs after the integration of blood concentration based on AUC0→∞
3 討論
本課題組建立了比格犬血漿中PNS濃度的RPHPLC測定方法,以淫羊藿苷為內標采用梯度洗脫,在此條件下基線平穩,各主要測定峰能達到良好分離;血樣處理方法較為簡單,適用于PNS體內濃度分析。
由于梧州制藥提供的PNS中3種皂苷的含量和血栓通膠囊的不同,因此在犬給藥時,無法做到各種皂苷的給藥量一致,計算相對生物利用度時,都會進行計量折算。
本實驗研究發現PNS中3種主要成分R1,Rb1和Rg1在犬體內的藥動學參數差異較大,很顯然,任何單一成分的藥動學行為均不能用于表征PNS的整體藥動學行為。基于AUC0→∞分析的PNS整合藥動學能夠更科學地反映PNS在犬體內的藥動學行為[4]。
PNS在胃液內不穩定,各種有效成分主要在小腸吸收[6]。腸溶膠囊殼能有效的保護PNS到達小腸,從而提高生物利用度。對自制的PNS腸溶膠囊進行了體內藥動學研究,結果顯示,與參比制劑相比,藥物在犬體內吸收的達峰時間和延遲時間均延長。基于AUC0→∞分析的PNS整合藥動學也有相同的結論。由于PNS中三種成分的相對分子質量和極性較大,比較難透過腸壁類脂膜,因此其絕對生物利用度較低。一些體外研究表明吸收促進劑能促進PNS透膜吸收[7],那么在體內吸收促進劑的效果如何,需要進一步的研究。本實驗對于這種分子質量和極性較大、在胃液中不穩定的物質的口服制劑的開發和研究,提供了參考借鑒。
[1]Zhang JF,Zhang DF.Study advancement in pharmalcological actions of total saponins of Panax notoginseseng[J].Med Recapit(醫學綜述),2007,13(6):472-474.
[2]Li XY,Hao HP,Wang GJ,Sun JG,Liang Y,Xie L,et al.Integrated pharmacokinetic study of multiple effective components contained in total Panax notoginsenoside[J].Chin Nat Med(中國天然藥物),2008,6(5):377-381.
[3]Wang Y,Liu TH,Wang W,Wang BX.Research on the transformation of ginsenoside Rg1by intestinal flora[J].China J Chin Mater Med(中國中藥雜志),2001,26(3):188-190.
[4]Hasegawa H, Sung JH, Matsumiya S,Uchiyama M.Main ginseng saponin metabolites formed by intestinal bacteria[J].Planta Med,1996,62(5):453-457.
[5]Yu ZG.Establish and validate biopharmarceutical analysis method[M]∥Li HZ.Biopharmarceutical Analysis(體內藥物分析).Beijing:China Medical Science Press,2003:130.
[6]Han M.Studies on oral absorption of Panax notoginsenoside(PNS)and preparation of W/O microemulsion for oral administration[D].Shanghai:Fudan University,2006.
[7]Feng L,Jiang XH,Zhou J,Yang JY.Studies on absorption kinetics of sanchinoside R1and ginsenoside Rg1in rat intestine[J].Chin Pharm J(中國藥學雜志),2006,41(14):1097-1102.

