利用秀麗隱桿線蟲初步評價藥物急性毒性
周雨朦,朱春寶,陳代杰,李繼安
(中國醫藥工業研究總院上海醫藥工業研究院,上海 200040)
秀麗隱桿線蟲(Caenorhabditis elegans,C.elegans)是一種經典的模式生物,因其結構簡單、通體透明、繁殖快、生命周期短和易于實驗室培養,被廣泛用于生命科學等領域。近年來,C.elegans又被用于藥物篩選研究和環境毒性檢測與生態毒理學研究。目前,已經建立了 C.elegans高通量藥物篩選模型[1-3]和基于C.elegans的不同種類化合物篩選方法(如抗感染藥物[4-6]、小分子鈣離子通道拮抗劑[7]和抗衰老藥物[1]。在環境毒性檢測中,已初步建立了 C.elegans液態環境研究方法[8-9];利用C.elegans檢測環境中化學試劑、重金屬離子等毒性[10-11]。但是,利用 C.elegans對各類藥物進行毒性評估,還沒有相關的研究報道。因此,本研究采用C.elegans對4大類抗感染抗生素,包括青霉素類、四環素類、氨基糖苷類、大環內酯類和3種抗腫瘤藥物進行毒性評估,統計經過待測藥物處理若干時間后線蟲的存活率。這種存活率不僅反映待測藥物的綜合質量,同時也反映了藥物隨時間在線蟲體內的積累效應。通過了解不同種類藥物對線蟲的毒性,掌握化合物毒性范圍,為進一步哺乳動物毒性實驗提供依據。初步建立非哺乳動物——C.elegans藥物急性毒性評價體系。
1 材料與方法
1.1 藥物和儀器
青霉素(penicillin)、苯唑西林鈉(oxacillin sodium)、氨芐西林(ampicillin)、紅霉素(erythromycin)、阿奇霉素(azithromycin)、鹽酸四環素(tetracycline hydrochloride)、鹽酸金霉素(chlortetracycline hydrochloride)、土霉素 (oxytetracycline)、鏈霉素(streptomycin)、妥布霉素(tobramycin)、卡那霉素(kanamycin)、硫酸慶大霉素(gentamicin sulfate)、硫酸西索米星(sisomicin sulfate)、阿米卡星(amikacin)和絲裂霉素C(mitomycin C)由本實驗室保藏,純度在99%以上。柔紅霉素(daunorubicin)和多柔比星(doxorubicin)購自Pharmacia&Upjohn公司。NV-T型體視顯微鏡(配視頻攝像器)為上海精密儀器儀表有限公司產品。
1.2 秀麗隱桿線蟲的培養
C.elegans WT Bristol N2[12]由復旦大學附屬華山醫院中西醫結合研究所惠贈,glp-4(bn2ts);sek-1(km4)[6]由哈佛大學醫學院遺傳學部提供,均飼養于涂布E.coli OP50的標準線蟲培養基(NGM)[13]中。E.coli OP50采用 Luria-Bertani培養基(LB培養基)進行培養。
1.3 藥物毒性的測定
將處于產卵階段的線蟲進行同期化處理[17],從平板上收集孕蟲,清洗,最后剩約500μl蟲懸液,之后加入400μl漂白劑(5%NaClO)和100μl NaOH 5 mol·L-1,漩渦振蕩3~4 min至蟲體大部分溶解,然后加入無菌水稀釋,1300×g離心1 min,棄上層液體,再清洗1次,收集同步化生長的蟲卵。將蟲卵置于M9緩沖液[14]中15℃過夜孵育至 L1期。之后,將L1期線蟲轉接到覆有E.coli OP50的NGM培養基上,25℃培養48~52 h到L4期(不孕階段),用M9緩沖液將其從平板上洗下,重懸,清洗,收集蟲體進行藥物急性毒性實驗。本實驗全部采用處于幼蟲發育后期L4期的線蟲進行毒性考察實驗。
配制不同濃度梯度的待檢測藥物溶液(表1)。將100μl配制好的待測藥物溶液加入無菌的96孔板中,然后再轉入100μl含20條的線蟲溶液,最終毒性考察體系為200μl。每個藥物濃度梯度做3個復孔,以不含藥物的線蟲溶液體系作為空白對照。在染毒后第1天,統計線蟲存活率,之后每隔1 d,觀察線蟲的存活情況,直到第7天。線蟲身體僵直,用探針觸碰沒有反應,判定為死亡。
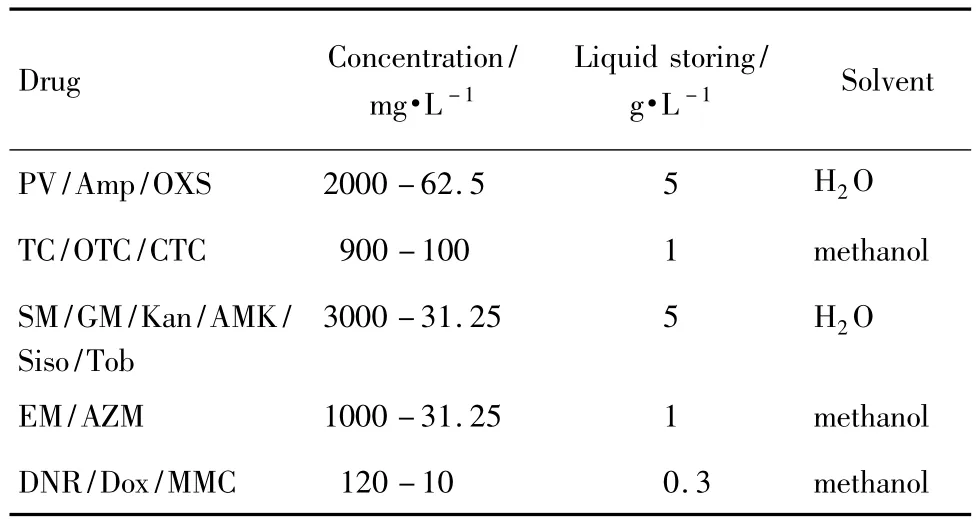
Tab.1 Preparation of drugs
1.4 統計學分析
實驗均重復3次,線蟲生存統計數據使用GraphPad Prism 5.01軟件。采用Kaplan-Meier方法進行生存分析,log-rank檢驗法對組間的數據進行差異顯著性分析。毒性實驗結果采用Origin Pro 8.0軟件處理分析,利用DoseResp函數進行擬合,并計算藥物半致死劑量(LC50),并且采用t檢驗法進行組間差異顯著性分析。
2 結果
2.1 不同品系線蟲對藥物毒性的敏感度
實驗考察野生型N2和突變型glp-4;sek-1線蟲分別在含紅霉素250 mg·L-1、四環素或是多柔比星50 mg·L-1染毒體系中,7 d內的存活情況。如圖1所示,在相同毒性體系中,glp-4;sek-1線蟲的死亡速率要大于N2線蟲的死亡速率。在紅霉素250 mg·L-1染毒體系中,N2線蟲的半數死亡天數為5 d,glp-4;sek-1線蟲的半數死亡天數為3 d(P<0.01);在四環素 250 mg·L-1染毒體系中,N2 線蟲的半數死亡天數為7 d、glp-4;sek-1線蟲的半數死亡天數為 5 d(四環素 P<0.01);在多柔比星50 mg·L-1染毒體系中,N2線蟲的半數死亡天數>7 d、glp-4;sek-1線蟲的半數死亡天數為 3 d(P<0.01)。結果表明兩種品系的線蟲對藥物毒性的敏感度具有顯著性差異,glp-4;sek-1與N2線蟲相比藥物的毒性更敏感。
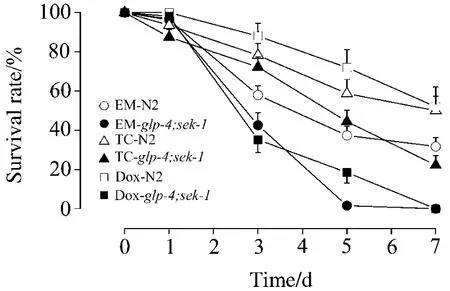
Fig.1 Effect of EM,TC and Dox on N2 and glp-4;sek-1 survival rate.EM 250 mg·L -1;TC 250 mg·L -1;Dox 50 mg·L -1.
2.2 大環內酯類藥物毒性
考察紅霉素和阿奇霉素對線蟲的急性毒性,選取染毒72 h后的數據進行函數擬合(圖2),相關系數R2均在0.99左右,表明存在典型的劑量-效應關系。紅霉素對N2和glp-4;sek-1線蟲的72 h半致死劑量〔LC50(72 h)〕分別 為 250 mg·L-1和120 mg·L-1;而阿奇霉素分別為 411 mg·L-1和286 mg·L-1。以上數據可以看出:① 在 N2和glp-4;sek-1線蟲評估體系中,紅霉素的毒性均要大于阿奇霉素毒性(P<0.05)。此結果與小鼠急性毒性實驗結果相一致(表2)。②glp-4;sek-1與N2線蟲相比對紅霉素和阿奇霉素的藥物毒性更敏感。目前,glp-4;sek-1線蟲已用于抗細菌和真菌感染藥物的高通量篩選[2-3]。作為常用的藥物篩選模型,并且具有對藥物毒性敏感度強的特性,因此,后續研究均采用glp-4;sek-1線蟲考察藥物毒性。
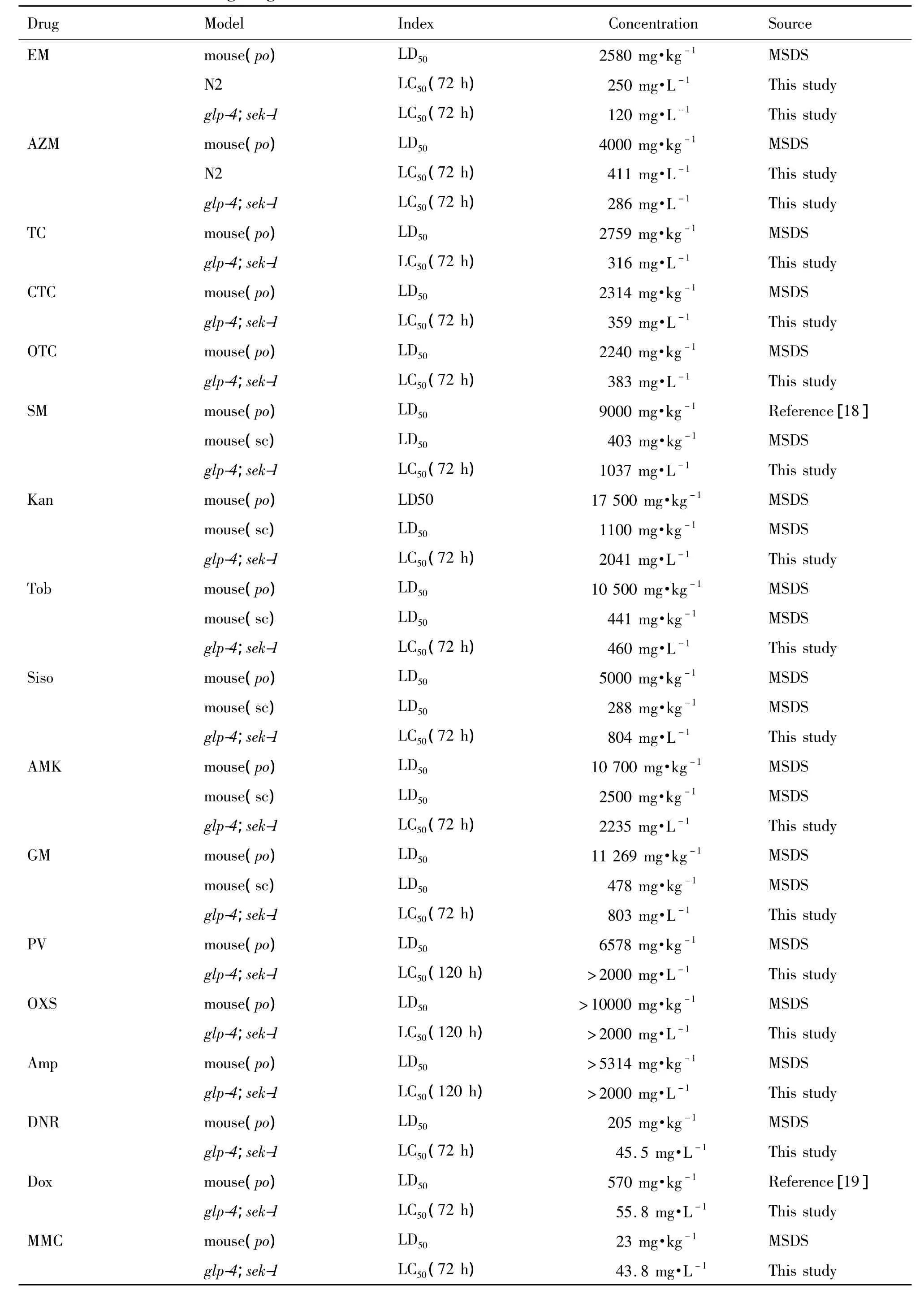
Tab.2 Toxic index of testing drugs
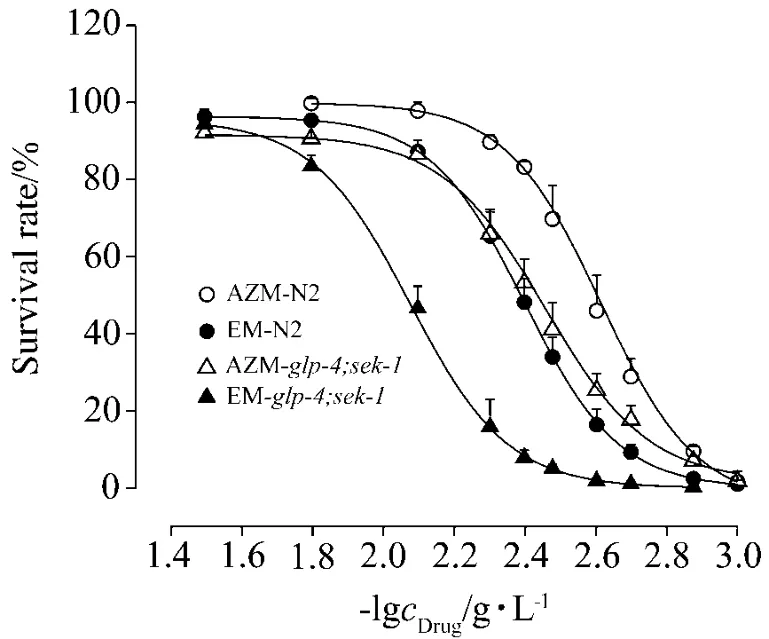
Fig.2 Effect of EM and AZM on N2 and glp-4;Sek-1 survival rate.Data was fitted with DoseResp.
2.3 四環素類藥物的毒性
采用上述方法進行數據分析和擬合(R2均在0.99左右),四環素、土霉素和金霉素的LC50(72 h)分別為316,383和359 mg·L-1(圖3)。在線蟲評估體系中,四環素、土霉素和金霉素的藥物毒性相當,與資料顯示(表2)的小鼠口服急性毒性實驗結果相一致。
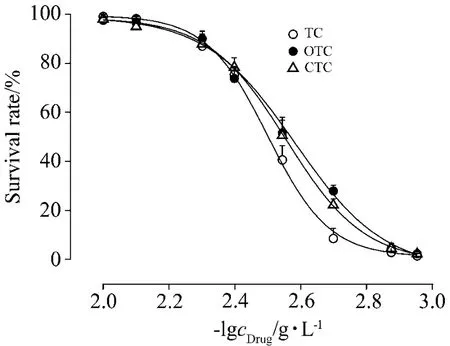
Fig.3 Concentration-response curve for the toxicity of TC,OTC and CTC.Data were fitted with DoseResp.
2.4 氨基糖苷類藥物的毒性
對6種氨基糖苷類藥物進行線蟲毒性考察,記錄染毒72 h后線蟲存活數據,對數據進行分析擬合(圖4)。6種藥物對線蟲的毒性大小為:妥布霉素>慶大霉素>西索米星>鏈霉素>卡那霉素>阿米卡星;大致分為3個等級:阿米卡星和卡那霉素LC50(72 h)>2000 mg·L-1;鏈霉素、西索米星和慶大霉素LC50(72 h)在 1000 mg·L-1左右;妥布霉素LC50(72 h)<500 mg·L-1。與資料報道的氨基糖苷類藥物毒性作比較,發現在小鼠po和sc給藥急性毒性實驗中,妥布霉素毒性(LD50分別為10 500和441 mg·kg-1)相對西索米星毒性(LD50分別為5000和288 mg·kg-1)較小,而在線蟲體系中,妥布霉素的LC50(72 h)460 mg·L-1要大于西索米星的LC50(72 h)804 mg·L-1。表明某些藥物對線蟲的毒性相對較強,而對小鼠的毒性相對較弱,而對于具體的機制還有待進一步研究。但是總體上,線蟲評價的藥物毒性大小基本與小鼠相似(圖5)。
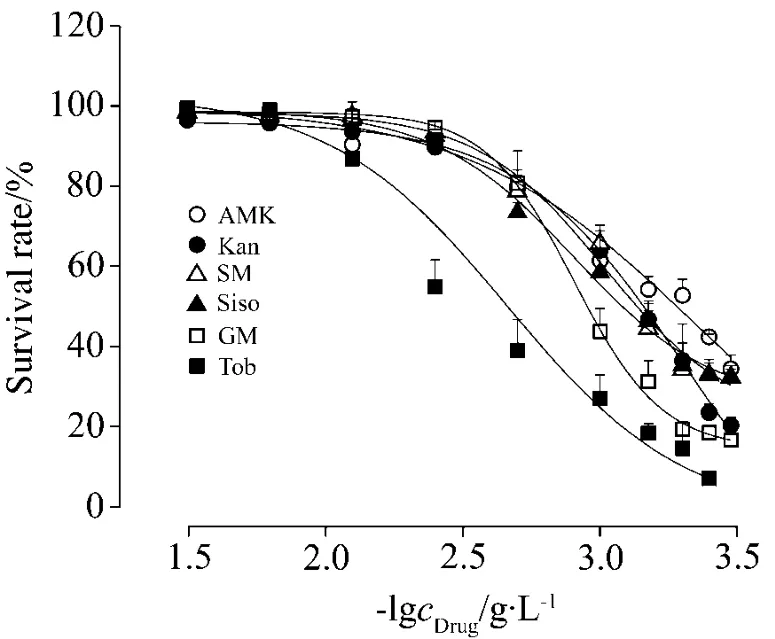
Fig.4 Effect of AMK,Kan,SM,Siso,GM and Tob on glp-4;sek-1 survival rate.Data was fitted with DoseResp.AMK:amikacin;Kan:kanamycin;SM:streptomycin;Siso:sisomicin sulfate;GM:gentamicin sulfate;Tob:tobramycin.
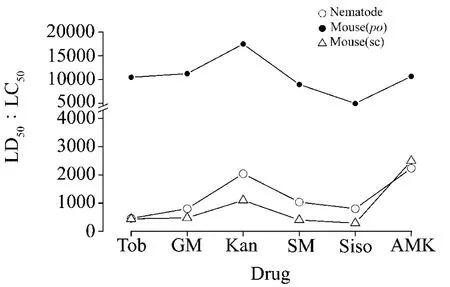
Fig.5 Trend curve of aminoglycoside antibiotic toxicity on mice and glp-4;sek-1.
2.5 青霉素類藥物的毒性
實驗考察青霉素、氨芐西林和苯唑西林在62.5 ~2000 mg·L-1濃度范圍內對線蟲的毒性。實驗采集了第5天的線蟲存活數據,發現當藥物濃度達到2000 mg·L-1時,所有染毒體系中線蟲的存活率仍在95%以上(圖6)。根據化合物毒性分級標準判定,3種藥物對線蟲幾乎沒有毒性,屬于低毒性化合物。
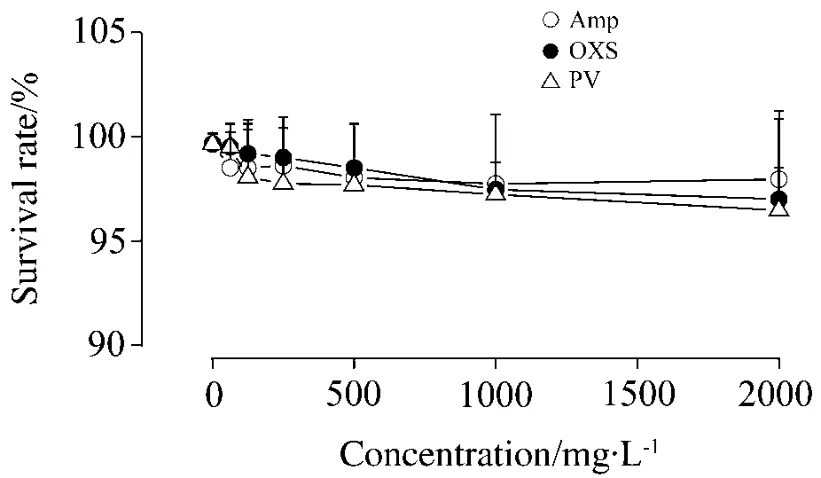
Fig.6 Effect of PV,Amp and OXSon glp-4;sek-1 survival rate.
2.6 抗腫瘤類藥物的毒性
考察3種抗腫瘤類藥物對線蟲毒性分別為:柔紅霉素 LC50(72 h)為 45.5 mg·L-1;多柔比星 LC50(72 h)為55.8 mg·L-1;絲裂霉素 C LC50(72 h)為43.8 mg·L-1。柔紅霉素、多柔比星和絲裂霉素 C對線蟲的毒性沒有顯著性差異(圖7)。與資料報道的小鼠評價體系相比,線蟲體系對這3種抗腫瘤藥物沒有很高的毒性區分度,并且絲裂霉素C對線蟲毒性和小鼠(LD50=23 mg·kg-1)相差不大。這3種抗腫瘤藥物的機制是抑制DNA生物合成,推測3種藥物對線蟲造成的毒性是一致的,因此,在線蟲評價體系中無法得到區分。
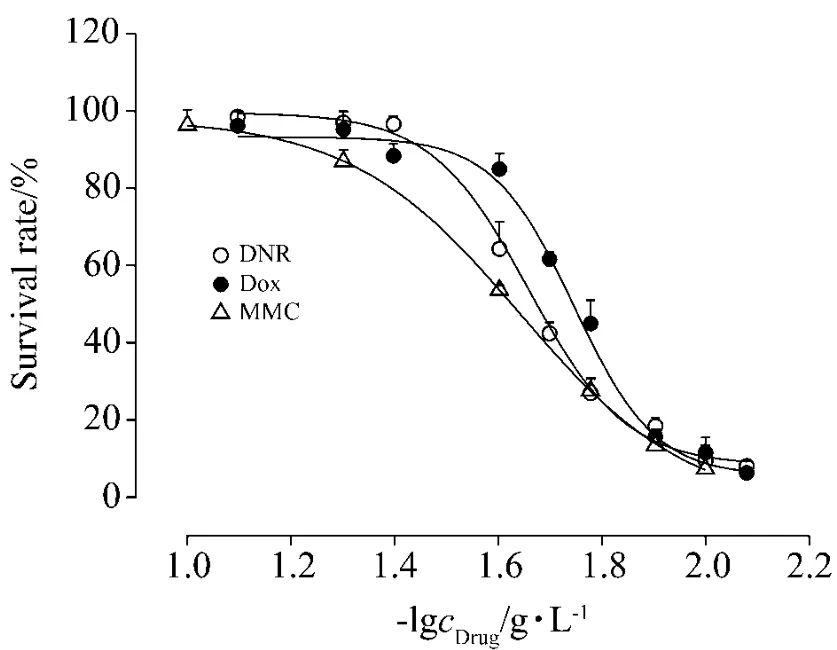
Fig.7 Effect of NDR,Dox and MMC on glp-4;sek-1 survival rate.Data was fitted with DoseResp.
3 討論
秀麗隱桿線蟲已被廣泛用于各類藥物篩選中,作為一個整體生物篩選模型對藥物的有效性進行評價。但是在對藥物進行有效性評價的同時,是否可以對其安全性進行初步評價。因此,本實驗采用線蟲在環境毒理學中研究的方法,對4大類抗生素和3種抗腫瘤藥物進行急性毒性評價,通過線蟲存活率,來反映藥物的急性毒性。大部分藥物在線蟲評價體系中呈現的毒性大小,與小鼠評價體系相類似。然而,線蟲作為黑箱式的評價系統,與哺乳動物相比存在一些不足之處,包括線蟲沒有心臟,呼吸系統,眼、耳和腎等器官,所以無法對藥物的具體毒性、損傷器官等進行評價,可能造成對某些藥物毒性相對敏感或相對不敏感的差異。鑒于線蟲與人類種間距離太遠,線蟲的作用仍處在藥物研發和評價初期,為化合物快速粗篩和毒性評價提供線索。
總之,秀麗隱桿線蟲是一個很好的藥物毒性檢測器,通過監測線蟲的死亡率來反映藥物急性毒性大小,對藥物的安全性進行初步評價。與小鼠評價模型相比,此評價系統操作簡單,監測方便,周期短,投入少,更適合化合物高通量篩選和毒性預評估。
[1]Petrascheck M,Ye X,Buck LB.A high-throughput screen for chemicals that increase the lifespan of Caenorhabditis elegans[J].Ann N Y Acad Sci,2009,1170:698-701.
[2]Moy TI, Conery AL, Larkins-Ford J, Wu G,Mazitschek R,Casadei G,et al.High-throughput screen for novel antimicrobials using a whole animal infection model[J].ACSChem Biol,2009,4(7):527-533.
[3]Okoli I,Coleman JJ,Tampakakis E,An WF,Holson E,Wagner F,et al.Identification of antifungal compounds active against Candida albicans using an improved highthroughput Caenorhabditis elegans assay[J].PLoS One,2009,4(9):e7025.
[4]Pukkila-Worley R,Holson E,Wagner F,Mylonakis E.Antifungal drug discovery through the study of invertebrate model hosts[J].Curr Med Chem,2009,16(13):1588-1595.
[5]Breger J,Fuchs BB,Aperis G,Moy TI,Ausubel FM,Mylonakis E.Antifungal chemical compounds identified using a C.elegans pathogenicity assay[J].PLoS Pathog,2007,3(2):e18.
[6]Moy TI,Ball AR,Anklesaria Z,Casadei G,Lewis K,Ausubel FM.Identification of novel antimicrobials using a live-animal infection model[J].Proc Natl Acad Sci USA,2006,103(27):10414-10419.
[7]Kwok TC,Ricker N,Fraser R,Chan AW,Burns A,Stanley EF,et al.A small-molecule screen in C.elegans yields a new calcium channel antagonist[J].Nature,2006,441(7089):91-95.
[8]Williams PL,Dusenbery DB.Aquatic toxicity testingusing the nematode,Caenorhabditis elegans[J].Environ Toxicol Chem,1990,9(10):1285-1290.
[9]Donkin SG,Eiteman MA,Williams PL.Toxicity of glucosinolates and their enzymatic decomposition products to Caenorhabditis elegans[J].J Nematol,1995,27(3):258-262.
[10]Tatara CP,Newman MC,McCloskey JT,Williams PL.Predicting relative metal toxicity with ion characteristics:Caenorhabditis elegans LC50[J]. Aquatic Toxicol,1997,39(3-4):279-290.
[11]Anderson GL,Boyd WA,Williams PL.Assessment of sublethal endpoints for toxicity testing with the nematode Caenorhabditis elegans[J].Environ Toxicol Chem,2001,20(4):833-838.
[12]Brenner S.The genetics of Caenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[13]Lewis JA, Fleming JT. Basic culture methods[J].Methods Cell Biol,1995,48:3-29.
[14]Stiernagle T.Maintenance of C.elegans[J].Worm-Book,2006:1-11.
[15]Tomlin M,Basarab A,Warnock D.In process citation[J].Clin Drug Invest,1997,13(2):118-120.
[16]Gol'dberg LE,Filippos'iants ST,Shepelevtseva NG,Vertogradova TP.Toxicity,pharmacokinetics and pharmacodynamics of Soviet-made doxorubicin[J].Antibiotiki,1983,28(4):298-303.

