豆漿中脲酶活性測定方法的建立及酶學性質的研究
曹 慧,徐 斐
(上海理工大學醫療器械與食品學院,上海200093)
豆漿中脲酶活性測定方法的建立及酶學性質的研究
曹 慧,徐 斐
(上海理工大學醫療器械與食品學院,上海200093)
生豆漿中的胰蛋白酶抑制因子在實驗室中較難檢測,但其活性與脲酶活性呈正相關。對此建立了豆漿中脲酶的定量檢測方法,并對其酶學性質進行研究。結果表明,采用納氏試劑測定豆漿脲酶活性的最適條件為:波長415nm,顯色劑用量1mL,尿素濃度3%,反應溫度35℃,反應時間7min。豆漿中脲酶的最佳作用pH為7.0,最適反應溫度為35℃,脲酶在25~40℃之間貯存3h有較好的熱穩定性,酶活保留率在80%以上。利用Lineweaver-Burk雙倒數作圖法求得脲酶的Vmax為0.173mmol/min,Km為0.0172mol/L。
豆漿,脲酶活性,納氏試劑法,酶學性質
豆漿因其富含植物性蛋白質、礦物質、維生素等營養元素,素有“植物肉”、“綠色牛乳”之美譽。但生豆漿中含有多種阻礙營養物質利用的抗營養因子,如蛋白酶抑制因子、植物凝集素、胃腸脹氣因子等[1]。尤其是胰蛋白酶抑制因子能抑制胃蛋白酶、胰蛋白酶等幾十種蛋白酶的活性,導致蛋白消化和利用率降低,引起胰腺增生、腫大。胰蛋白酶抑制因子在實驗室中較難檢測,但其變性失活程度與脲酶相似,因此我們常以脲酶活性作為判斷豆漿生熟度的標準[2]。脲酶(urease),又稱尿素酶或酰胺水解酶,能特異性地催化尿素水解,產生二氧化碳和氨,其催化反應速度是常規化學催化的104倍,常被用于尿素或重金屬的快速檢測[3-4]。目前脲酶的測定方法主要有氨氣敏電極法定量法、pH增值法、國標納氏試劑法等。利用氨氣敏電極測定單位時間內由脲酶作用所產生的氨數量可定量表示大豆脲酶活性的高低,此法操作較簡單,但測定過程中氨容易逃逸,導致實驗結果存在較大誤差[5]。尿素被樣品中的脲酶催化分解產生氨,導致溶液pH增加,增加的程度與脲酶活性大小呈正相關,因此可以用其與空白溶液的差值表示脲酶活性高低。pH增值法操作簡單、試劑少,但是計算結果不易比較,不夠直觀[6]。國標法是利用脲酶水解產生的氨,在適當條件下能與納氏試劑中的碘化鉀汞復鹽作用生成棕色的碘化雙汞銨。國標法靈敏度較高,但只能定性檢測,且過程復雜,耗時也較長[7]。因此,本實驗擬建立一種脲酶的定量檢測方法,并對大豆脲酶的酶學性質進行初步研究。
1 材料與方法
1.1 材料與儀器
碘化汞、碘化鉀、(NH4)2SO4、尿素、磷酸氫二鈉、磷酸二氫鉀、三氯乙酸等試劑 購自國藥集團,均為分析純。
722S型分光光度計 上海分析儀器廠;SZ-93自動雙重純水蒸餾器 北京東南儀誠實驗室設備有限公司;HY-6多用振蕩器 金壇市醫療器械廠;J2-HS型臺式高速離心機 美國貝克曼公司;SHZ-88臺式水浴恒溫振蕩器 上海醫療器械七廠;九陽料理機 杭州九陽小家電有限公司。
1.2 實驗方法
1.2.1 溶液的配制
1.2.1.1 納氏試劑的配制 稱取5.5g碘化汞、4.125g碘化鉀溶于25mL水中,溶解后轉移到100mL容量瓶中。再稱取14.4g氫氧化鈉溶于50mL水中,待溶解冷卻后,慢慢轉移到上述100mL容量瓶中,用水定容至刻度,搖勻后倒入試劑瓶中,靜止后取上層清液。
1.2.1.2 硫酸銨標準應用液的配制 精確稱取硫酸銨0.9910g(60℃干燥至恒重)加蒸餾水溶解后定容至1000mL容量瓶中,此溶液為1mL≈15μmol的NH4+的貯存液。精確吸取10mL貯存液,置于100mL容量瓶中,加蒸餾水至刻度,此溶液為1mL≈1.5μmol的NH4+。
1.2.2 標準曲線的建立 準確吸取硫酸銨標準溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0mL(對應NH4+濃度為0.0、0.75、1.5、2.25、3.0、3.75、4.5μmol)分別置于7支25mL具塞比色管中,加水至9mL,各加納氏試劑1mL。于415nm波長處測定其吸光值。根據測得的吸光值繪制標準曲線。
1.2.3 豆漿脲酶活性檢測方法的確定 取30g大豆,置于250mL蒸餾水中浸泡4h,用料理機打碎,取1mL定容至50mL容量瓶中。取1mL豆漿稀釋液,加入1mL尿素溶液(濃度分別為0.5%、1%、3%、5%、7%),恒溫水浴反應(反應時間分別為3、5、7、9、11、13min;反應溫度分別為25、30、35、40、45℃),反應完畢后加入1mL 10%三氯乙酸溶液,振蕩均勻。3000r/min離心5min,取上清液0.5mL置于納氏試管中,各加8.5mL蒸餾水及1mL納氏試劑,于415nm處測定吸光值。豆漿中脲酶酶活定義為:在35℃時,每分鐘催化產生1μmol氨的酶量為1個酶活力單位,計算公式為:
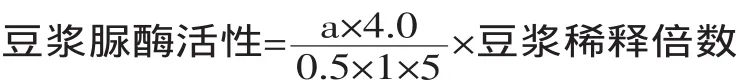
式中:a:經標準曲線所查得的樣品管中的NH4+的微摩爾數。
1.2.4 脲酶酶學性質的研究 將生大豆粉碎,經過35%乙醇浸提、多步分離純化、最后利用真空冷凍干燥制得大豆脲酶,并對其酶學性質進行研究。
1.2.4.1 溫度穩定性 分別在25、30、35、40、45、50、55℃下將脲酶酶液保溫3h,檢測其在不同溫度下保溫后的酶的活力變化情況。
1.2.4.2 脲酶的最適反應pH 分別在pH5、6、7、8和9下測定脲酶的活力。
1.2.4.3 米氏常數Km及最大反應速度Vmax的測定 在不同濃度尿素下測定反應的初速度,然后按Lineweaver-Burk雙倒數作圖法求得酶反應的米氏常數,再由縱軸截距求出酶反應的最大反應速度Vm。
2 結果與分析
2.1 標準曲線的建立
2.1.1 檢測波長的選擇 吸取1mL硫酸銨標準溶液,按1.2.2方法顯色,以空白為參比在400~700nm波長范圍內進行掃描。結果表明,待測樣品反應液在415nm有最大吸收峰,故選擇415nm為檢測波長。
2.1.2 顯色劑用量的確定 脲酶水解尿素產生的氨,在適當條件下能與納氏試劑中的碘化鉀汞復鹽作用生成棕色的碘化雙汞銨。因此,在415nm波長下考察不同顯色劑用量對吸光值的影響。由圖1可見,隨著顯色劑用量的增加,吸光值呈直線上升趨勢,當顯色劑用量增加到1mL時,吸光值呈微弱下降的趨勢。因此,選擇顯色劑1mL為最適用量。
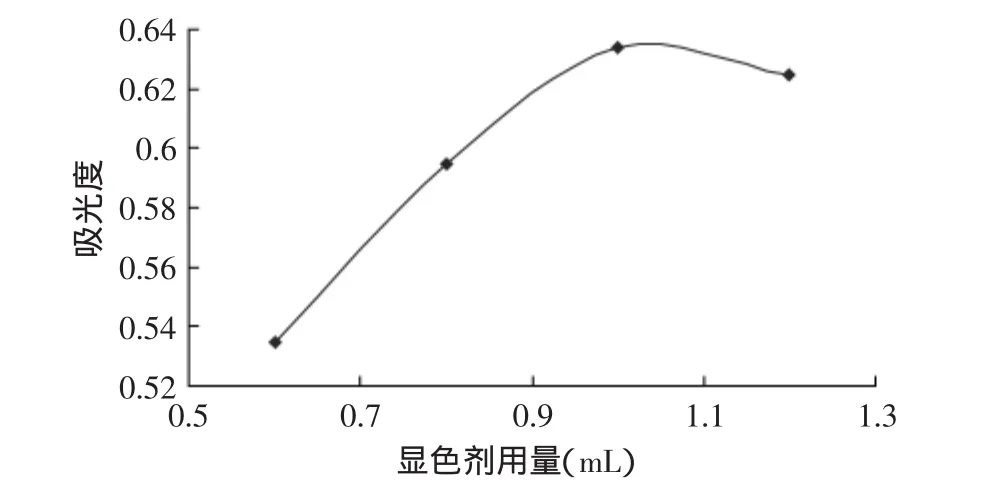
圖1 納氏試劑用量對吸光值的影響Fig.1 Effect of nessler reagents amount on the color development
2.1.3 硫酸銨的標準曲線 在415nm波長、1mL顯色劑用量下,以不同濃度的NH4+為橫坐標,吸光值為縱坐標建立標準曲線。由圖2可見,標準方程為y=0.2234x+ 0.0436,R2=0.9937,當NH4+的微摩爾數在0.75~4.5時呈良好的線性關系。

圖2 硫酸銨標準曲線Fig.2 The standard curve of ammonium sulfate
2.2 豆漿脲酶活性檢測條件的確定
2.2.1 尿素濃度的確定 脲酶能專一性地分解尿素產生氨,因此以尿素為底物,考察不同尿素濃度對脲酶酶活的影響,結果如圖3所示。由圖3可見,隨著尿素濃度的增加,酶活呈增加趨勢,當尿素濃度增加到3%時,酶活呈現平穩狀態,這可能是由于底物已達到飽和。因此,選擇3%的尿素作為最適底物濃度。2.2.2 反應溫度的確定 反應溫度對酶活的測定有顯著影響,因此考察了不同反應溫度對脲酶酶活的影響。由圖4可見,隨著反應溫度的升高,脲酶酶活呈增加趨勢,當反應溫度達到35℃時,酶活逐漸下降。因此,選擇35℃作為最適的反應溫度。
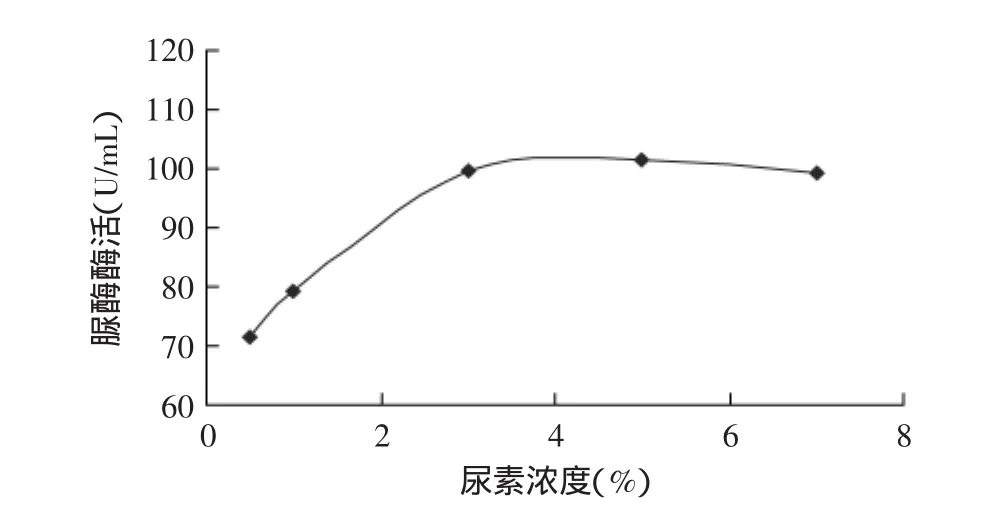
圖3 尿素濃度對脲酶酶活的影響Fig.3 Effect of urea amount on urease activity
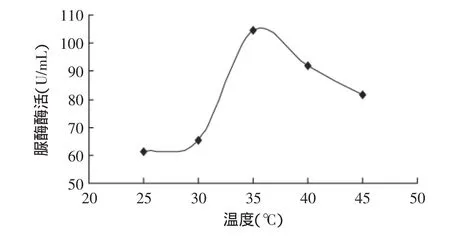
圖4 反應溫度對脲酶酶活的影響Fig.4 Effect of reaction temperature on urease activity
2.2.3 反應時間的確定 反應時間對酶活的影響如圖5所示。由圖5可見,隨著反應時間的延長,脲酶酶活呈上升趨勢,當反應時間達到9min時,酶活趨于平穩。因此,根據酶初速度的定義,選擇7min作為最適的反應時間。
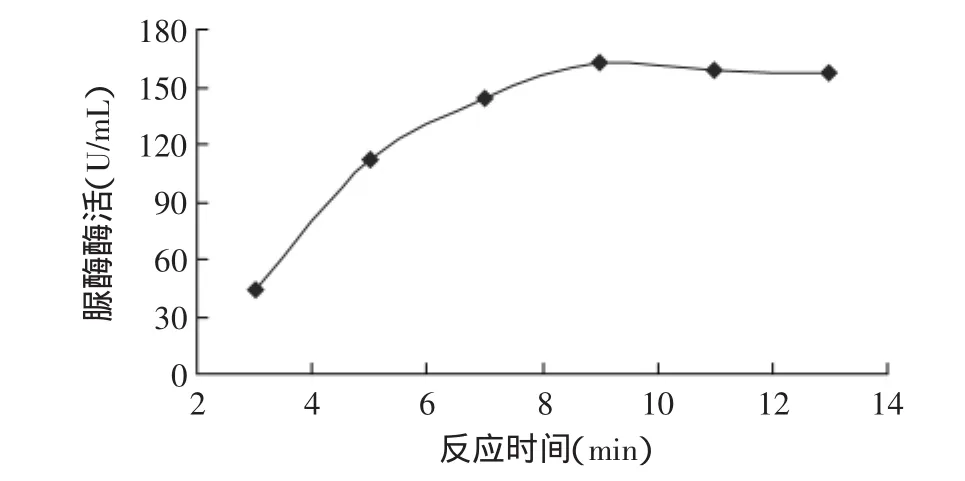
圖5 反應時間對脲酶酶活的影響Fig.5 Effect of reaction times on urease activity
2.3 脲酶酶學性質的研究
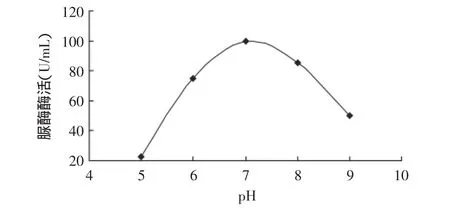
圖6 脲酶反應的最適pHFig.6 Optimal pH of urease
2.3.1 酶反應的最適pH 脲酶最適反應pH如圖6所示。由圖6可見,隨著pH的上升,脲酶的活力逐漸增加,當pH達到7.0時,酶活力最大,隨后又逐漸下降。因此,脲酶的最適pH在7.0左右。
2.3.2 酶反應溫度穩定性 脲酶最適反應溫度如圖7所示。由圖7可見,脲酶在25~40℃之間有較好的熱穩定性,保存3h酶活保留率都在80%以上。當酶液在50℃時,酶活保留率仍在50%左右。
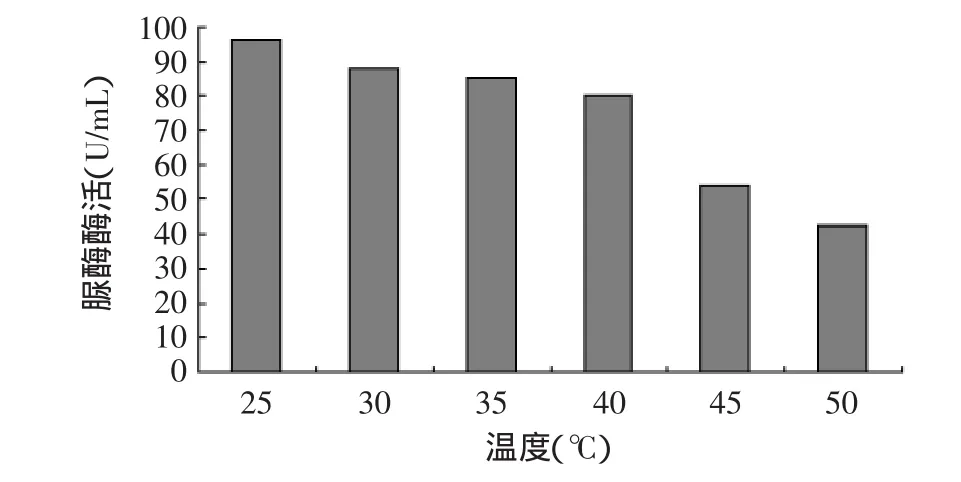
圖7 脲酶的溫度穩定性Fig.7 Thermal stability of urease
2.3.3 米氏常數Km和最大反應速度Vmax的測定 在pH7.0,反應溫度35℃的條件下,以尿素為底物,測定不同底物濃度下反應的初速度,按Lineweaver-Burk作圖法取雙倒數作1/v-1/[s]曲線(見圖8),計算Vmax= 0.173mmol/min,米氏常數Km為0.0172mol/L。
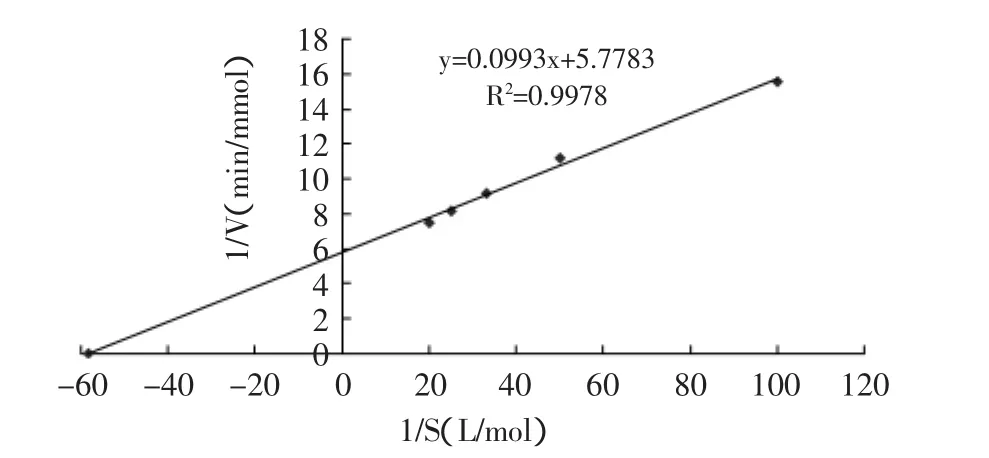
圖8 1/v-1[s]曲線Fig.8 1/v-1/[s]curve
3 結論
本文建立了大豆脲酶的定量測定方法,并對其酶學性質進行了初步研究。研究結果表明,納氏試劑測定脲酶的最佳吸收波長為415nm,顯色劑用量為1mL,當NH4+的微摩爾數在0.75~4.5μmol時呈良好的線性關系。脲酶酶活測定最佳反應條件為:尿素濃度3%,反應溫度35℃,反應時間7min。脲酶活力隨著pH的增加而增大,pH為7時,脲酶活力最高。脲酶反應的最適溫度為35℃,脲酶在25~40℃之間有較好的熱穩定性。利用Lineweaver-Burk雙倒數作圖法求得酶的Vmax=0.173mmol/min,Km為0.0172mol/L。通過對大豆脲酶活性的測定以及酶學性質的研究,為采用此酶快速測定尿素及重金屬的殘留奠定了理論基礎。
[1]吳非,霍貴成.酶法鈍化大豆胰蛋白酶抑制劑研究[J].糧食與油脂,2002(6):9-10.
[2]Kunitz M.Cristallization of a trypsin inhibitor from soybean [J].Science,1985,101:668-691.
[3]Katsuro M, Motoo S.Purification characterization and application of an acid urease from Arthobacter mobilis[J].Journal of Biotechnology,1999,68:227-236.
[4]陳秀云,李湘鳴.豆漿中脲酶活性的測定[J].江蘇預防醫學,2002(3):63-64.
[5]徐茂軍,樂培恩,鄭凱.氨氣敏電極法定量測定大豆脲酶活性[J].食品科學,1993(9):64-68.
[6]楊奇慧,舒璐,鐘劍鋒.不同方法測定大豆脲酶活性的比較研究[J].飼料廣角,2008,21:30-32.
[7]QB/T 2132-2008植物蛋白飲料豆奶(豆漿)和豆奶飲料[S].附錄A脲酶的定性測定.
Establishment of determination method of urease in soybean juice and the enzymology characteristics
CAO Hui,XU Fei
(Medical Equipment and Food Institute,University of Shanghai for Science and Technology,Shanghai 200093,China)
The determination of trypsin inhibitor in the laboratory was very difficult,but the activity of urease was positively correlated with trypsin inhibitor concentration.Therefore,we established the measuring method for urease activity,and then the enzymology characteristics were studied.Results showed that the optimal values for urease activity as follows:detection wavelength 415nm,amount of nessler reagents 1mL,urea concentration 3%,reaction temperature 35℃,reaction time 7min.Meanwhile,the optimum reaction pH and temperature of soybean urease was 7.0 and 35℃,respectively.Incubation at 25~40℃for 3h,the retention rate of enzyme activity was above 80%.The Kmand Vmaxof urease were 0.173mmol/min and 0.0172mol/L,respectively.
soybean milk;urease;nessler’s method;enzymology characteristics
TS201.2+5
A
1002-0306(2012)01-0106-04
2010-09-06
曹慧(1976-),女,講師,博士,研究方向:功能性配料及添加劑。
上海高校選拔培養優秀青年教師科研專項基金(Slg08030)。

