骨髓間充質干細胞性狀穩定性與生物安全性研究
河北省秦皇島市第一醫院神經外科二病區 (秦皇島066000)
吳 磊 趙建華 馮 繼
骨髓間充質干細胞(Bone marrow-derived mesenchymal stem cells,BMSCs)具有向神經細胞、肌細胞、骨和軟骨細胞等多種組織分化的潛能[1],被多個學科爭先進行研究,但到目前為止,仍有很多領域存在尚未解決的問題,嚴重限制了其廣泛的臨床應用。作為干細胞,其自我更新和不斷增殖潛能使其有可能存在類似于腫瘤細胞的增殖特征,特別是長期體外培養的干細胞可能發生異質性問題,這一問題已被少數研究機構報道[2,3],但結論不一而足。本研究以此為著眼點予以研究。
材料和方法
1 材 料 實驗使用的DMEM培養基和胰蛋白酶均由美國Gibco公司生產,而胎牛血清為中科院血研所生產,FITC標記CD29、CD34抗體購自英國Serotec公司,CD31、CD45、CD71、CD90抗體購自美國Santa Cr uz公司,低熔點瓊脂糖、臺盼蘭購自北京鼎國公司;鼠源性C6惡性膠質瘤細胞系由天津市神經病學研究所神經腫瘤實驗室提供;清潔級Sprague-Dawley大鼠購自中國軍事醫學科學院動物中心。
2 大鼠源性BMSCs的分離及常規培養 用貼壁培養法分離BMSCs.即將Sprague-Dawley大鼠通過拉頸手法將其處死,然后使用75%酒精浸泡充分消毒;將Sprague-Dawley大鼠的雙側股骨和脛骨仔細分離,并剪開其長骨兩端的骨皮質,將含10%FBS的DMEM培養基抽取到注射器中,通過注射器將培養基反復沖洗該鼠的骨髓腔,收取實驗所需的細胞懸液,將其接種到塑料培養皿或者培養瓶中,在37℃、5%CO2飽和濕度條件下使用細胞培養箱對其進行培養。等到部分細胞貼壁后對其進行半量換液,第3d實行全量換液,第2代起每3~5d胰酶消化傳代,獲取長期傳代培養細胞。
3 流式細胞儀檢測不同傳代次數BMSCs表面標志蛋白表達 取第4、20和40代BMSCs單細胞懸液,通過FITC標記的CD29、CD31、CD34、CD45、CD71、CD90抗體在室溫下避光染色30 min,使用FACSCalibur流式細胞儀和CELLQuest軟件(Bect on Dickinson,USA)進行采樣分析。
4 流式細胞儀檢測長期體外培養BMSCs細胞周期及DNA倍性變化 取第4、20和40代BMSCs,使用PBS進行離心漂洗,共進行3次,然后使用無水乙醇進行固定,RNase A消化和PI染色30 min,最好上流式細胞儀進行分析檢測。
5 血清依賴實驗 取生長狀態良好的第4、20、40代BMSCs和C6膠質瘤細胞分別接種于96孔板,24h后將條件培養液換為含0.1%FBS的DMEM條件培養液繼續培養;每日取96孔板培養皿中的8個孔細胞進行苔盼蘭染色,使用顯微鏡對活細胞進行計數取平均值,計算活細胞占所有細胞的百分率;用C6膠質瘤的細胞作為陽性對照研究。
6 細胞克隆形成能力比較 在培養皿孔底預鋪置0.7%瓊脂,在常規培養箱中過夜凝固;用終濃度為0.35%低熔點瓊脂糖工作液與第40代BMSCs和C6膠質瘤細胞懸液混勻,加入培養皿孔板中,置于細胞培養箱;第二日向每孔中各加入200μL的全培養基,等培養3個星期后,在倒置顯微鏡下隨機抽取培養基的10個視野進行計數,計數細胞數大于40的克隆團數需要計算平均值。
7 大鼠顱內致瘤試驗 取第40代BMSCs進行胰酶消化,調節細胞終濃度為1×106個細胞/25μl備用;大鼠顱內立體定向注射BMSCs:在對大鼠腹腔進行麻醉注射時,需要根據其體重采取有針對性的用量,按3.5 ml/kg的標準使用10%水和氯醛注射;待對大鼠頭部皮毛進行常規消毒后,使用手術刀切開其頭皮,使其顱骨充分暴露出來,通過立體定向注射儀對其進行準確定位,定位點控制在其前囟右旁開3.5 mm,同時向前1 mm,使用牙科鉆對其進行鉆孔后緩慢進針,將進入深度控制為5 mm,注射持續時間為5~10 min,最后停針3 min后緩慢退針。MRI監測顱內成瘤情況,仔細觀察該老鼠的生存狀態,等到大鼠存活到第28d將其處死,然后取下其腦切片進行HE染色。本實驗以鼠源性C6膠質瘤細胞系為陽性對照。
8 統計學方法 選用方差分析、χ2檢驗。
結 果
1 大鼠BMSCs傳代培養特征 原代貼壁細胞成分復雜,隨著傳代次數增加,異種細胞逐漸被淘汰,于第4、5代可獲得形態均一、增長旺盛的純化BMSCs;這些BMSCs可穩定培養至20代左右,以后逐漸表現出傳代間隔縮短,細胞增殖速度增快現象,形態學觀察細胞排列稍有紊亂,折光性有所增強(圖1)。

圖1 第4、20及40代BMSCs形態學觀察,可見第40代細胞排列稍有紊亂,折光性有所增強(×200)
2 不同傳代次數BMSCs表面標志蛋白表達 流式細胞儀檢測結果顯示第4、20和40代BMSCs的多個表面標志蛋白(陽性標志蛋白:CD29、CD71、CD90,陰性標志蛋白:CD31、CD34、CD45)的表達不隨傳代次數增加而發生改變,不同傳代次數BMSCs的同一檢測指標相互比較無統計學差異(P>0.05)(圖2)。
3 不同代數的BMSCs細胞周期的改變 見圖3。處于合成期(S期)的細胞比例在體外培養時BMSCs會隨著傳代次數增加而逐漸增加。不同傳代次數的BMSCs間DNA倍性無明顯改變。較周圍腦組織稍有深染。與BMSCs接種動物相比較,C6膠質瘤細胞接種動物經MRI檢測在第14d可見接種腦半球巨大腫瘤形成,腫瘤幾乎占據整個半球。以上結果顯示移植于腦內的BMSCs在體內可存活較長時間,但尚無惡性轉化表現(圖6)。

圖2 第4、20及40代BMSCs表面標志蛋白表達情況比較,可見3個陽性標志蛋白cd29、cd71、cd90表達率均大于98%,而3個陰性標志蛋白cd31、cd34、cd45表達率均小于5%,而不同傳代次數BMSCs的同一標志蛋白表達相互間無統計學差異(P>0.05)
討 論
BMSCs在動物骨髓中廣泛存在,是一種具備可以自我更新和多分化潛能的前體細胞,即便在機體組織細胞受到損傷后,其修復過程也可以發揮重要作用[4]。因其在體外容易獲得和擴增,相較于胚胎干細胞、臍血干細胞或神經干細胞,倫理學限制較少,易于實驗室工作的大范圍展開。近年來圍繞BMSCs的組織損傷反應性及其多胚層分化潛能,多學科的相關性研究相繼展開,

圖3 第4、20及40代BMSCs細胞周期變化,可見體外培養BMSCs處于S期的細胞比例隨著傳代次數增加而增加(P<0.05),而G2/G0+G1值比較無統計學差異(P>0.05),提示不同傳代次數的BMSCs間尚無明顯倍體改變
4 低營養條件下細胞生長情況比較 圖4顯示為在低血清培養條件下所有代次的BMSCs均在4d內死亡,表明BMSCs的生長對血清有高度依賴性;但在同樣低血清培養條件下,C6膠質瘤細胞一直存活到第11d,表現出更強的低營養耐受能力。
5 細胞克隆形成能力比較結果 該實驗結果顯示,接種的C6膠質瘤細胞系在第21d時出現了大量的克隆,二者相比較可以看出,所有BMSCs實驗組幾乎均未形成克隆(圖5)。

圖4 通過血清依賴實驗可以看出,在低血清的培養條件下,所有傳代次數的BMSCs在4d內全部死亡,但是C6膠質瘤細胞卻不同,在同樣條件下,該細胞可以一直存活11d,體現出了更強的生長活性,具有更好的低營養抵抗能力
6 體內致瘤性的結果比較 BMSCs接種的大鼠生存狀況均非常良好,MRI及腦組織標本中未見腫瘤形成。圖6 A顯示為BMSCs移植部位腦組織結構HE染色,6B為非BMSCs移植區域腦組織HE染色,在鼠腦切片的BMSCs移植層面可見較多BMSCs不均一地分散于正常腦組織結構中,細胞排列無序,胞漿如心肌梗死組織的替代、骨或肌腱組織的再生、神經退行性疾病的功能恢復等[5]。由于這些領域幾乎均需要體外擴增出足夠的細胞數量以用于BMSCs移植或基因修飾,因此一個不可回避的問題是這些長期體外擴增培養的BMSCs的性狀穩定性與應用安全性問題。
目前已有研究報道,BMSCs經過長期體外的擴增培養后,可以失去其原始的生物學特征,如特異表面標志蛋白的改變,誘導遷移相關蛋白的表達下降或丟失等,這些蛋白表達的改變將影響其特有的損傷反應性和定向遷移能力,進而影響組織再生和修復效率。Abdallah等用端粒酶逆轉錄酶(h TERT)轉染BMSCs,經過3年體外培養,觀察到所有體外培養細胞株不僅都具有良好的自我復制,還具有多胚層分化潛能。Burns等研究表明,BMSCs經過繼續的體外培養后可以發生明顯的基因改變且是自發的,還可以引起其免疫缺陷腫瘤的形成。在110個BMSCs單細胞克隆中,僅有6株出現了INK4a/ARF基因位點的缺失和DBCCR1抑癌基因啟動子的高甲基化,使得其基因表現沉默,只會出現在人類腫瘤和骨肉瘤源性細胞株中。
研究還發現,實驗對長期體外培養的大鼠源性BMSCs性狀穩定性與應用安全性予以研究。首先雖然在細胞形態上BMSCs經長期培養后出現了不同程度的排列紊亂,折光性明顯增強,生長周期明顯縮短,但DNA倍性并未出現明顯改變,所檢測的6個表面標志蛋白表達也沒有明顯差別,提示體外傳代培養40代的BMSCs尚具備良好的生物學性狀穩定性。血清依賴實驗主要在于惡性程度較高的細胞系,它不僅可以分泌生長因子,在低營養條件下具有比較低惡度的細胞系或正常細胞系更強的耐受能力,體現出來了更強的增殖活性,還可以作為評價細胞系惡性程度的重要指標。本次研究選用的惡性程度較高的C6膠質瘤細胞系作為了對照,C6膠質瘤細胞系表現出了更強的低營養耐受能力,在低營養條件下,BMSCs無論是早期還是長期培養都較早地出現了生長停滯現象,直到細胞死亡。軟瓊脂細胞克隆形成實驗是一種常用實驗方法,在模擬活體內,細胞外基質的半固體生長環境下,進行體外檢測評估,分析細胞純系化集落生長潛力。集落主要指在體外培養基中從一個細胞逐漸增殖而形成的細胞團。腫瘤細胞和類腫瘤細胞的無限繁殖,使得成熟分化細胞不能及時形成集落。本次實驗表明BMSCs在長期體外培養下阻力介質中仍然不具備形成克隆的能力,存在極低的惡性度和致瘤潛能。而本實驗體內研究結果也表明長期體外培養(至少40代)的BMSCs體內移植后尚不存在致瘤性,具備良好的應用安全性。總之,長期體外培養的BMSCs具有相對穩定的生物學性狀和應用安全性,適宜于大數量BMSCs移植或體外基因修飾為基礎的研究展開。
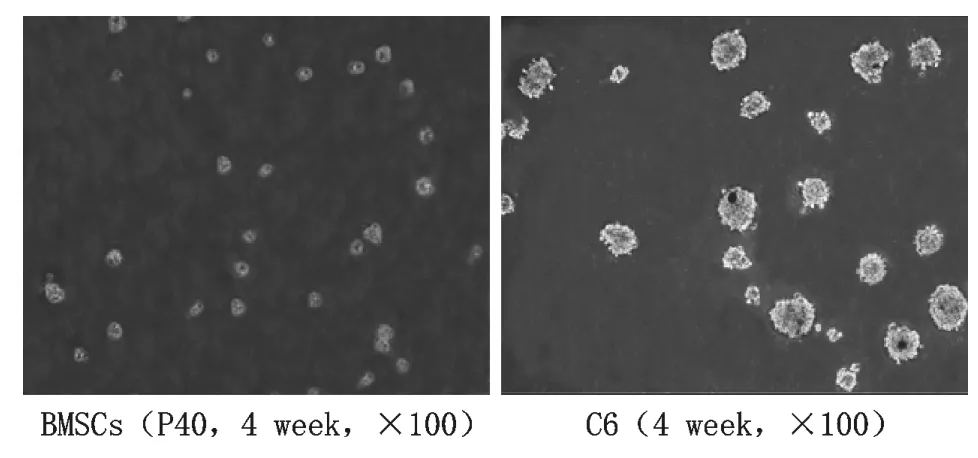
圖5 長期體外培養的第40代BMSCs和C6膠質瘤細胞在軟瓊脂中克隆形成能力比較

圖6 A為BMSCs移植部位腦組織結構HE染色,B為非BMSCs移植區域腦組織HE染色,在A可見較多BMSCs不均一地分散于正常腦組織結構中,細胞排列無序,胞漿較周圍腦組織稍有深染(A、B,×200)
[1]Baksh D,Song L,Tuan RS.Adult mesenchy mal stem cells:characterization,differentiation,and application in cell and gene therapy.J Cell Mol Med,2004,8(3):301-316.
[2]Tuan RS,Boland G,Tuli R,etal.Adult mesenchy mal ste m cells and cell-based tissue engineering.Arthritis Res Ther,2003,28(5):32-45.
[3]Colter DC,Class R,Di-Girola mo CM,etal.Rapid expansion of recycling ste m cells in cultures of plastic-adherent cells fro m hu man bone marrow.Proc Natl Acad Sci USA,2000,97(7):3213-3218.
[4]賴平平,韓春茂,岑航輝,等.骨髓間充質干細胞的分離培養和生物學性狀[J].浙江醫學,2004,26(5),328-329.
[5]杜振宗,任 華,張超紀.成人骨髓間充質干細胞的分離、鑒定和生物學特性[J].中國組織工程研究與臨床康復,2008,38(43):8495-8499.

