鴨瘟活疫苗外源病毒檢驗方法(雞檢查法)的修訂
李啟紅,李俊平,楊承槐,黃建華,蔣桃珍,李慧姣
(中國獸醫藥品監察所,北京 100081)
為了保證疫苗純凈、安全、有效,活疫苗應進行外源病毒檢驗。《中華人民共和國獸藥典》(簡稱《獸藥典》)二〇〇五年版中規定的禽源制品外源病毒檢驗方法有雞胚檢查法、細胞檢查法和雞檢查法。通常情況下,采用雞胚檢查法和細胞檢查法進行,如果檢驗無結果或結果可疑時,用雞檢查法進行檢驗[1]。雞胚檢查法和細胞檢查法均采用高效價的抗血清中和本病毒后接種雞胚、細胞,觀察是否有外源病毒引起的病變。采用雞檢查法進行外源病毒檢驗時不需要中和疫苗病毒,但需要接種疫苗的劑量大,即每只雞需接種2次,每次經滴鼻、點眼和肌肉注射共接種120羽份。
目前,國內使用的鴨瘟活疫苗系用雞胚化的鴨瘟病毒接種SPF雞胚或雞胚成纖維細胞,收獲感染的雞胚液、胎兒及絨毛尿囊膜并混合研磨或收獲病毒培養液,加適宜穩定劑,經冷凍真空干燥制成。在實際檢驗工作中,因抗鴨瘟病毒血清中和效價不高,不能中和《獸藥典》規定的羽份數,所以無法通過雞胚檢查法和細胞檢查法進行外源病毒檢驗。選用雞檢查法對鴨瘟活疫苗進行外源病毒檢驗時,按《獸藥典》使用1、4月齡的SPF雞接種疫苗后,大部分雞在1周內死亡,無法繼續檢驗。所以,有必要對目前鴨瘟活疫苗的外源病毒檢驗的雞檢查法進一步修訂,以便更好地控制疫苗質量。本實驗室對實驗用SPF雞的周齡和基礎免疫程序進行了研究。
1 材料與方法
1.1 實驗動物 SPF雞,購自北京梅里亞維通實驗動物中心。
1.2 鴨瘟種毒 從中國獸醫藥品監察所菌種保藏中心領取種毒,經SPF雞胚繁殖,制備的濕毒病毒含量為 107.4ELD50/0.2 mL。
1.3 鴨瘟活疫苗 來自3個企業5批次。
1.4 抗體檢測ELISA試劑盒 雞傳染性支氣管炎病毒(IBV)、傳染性法氏囊病病毒(IBDV)、禽呼腸孤病毒(REOV)、雞網狀內皮增生癥病毒(REV)、J亞型禽白血病病毒(ALV-J)、禽腦脊髓炎病毒(AEV)抗體檢測試劑盒,均購自IDEXX公司。
1.5 血凝(HA)抗原 新城疫病毒(NDV)、減蛋綜合征病毒(EDS)HA抗原,由中國獸醫藥品監察所制備供應;H5亞型和H9亞型禽流感病毒(AIV)HA抗原,由國家禽流感參考實驗室制備供應。
1.6 方法
1.6.1 建立檢驗方法 SPF雞只周齡、基礎免疫的時間和接種劑量的試驗方案見表1。購進4周齡SPF雞后,隔離器分組飼養,飼養至4、7、9周齡后進行試驗。先用小劑量的鴨瘟種毒進行基礎免疫,14 d后再按照《獸藥典》(二〇〇五年版)附錄20頁“雞檢查法”進行免疫及抗體檢測。
1.6.2 驗證檢驗方法 按照1.6.1建立的方法,選取5批疫苗樣品進行外源病毒檢驗,對所建立方法進行驗證。
2 結果
2.1 檢驗方法的建立 結果見表1。選用4周齡SPF雞進行鴨瘟活疫苗的外源病毒檢驗時,首次接種 103.0、104.0、105.0ELD50的鴨瘟種毒均引起免疫雞100%發病,50%以上死亡。7周齡 SPF雞接種103.0ELD50以上的鴨瘟病毒引起25%以上發病,20% 以上死亡。9 周齡 SPF 雞免疫 102.0、103.0的鴨瘟種毒均未引起臨床癥狀和死亡。
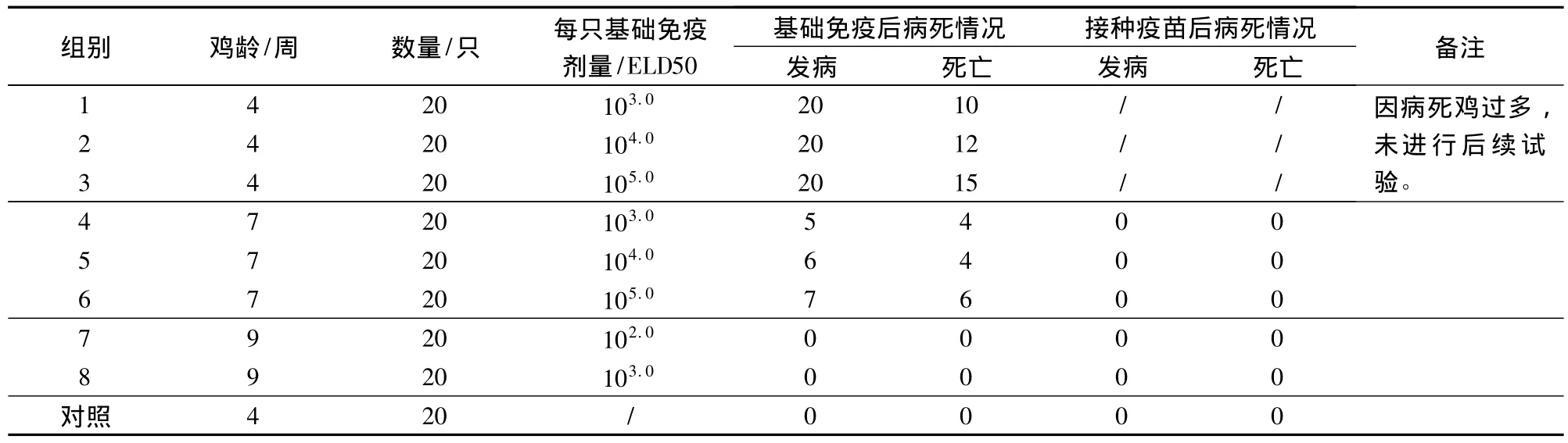
表1 建立檢驗方法的試驗方案及各組發病和死亡情況
2.2 檢驗方法的驗證 結果見表2。9、10周齡SPF雞免疫103.0ELD50的鴨瘟種毒均未引起雞只特異性發病和死亡,基礎免疫后14 d按《獸藥典》(二〇〇五年版)附錄20頁“雞檢查法”規定的劑量和程序鴨瘟活疫苗,均未出現因疫苗引起的異常臨床癥狀和特異性死亡。
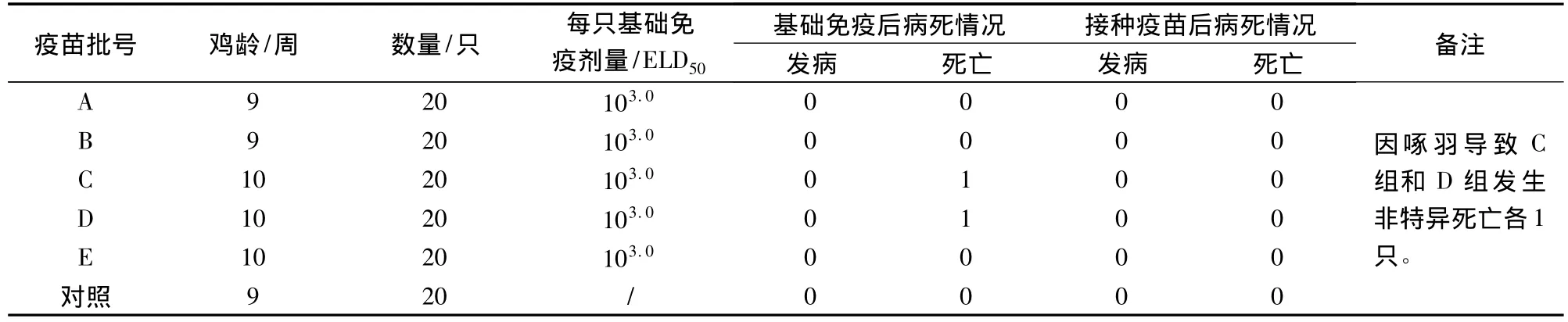
表2 驗證檢驗方法的試驗方案及各組雞發病死亡情況
2.3 抗體檢測結果 見表3。選取建立方法試驗的第6組(免疫劑量最大)、檢驗方法驗證試驗的5批疫苗及對照組雞的血清樣品,按《獸藥典》(二〇〇五年版)檢測11種(亞型)病原抗體,結果C和E 2批次疫苗中污染REV(抗體陽性率為47%和60%,S/P 比值為0.60 ~8.1 和0.69 ~7.48),說明目前我國鴨瘟活疫苗中有污染外源病毒的現象。
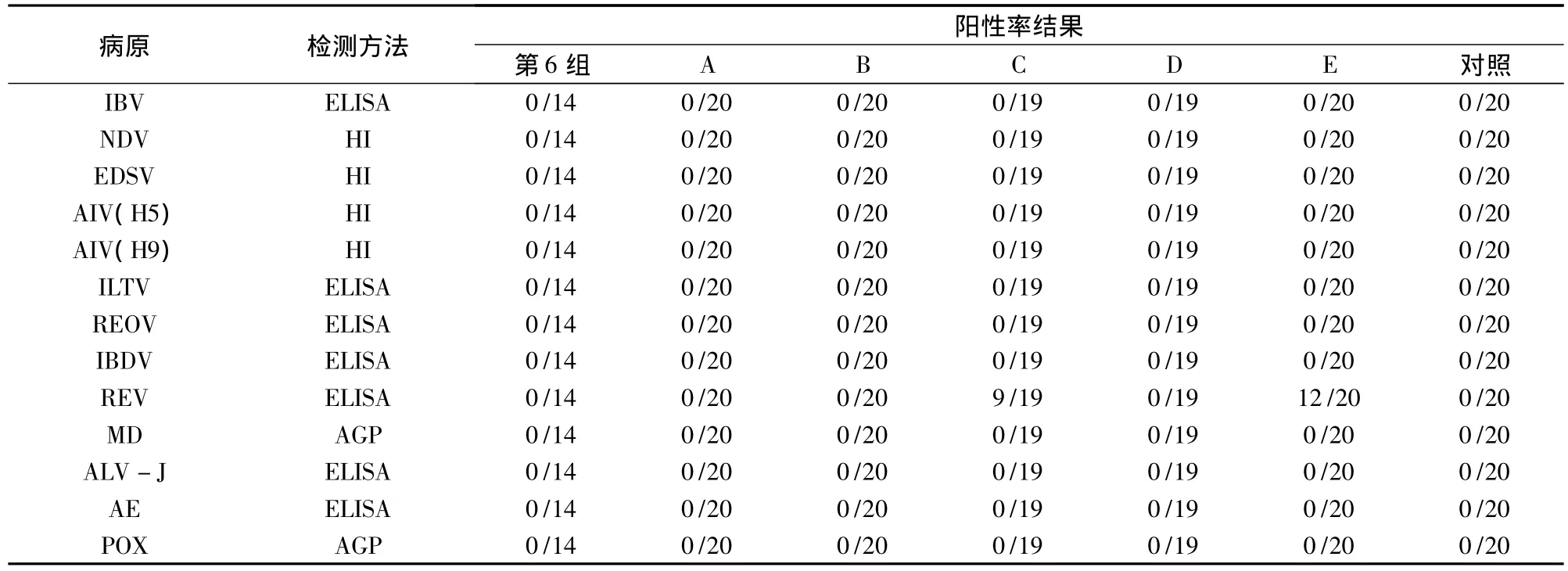
表3 抗體檢測結果
3 討論
目前國內使用的鴨瘟活疫苗種毒為1957年分離自發病鴨的強毒株[2],經雞胚連續傳代60多代后獲得,對鴨失去致病性,但保留了良好的免疫原性[3]。雞非鴨瘟病毒的自然易感宿主[4],但經雞胚連續傳代的鴨瘟病毒可在雞胚上增殖,其可以獲得高滴度的病毒,同時也可增強對雞的致病性。早在1981年,黃如意等研究人員就報道了鴨瘟活疫苗能致雛雞發病、死亡[5]。
外源病毒檢驗是獸用活疫苗質量標準中的關鍵項之一,有效控制外源病毒污染關系到疫苗使用的安全性和有效性,直接影響疫病防控效果和養殖業的健康發展,以及動物源性食品安全。有關外源病毒檢驗,《歐洲藥典》[6]、美國的《聯邦法規》(9CFR)[7]均有嚴格的規定和原則要求,我國《獸藥典》有關規定和要求與歐美相似,外源病毒檢驗方法參考國外的方法建立,并逐步完善。
我國是養鴨大國,鴨的養殖量占全球的60%以上,用于預防鴨病的生物制品品種相對較多,用量大。國外鴨的養殖量少,用于預防鴨病的活疫苗品種也少,鮮見鴨用活疫苗外源病毒檢驗的具體方法。鴨瘟活疫苗外源病毒檢驗按照我國原有《獸藥典》的有關規定無法進行,參照《歐洲藥典》有關水禽活疫苗種毒外源病毒雞檢查法的原則,研究建立用雞檢查法對鴨瘟活疫苗進行外源病毒檢驗的切實可行的方法。
本研究證實,9周齡以下的 SPF雞接種103.0ELD50的鴨瘟活疫苗可引起嚴重的發病和死亡,發病及死亡率隨著接種劑量增加有升高的趨勢,隨著接種雞日齡的提大,發病率和死亡率明顯下降,9周齡和10周齡SPF雞免疫103.0ELD50的鴨瘟活疫苗病毒后均無臨床癥狀和特意死亡。根據試驗結果,為保證外源病毒檢驗時免疫雞不發病,選擇9~12周齡的SPF雞用于檢驗。在按藥典規定劑量免疫前,先用低劑量鴨瘟病毒進行基礎免疫,從而建立了鴨瘟活疫苗的外源病毒檢驗的雞檢查法,該方法已被《獸藥典》(二〇一〇年版)[8]收錄。
應用建立的檢驗方法,對3個企業5批次的鴨瘟活疫苗進行了外源病毒檢驗,同時選取建立方法試驗時的第6組(免疫劑量最大)進行抗體檢測。結果表明,用于基礎免疫的鴨瘟種毒無外源病毒污染,2批次疫苗中污染了REV,說明目前我國鴨瘟活疫苗中有污染外源病毒的現象,有必要加強對鴨瘟活疫苗的監督檢驗。
致謝 感謝中國獸藥典委員會對本研究的資助。感謝瑞普(保定)生物藥業有限公司在動物實驗過程中給予的大力幫助。
[1] 中國獸藥典委員會.中華人民共和國獸藥典二○○五年版三部[S].
[2] 黃引賢.擬鴨瘟的研究[J].華南農學院學報,1959,1:67 -78.
[3] 農業部第四屆獸用生物制品規程委員會.中華人民共和國獸用生物制品規程2000年版[S].
[4] Saif Y M.Disease of Poultry[S].12thEdition.USA:Blackwell Publshing,2008.
[5] 黃如意,肖俊發,陳荷鳳,等.鴨瘟弱毒疫苗對雞致死研究初報[J].上海農業科技,1981,2:37,34.
[6] Council of Europe.European Pharmacopoeia[S].6thEdition.Section 2.6.24;Revised 2008.
[7] Office of the Federal Register National Archives and Records Administration.Code of Federal Regulations(9 Animal and Animal Products)[S].USA:US Government Pringting Officeh,2007.
[8] 中國獸藥典委員會.中華人民共和國獸藥典二○一○年版三部[S].

