手術創傷引起的海馬炎癥反應對老年小鼠術后認知功能的影響*
何 龍,艾艷秋,儲勤軍,魯穩梁,張 衛
鄭州大學第一附屬醫院麻醉科 鄭州450052
#通訊作者,女,1963年9月生,博士,教授,研究方向:麻醉學,E-mail:aiyanqiu82@sohu.com
術后認知功能障礙(postoperative cognitive dysfunction,POCD)是老年人術后常見的中樞神經系統并發癥,主要表現為術后記憶力、判斷力及認知功能受損,同時伴有社會活動能力減退[1]。POCD 的確切發病機制目前尚不明確。作者觀察了老年小鼠肝臟部分切除術后認知功能和海馬炎癥因子表達水平的變化,以探討圍術期手術創傷引起的神經炎癥反應對術后認知功能的影響。
1 材料與方法
1.1 動物選擇及分組 96 只健康雄性昆明小鼠由河南省實驗動物中心提供,月齡16 個月,體質量30~40 g。采用隨機數字表法分為4組,每組24只。對照組(NS組)腹腔注射生理鹽水0.1 mL/10 g;麻醉組(Ane組)腹腔內注射芬太尼0.2 mg/kg、氟哌利多5 mg/kg 行動物麻醉;假手術組(Sham組)和手術組(Sur組)采用與Ane組相同的麻醉方法行動物麻醉,待反正反射消失后,腹部擬切口部位常規備皮消毒,于劍突下腹部正中做一2.0 cm 左右切口。Sham組打開腹腔,5 min 后,腹腔注射生理鹽水0.3 mL 補充液體丟失,2.5 g/L 的丁哌卡因浸潤切口,以0 號絲線分層縫合腹膜和腹壁; Sur組打開腹腔后充分暴露肝臟,棉簽抬起肝臟左外側葉,充分游離后結扎,剪下肝臟左外側葉(約占整個肝臟體積的1/3),后續處理同Sham組。手術時間約20 min。待動物清醒后放回鋪有棉紗布墊的籠具,注意保暖。
1.2 認知功能測試 采用Morris 水迷宮法[2],包括定位航行實驗和空間探索實驗兩個部分。術前進行定位航行實驗,歷時5 d,動物面向池壁隨機從4 個入水點放入水迷宮中,共4 次。尋找平臺(平臺置于Ⅰ象限,直徑10 cm,沒于水面下1 cm)最大時限設定為60 s,取當天4 次測試結果平均值進入最后統計分析。麻醉或手術后第1、3、7 天,分別從各組中隨機抽取8 只動物進行空間探索實驗[即撤去平臺,選取平臺正對象限(Ⅲ象限)的中點為入水點將動物面向池壁放入水中,自由游泳60 s]。攝像系統及相應分析軟件自動分析記錄動物游泳軌跡、逃避潛伏期、游泳距離、游泳速度、目標象限停留時間百分比、1 min 內穿越平臺次數等參數。
1.3 海馬組織IL-1β、IL-6、TNF-α 蛋白及mRNA的表達檢測 認知功能測定完畢后,動物麻醉下處死取腦,迅速分離海馬,置入液氮中,后轉存至-80℃低溫冰箱保存,以檢測IL-1β、IL-6、TNF-α 蛋白及其mRNA 的表達水平。
1.3.1 Western blot 法檢測海馬IL-1β、IL-6、TNF-α蛋白的表達 海馬組織加入RIPA 裂解液,低溫勻漿,4℃下12 000 g 離心5 min,取上清液。BCA 法測定樣品蛋白濃度。取蛋白樣品40 μg 與等體積的上樣緩沖液混合,煮沸10 min,100 g/L SDS 凝膠電泳后,轉至PVDF 膜,50 g/L 脫脂奶粉封閉1 h,加入一抗按(按1∶ 1 000 稀釋,英國Abcam 公司)和βactin(按1∶ 1 000 稀釋,英國Abcam 公司),4℃孵育過夜,TBST 洗膜,加入辣根過氧化物酶標記的羊抗兔抗體(按1 ∶ 4 000 稀釋)及鼠抗β-actin 抗體(按1∶ 5 000 稀釋),37℃孵育2 h,TBST 洗膜,ECL化學發光液X 光片曝光顯色。采用UVP 凝膠成像系統分析儀采集圖像,Quantity One 軟件進行分析,以目的蛋白與β-actin 灰度值的比值代表IL-1β、IL-6、TNF-α 的表達水平。
1.3.2 Real Time RT-PCR 法檢測海馬IL-1β、IL-6、TNF-α mRNA 的表達 Trizol 總RNA 提取試劑盒(TaKaRa 公司)抽提總RNA,參照逆轉錄試劑盒(TaKaRa 公司)進行逆轉錄反應。應用軟件Premier 5.0 設計其擴增引物,由大連寶生物公司合成。β-actin 上游引物序列5’-CCCATCTATGAGGGTTACGC-3’,下游引物序列5’-TTTAATGTCACGCACGATTTC-3’,擴增產物大小為150 bp;IL-1β 上游引物序列5’-TCCAGGATGAGGACATGAGCAC-3’,下游引物序列5’-GAACGTCACACACCAGCAGGTTA-3’,擴增產物大小為105 bp; IL-6 上游引物序列5’-AAATTCGGTA CATCCTCGAC-3’,下游引物序列5’-CCTCTTTGCT GCTTTCACAC-3’,擴增產物大小為84 bp; TNF-α 上游引物序列5’-GTTCTATGGCCCAGACCCTCAC-3’,下游引物序列5’-GGCACCACTAGTTGGTTGTCTTTG-3’,擴增產物大小為175 bp。采用SYBR Green Real Time PCR 試劑盒(TaKaRa 公司)對逆轉錄產物進行擴增。PCR 反應條件:95℃預變性1 min;95℃變性30 s,58℃退火35 s,72℃延伸1 min,共40 個循環;最后72℃延伸10 min。以2-ΔΔCT法計算IL-1β、IL-6及TNF-α mRNA 的表達水平。
1.4 統計學處理 采用SPSS 17.0 處理數據,4組逃避潛伏期和潛伏期內游泳總路程的比較應用重復測量數據的方差分析,其他指標的比較應用析因設計的方差分析,檢驗水準α=0.05。
2 結果
2.1 術前定位航行實驗逃避潛伏期及逃避潛伏期內游泳總路程比較 見表1。各組逃避潛伏期、潛伏期內游泳總路程隨著訓練時間的增加而逐漸減小,同一時間點各組間比較差異無統計學意義。
2.2 術后游泳速度、目標象限停留時間百分比及1 min 內穿臺次數的比較 見表2。術后第1、3、7 天,4組動物游泳速度比較差異無統計學意義; 目標象限停留時間百分比及1 min 內穿臺次數比較差異有統計學意義。
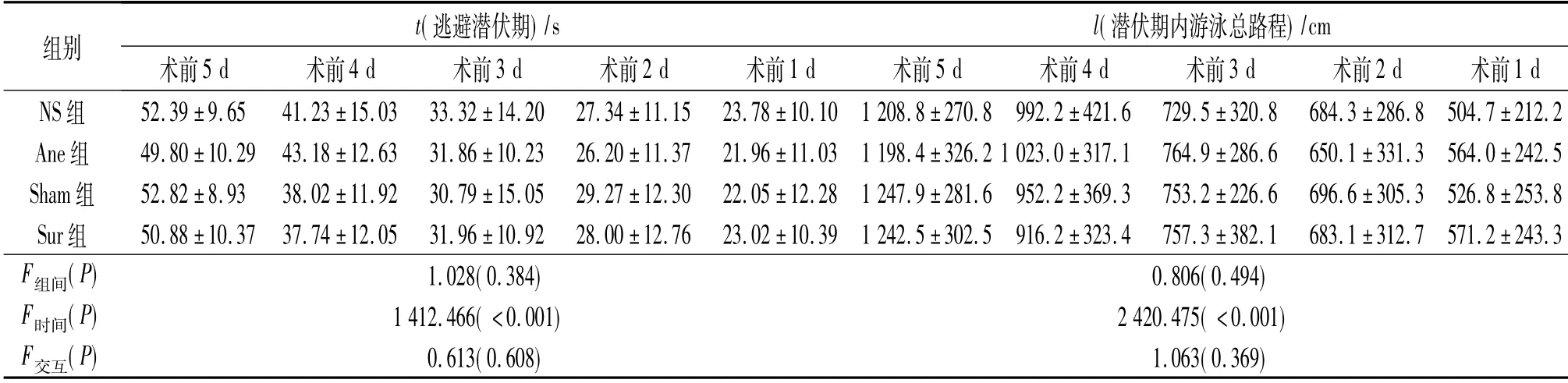
表1 4組術前逃避潛伏期、潛伏期游泳總路程的比較(n=24)
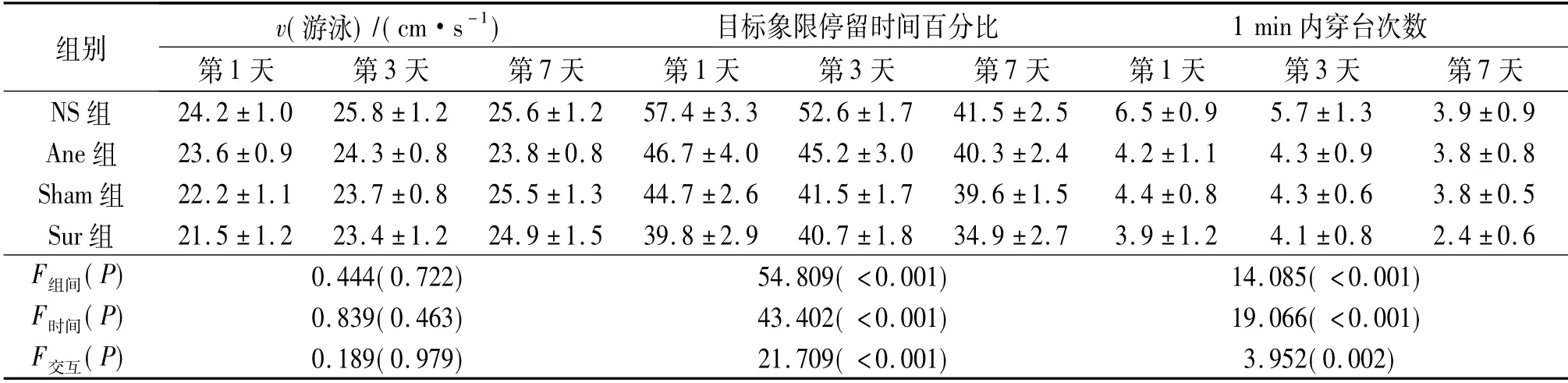
表2 術后第1、3、7 天4組動物游泳速度、目標象限停留時間百分比及1 min 內穿臺次數的比較(n=8)
2.3 術后第1、3、7 天4組動物海馬IL-1β、IL-6 及 TNF-α 蛋白和mRNA 表達水平的比較 見表3、4。
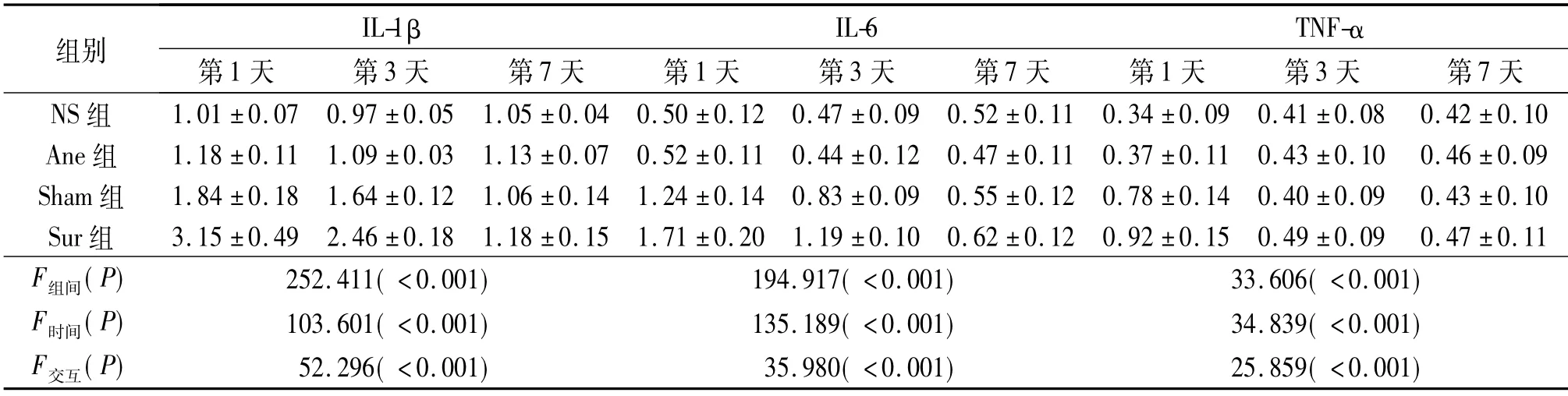
表3 術后第1、3、7 天4組動物海馬IL-1β、IL-6、TNF-α 蛋白的表達水平比較(n=8)
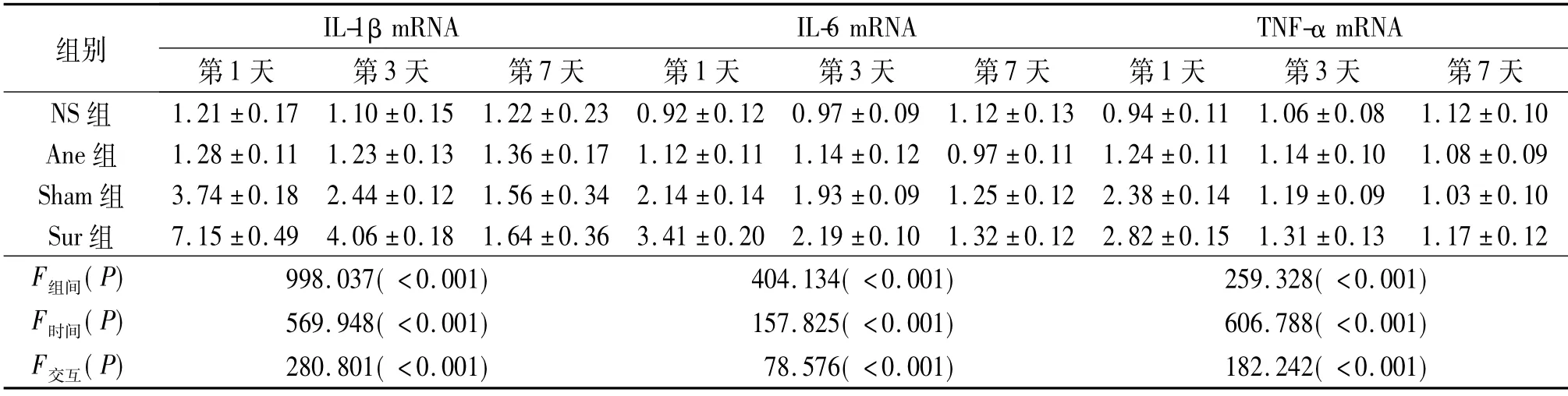
表4 術后第1、3、7 天海馬IL-1β、IL-6 及TNF-α mRNA 的表達水平比較(n=8)
3 討論
POCD 的確切病因目前尚不明確。研究[3]表明中樞炎癥反應在與衰老有關的認知功能減退中起重要作用,而手術創傷引起的炎癥反應是圍術期發生的重要病理生理學改變。小鼠各肝葉相對質量恒定,肝左葉切除能夠獲得恒定的切除率,損傷程度容易控制,僅切除小鼠肝左葉不會引起肝功能和機體物質代謝障礙[4]。且有研究[5]報道針對老年小鼠手術創傷引起的中樞炎癥反應較成年小鼠更為強烈,因此該實驗選用老年小鼠實施肝左葉切除手術,檢測術后海馬炎癥因子表達水平和認知功能改變,觀察手術創傷引起的海馬炎癥反應對老年小鼠術后認知功能的影響。
該實驗中術前各組動物逃避潛伏期、潛伏期游泳總路程隨著實驗時間增加而逐漸減小,表明動物對空間環境逐漸形成了記憶。Sur組術后認知功能明顯受損,同時伴有海馬炎癥因子表達上調,但Sur組認知功能下降程度和炎癥因子表達水平均高于Sham組,可能是由于Sur組的創傷嚴重程度高于Sham組所致。有研究[6]報道創傷后炎癥因子表達水平與創傷嚴重程度密切相關,而中樞較高濃度的炎癥因子對學習記憶功能的損害可能更加嚴重[7]。
中樞神經系統生理濃度的IL-1β、IL-6、TNF-α在學習記憶過程中具有重要作用,但過量表達卻能夠導致學習記憶功能損害; 海馬是腦內炎癥因子受體表達的聚居區,對炎癥反應引起的損傷更為敏感[8]。TNF-α 在炎癥反應的起始階段和級聯放大過程中具有重要作用,參與調控細胞因子、趨化因子的釋放和中樞膠質細胞的激活,可通過活化中樞免疫細胞、招募外周循環中的免疫細胞進入中樞,引起神經炎癥反應,產生過量炎癥因子,最終導致動物學習記憶功能障礙[9]。IL-1β 也參與神經炎癥反應的調控過程,中樞腦組織IL-1β 持續過量表達能夠導致認知功能損害[10]。而IL-6 作為內源性熱原質,通過易化其他促炎介質的促炎作用,加重炎癥反應對認知功能的損傷[11]。
綜上所述,老年小鼠肝臟部分切除術能夠引起術后認知功能障礙,其機制可能與手術創傷所導致的中樞海馬組織中炎癥因子IL-1β、IL-6 及TNF-α的表達上調有關。
[1]Norkiene I,Samalavicius R,Misiuriene I,et al.Incidence and risk factors for early postoperative cognitive decline after coronary artery bypass grafting[J].Medicina(Kaunas),2010,46(7):460
[2]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848
[3]Kawasaki T,Sata T.Perioperative innate immunity and its modulation[J].J UOEH,2011,33(2):123
[4]Nikfarjam M,Malcontenti-Wilson C,Fanartzis M,et al.A model of partial hepatectomy in mice[J].Invest Surg,2004,17(5):291
[5]Rosczyk H,Sparkman N,Johnson R.Neuroinflammation and cognitive function in aged mice following minor surgery[J].Exp Gerontol,2008,43(9):840
[6]Huang TJ,Hsu RW,Li YY,et al.Less systemic cytokine response in patients following microendoscopic versus open lumbar discectomy[J].J Orthop Res,2005,23(2):406
[7]Canet J,Raeder J,Rasmussen L,et al.Cognitive dysfunction after minor surgery in the elderly[J].Acta Anaesthesiol Scand,2003,47(10):1204
[8]Yirmiya R,Goshen I.Immune modulation of learning,memory,neural plasticity and neurogenesis[J].Brain Behavi Immun,2011,25(2):181
[9]Terrando N,Monaco C,Ma D,et al.Tumor necrosis factor-alpha triggers a cytokine cascade yielding postoperative cognitive decline[J].Proc Natl Acad Sci USA,2010,107(47):20518
[10]Cibelli M,Fidalgo AR,Terrando N,et al.Role of interleukin-1β in postoperative cognitive dysfunction[J].Ann Neurol,2010,68(3):360
[11]Weaver J,Huang MH,Albert M,et al.Interleukin-6 and risk of cognitive decline[J].Neurology,2002,59(3):371

