6-位脂肪胺取代的萘酰亞胺衍生物與DNA的相互作用
解麗娟
(華僑大學 分子藥物學研究所,福建 泉州 362021)
6-位脂肪胺取代的萘酰亞胺衍生物與DNA的相互作用
解麗娟
(華僑大學 分子藥物學研究所,福建 泉州 362021)
利用紫外可見光譜、熒光光譜、圓二色譜和粘度測試,考察了8個6-位脂肪胺取代的萘酰亞胺衍生物與小牛胸腺DNA的相互作用.研究結果表明:小牛胸腺DNA對與其結合能力強的化合物3a~3d有熒光猝滅作用,對與其結合能力弱的3e~3h有熒光增強效應;圓二色譜顯示這些萘酰亞胺化合物能引起DNA二級結構發生不同的變化.在紫外-可見吸收光譜和粘度測試中,這些化合物與DNA的相互作用沒有差別.綜合光譜學和粘度測試的結果,推斷這些化合物是通過嵌插方式與DNA結合,由于結構不同,它們與DNA之間作用程度存在差異.
萘酰亞胺;小牛胸腺DNA;光譜;粘度;相互作用;嵌插方式
小分子化合物與DNA相互作用的研究一直是引人關注的領域[1-3].通過研究小分子化合物與DNA的相互作用,一方面可以了解引起DNA結構變化和影響其生理功能的因素;另一方面可以從分子水平了解小分子抗腫瘤化合物的作用機制,從而為防治腫瘤發生及開發新的高效抗腫瘤藥物提供指導.萘酰亞胺類衍生物是一類著名的DNA嵌入劑和拓撲異構酶Ⅱ型抑制劑,對多種人和鼠的腫瘤細胞具有較高的抗腫瘤活性[4-8].近年來,因發現萘酰亞胺類化合物具有抗多藥耐藥性[7],對其研究日益引起人們的關注.文獻[9-11]分別報道了不同結構的6-位脂肪胺取代的萘酰亞胺衍生物,但并未深入研究所報道的萘酰亞胺衍生物與DNA的相互作用.萘酰亞胺衍生物與DNA發生非共價結合后,兩者的物理性質都會發生明顯的變化,通過測定其變化,可以定性、定量地評價萘酰亞胺衍生物與DNA的結合過程,確定結合模式[12-15].Long等[12]提出并證明需要融合幾組實驗技術才能很好地確定化合物與DNA的結合模式.這些實驗技術包括:1)評價DNA螺旋變化;2)反映DNA和結合的化合物之間的電性作用;3)確定分子嵌入DNA的取向.本文利用紫外吸收光譜、熒光發射光譜、圓二色譜和粘度測試法,分別考察包括文獻[9-11]報道在內的8個6-位脂肪胺取代的萘酰亞胺衍生物與DNA的相互作用.
1 實驗部分
1.1 原料與儀器
原料及溶劑均為市售分析純,緩沖溶液自行配制;小牛胸腺DNA(CT-DNA,美國Sigma公司);柱色譜硅膠(200-300目,山東青島海洋化工廠).
HP1100LC/MSD型質譜儀(美國HP公司),GCT CA156型和LCT型質譜儀(英國Micromass公司),Nicolet 20DXB型FR-IR紅外光譜儀(美國Nicolet公司),Varian INOVA 400型核磁共振儀(400 MHz,TMS為內標,美國Varian公司),X-6型顯微熔點測定儀(北京泰克儀器有限公司),F-4500型熒光分光光度計(日本日立公司),BS-210S型萬分之一電子天平(德國Sartorius公司),UV-3100型分光光度計(日本島津公司),J-810型圓二色譜儀(日本Jasco公司).
1.2 6-位脂肪胺取代的萘酰亞胺衍生物的合成
圖1為8個6-位脂肪胺取代的萘酰亞胺衍生物結構圖.圖1中:3a,3b,3c和3f被Antonini等[10],Wu等[11]和 Norton等[9]分別報道過.
萘酰亞胺衍生物的具體合成方法:將4-溴-1,8-萘酐(277mg,1mmol)和N,N-二甲基乙二胺(112 μL,1.2mmol)溶于20mL乙醇中,加熱回流2h,減壓蒸除溶劑,得到中間體.該中間體(174mg,0.5 mmol)與要取代的脂肪胺(2mmol)和碳酸鉀(69mg,0.5mmol)溶于15mL的乙二醇單甲醚中,加熱回流8~12h;粗產物經硅膠柱柱層析精制,得到目標產物.最后,產物的結構經過高分辨質譜、核磁(氫譜和碳譜)、紅外光譜的表征和驗證.

圖1 6-位脂肪胺取代萘酰亞胺衍生物的結構Fig.1 Structure of 6-aliphatic amine substituted naphthalimide derivatives
1.3 測定方法[12-15]
1.3.1 紫外吸收光譜測定 紫外滴定實驗在UV-3100型分光光度計上進行,使用1cm石英吸收池,溫度為25℃.首先用空白溶劑(30mmol·L-1,pH=7.5的Tris-HCl緩沖溶液)對儀器進行基線校正,測量200~600nm范圍內濃度為50μmol·L-1的萘酰亞胺衍生物的紫外吸收譜;然后,往溶液中滴加CT-DNA,改變其與萘酰亞胺衍生物的濃度比值.每次加完DNA后混合數遍,以使DNA和萘酰亞胺衍生物充分接觸、反應;放置10min后,使兩者反應達到平衡并測量、記錄光譜數據.
1.3.2 熒光發射光譜測定 取0.1mL精確配制的,濃度為0.1~1.0mmol·L-1的萘酰亞胺衍生物DMSO溶液,與30mmol·L-1的Tris-HCl(pH=7.5)緩沖溶液混合于10mL的容量瓶中,制備兩組萘酰亞胺衍生物的Tris-HCl-DMSO溶液.其中一組為加入小牛胸腺DNA(CT-DNA)的Tris-HCl溶液,另一組為不含DNA的相同濃度化合物的溶液,萘酰亞胺衍生物的濃度保持在1.0~10.0μmol·L-1之間,CT-DNA的濃度為50μmol·L-1,定容,室溫避光放置一夜.將得到的一組樣品液和空白對照液分別置于1cm石英比色池中進行測試,掃描速度為1 200nm·min-1,激發波長為最大吸收值,激發狹縫寬度5nm,發射狹縫寬度5nm,測其熒光發射譜.
1.3.3 圓二色譜測定 將濃度為10μmol·L-1的萘酰亞胺衍生物加入到100μmol·L-1的CT-DNA溶液中,比較化合物在加入DNA前后所引起的DNA自身圓二色譜(CD)譜圖的變化.實驗條件:掃描范圍為200~600nm;掃描速度為500nm·s-1;響應時間為0.5s;狹縫寬度為2nm;積累次數為2次;CD譜的樣品池厚度為1.0cm.
1.3.4 粘度測試 將CT-DNA溶于Tris-HCl緩沖溶液(30mmol·L-1,pH=7.5)中,于4℃下保存;全部溶解后,在超聲儀中震蕩10min,用PVDF膜(孔徑0.45μm)過濾,以濾去不溶物,配制的CTDNA濃度為100μmol·L-1[16].粘度測定在烏氏粘度計上進行,放置于恒溫水域槽中,水浴保持恒溫25℃.吸取10mL,100μmol·L-1的CT-DNA置于粘度計中,用秒表記錄滴下時間.然后,分別滴加濃度為1.0mmol·L-1的萘酰亞胺衍生物溶液,使其濃度和DNA濃度的比值逐漸增加,用吸耳球鼓泡以混勻溶液;記錄萘酰亞胺衍生物滴下時間并重復測量3次,每次相差不超過0.2s,取其平均值.以(η/η0)1/3是相對于萘酰亞胺衍生物濃度與DNA濃度的比值作圖.其中:η表示滴加萘酰亞胺衍生物后DNA的相對運動粘度;η0表示沒有萘酰亞胺衍生物時DNA的相對運動粘度[17].
2 結果與分析
2.1 紫外吸收光譜分析
萘酰亞胺衍生物3a的紫外吸收光譜(UV-Vis),如圖2所示.圖2中:A為吸光度;曲線1~10的DNA與萘酰亞胺衍生物的濃度比值分別為0.02,0.04,0.06,0.10,0.14,0.20,0.30,0.40,0.50,1.00.
由圖2可以發現:隨著CT-DNA的不斷滴加,萘酰亞胺衍生物3a的特征吸收帶呈現明顯的減色效應,不過并沒有出現吸收峰位置紅移和等吸收點,這表明萘酰亞胺衍生物與DNA的堿基電子產生相互作用.
其他萘酰亞胺衍生物的紫外吸收光譜在逐漸滴加CTDNA后也呈現類似的現象,表明不同6-位脂肪胺取代的萘酰亞胺衍生物可能與DNA以相同或近似的方式相結合.

圖2 萘酰亞胺衍生物與CT-DNA相互作用的紫外吸收光譜Fig.2 UV-vis absorption spectra of interaction between naphthalimide derivatives and CT-DNA
2.2 熒光發射光譜分析
萘酰亞胺衍生物3a,3h與CT-DNA相互作用的熒光發射譜,如圖3所示.圖3中:I為熒光強度;曲線1~6的萘酰亞胺衍生物濃度分別為2.5,5.0,7.5,10.0,15.0,20.0μmol·L-1;曲線1′~6′則在上述萘酰亞胺衍生物濃度下均加入50μmol·L-1的DNA.從圖3可知:像大多數DNA嵌入劑一樣,隨著CT-DNA的不斷滴加,萘酰亞胺衍生物的熒光強度不斷下降,發射峰沒有位移變化.萘酰亞胺衍生物3b,3c和3d在滴加CT-DNA后,其熒光發射譜也產生相似的熒光淬滅現象.然而,萘酰亞胺衍生物3e,3f,3g和3h在滴加CT-DNA后,其熒光發射譜呈現明顯的熒光增強現象.
分析萘酰亞胺衍生物結構可以發現,萘酰亞胺衍生物3a,3b和3d都有富含電子的叔胺氮原子存在,在測試條件下氮原子易質子化,使得萘酰亞胺衍生物容易和帶負電荷的DNA相結合.萘酰亞胺衍生物3c盡管不含有這種氮原子,分子中的噻吩基團是苯的生物異構體,即富含電子,同時也容易容納負電荷.因此,萘酰亞胺衍生物3a~3d容易與DNA相結合,發生電子轉移和能量轉移,導致發射光譜產生熒光猝滅現象.另外,萘酰亞胺衍生物3e~3h的結構沒有這種特征,因此它們像溴化乙錠(EB)這種典型的DNA嵌入劑一樣,在與DNA結合后熒光發射譜呈現熒光增強.

圖3 萘酰亞胺衍生物與CT-DNA相互作用的熒光光譜Fig.3 Fluorescence spectra of interaction between naphthalimide derivatives and CT-DNA
萘酰亞胺衍生物與DNA之間的表觀結合常數Kb,可以利用Scatchard方程[18-19]求得.經計算,萘酰亞胺衍生物3a~3h的每一位點固有的結合常數分別為0.194,0.231,0.183,0.226,0.048,0.018,0.025,0.018ML·mol-1,即萘酰亞胺衍生物3a,3b,3c和3d與DNA之間的結合常數值明顯高于萘酰亞胺衍生物3e,3f,3g和3h與DNA之間的結合常數值.這個結果支持了關于導致萘酰亞胺衍生物發射光譜呈現差異的解釋.
2.3 圓二色譜分析
在CT-DNA溶液中分別滴加萘酰亞胺衍生物3a,3d和3h,其圓二色譜如圖4所示.圖4中:θ為摩爾橢圓度;DNA濃度為100μmol·L-1;萘酰亞胺衍生物3a,3d和3h的濃度為10.0μmol·L-1;小圖為誘導圓二色譜(ICD).圖4對應于B型CT-DNA的二級結構構象.
從圖4可知:279nm處的正峰是由于DNA的堿基對堆積而產生的,247nm處的負峰是由于DNA的雙螺旋結構而產生的.在CT-DNA溶液中分別滴加萘酰亞胺衍生物3a,3d和3h后,萘酰亞胺衍生物3a和3d均引起CT-DNA的CD譜中正、負峰的摩爾橢圓度絕對值增加,標志萘酰亞胺衍生物嵌入DNA堿基對后使堿基堆積增強,雙螺旋更緊湊;萘酰亞胺衍生物3h引起CD譜中正峰的摩爾橢圓度絕對值增加,負峰的摩爾橢圓度絕對值下降.這個現象進一步表明,萘酰亞胺衍生物因取代基團不同導致其和DNA結合存在差異.
在萘酰亞胺衍生物紫外最大吸收位置能夠觀察到誘導圓二色譜吸收帶.由圖4右上角的ICD放大圖可以看到:萘酰亞胺衍生物的ICD信號的摩爾橢圓度絕對值不超過1.0L·(mol·cm)-1.通常,DNA嵌入劑的ICD信號值較小,最大不超過10.0L·(mol·cm)-1.因此,可以確定萘酰亞胺衍生物是通過嵌插方式與DNA結合的.根據ICD圖譜可以得到DNA與嵌入劑結合的角度取向和位置信息.當嵌入劑的藥效團與DNA雙螺旋的對稱軸平行(γ=0°)時,產生正的ICD信號;當嵌入劑的藥效團與DNA雙螺旋的對稱軸垂直(γ=90°)時,產生負的ICD信號[20-21].結果顯示:萘酰亞胺衍生物的藥效團即萘酰亞胺母體環與DNA雙螺旋的對稱軸是垂直的.
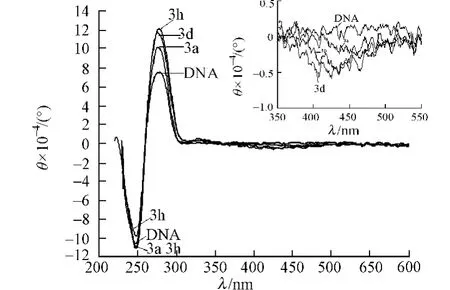
圖4 萘酰亞胺衍生物與CT-DNA相互作用的圓二色譜圖Fig.4 CD spectra of interaction between naphthalimide derivatives and CT-DNA
2.4 粘度測試分析
萘酰亞胺衍生物對CT-DNA溶液粘度的影響,如圖5所示.圖5中:DNA濃度為100μmol·L-1;反應溫度為(25±0.1)℃.由圖5可知,隨著萘酰亞胺衍生物3a,3c,3d,3e和3h的滴加,都會引起DNA溶液的粘度不斷增加,證明萘酰亞胺衍生物確實與DNA發生嵌插結合.

圖5 萘酰亞胺衍生物對CT-DNA溶液粘度的影響Fig.5 Effect of naphthalimide derivatives on CT-DNA viscosity
3 結束語
綜合光譜測試和粘度測試的結果可以確定,6-位脂肪胺取代的萘酰亞胺衍生物是通過嵌插方式與DNA相結合.不過,因為萘酰亞胺衍生物結構不同,它們與DNA結合程度存在差異.其中,含有富電子基團的萘酰亞胺衍生物與DNA結合能力強,沒有這種取代基團的萘酰亞胺衍生物與DNA結合能力較弱,結果這兩類萘酰亞胺衍生物與DNA作用后熒光光譜和CD譜呈現不同的現象.
[1]LI Nan,MA Ying,YANG Cheng,et al.Interaction of anticancer drug mitoxantrone with DNA analyzed by electrochemical and spectroscopic methods[J].Biophys Chem,2005,116(3):199-205.
[2]MAHESWARI P U,RAJENDIRAN V,STOECKLI-EVANS H,et al.Interaction of rac-[Ru(5,6-dmp)3]2+with DNA:Enantiospecific DNA binding and ligand-promoted exciton coupling[J].Inorg Chem,2006,45(1):37-50.
[3]WANG Bo-chu,TAN Jun,ZHU Lian-cai.Selective binding of small molecules to DNA:Application and perspectives[J].Colloid Surface B,2010,79(1):1-4.
[4]BRA?A M F,CACHO M,GRADILLAS A,et al.Intercalators as anticancer drugs[J].Curr Pharm Des,2001,7(17):1745-1780.
[5]BRA?A M F,RAMOS A.Naphthalimides as anticancer agents:Synthesis and biological activity[J].Curr Med Chem-Anti-Cancer Agents,2001,1(3):237-255.
[6]朱虹,丁健.萘酰亞胺類化合物作為抗腫瘤藥物的研發現狀[J].中國新藥雜志,2007,16(10):742-747.
[7]INGRASSIA L,LEFRANC F,KISS R,et al.Naphthalimides and azonafides as promising anti-cancer agents[J].Curr Med Chem,2009,16(10):1192-1213.
[8]Lü Min,XU Hui.Overview of naphthalimide analogs as anticancer agents[J].Curr Med Chem,2009,16(36):4797-4813.
[9]NORTON J T,WITSCHI M A,HUANG Sui,et al.Synthesis and anticancer activitives of 6-amino amonafide derivatives[J].Anti-Cancer Drugs,2008,19(1):23-36.
[10]ANTONINI I,VOLPINI R,BEN D D,et al.Design,synthesis,and biological evaluation of new mitonafide derivatives as potential antitumor drugs[J].Bioorg Med Chem,2008,16(18):8440-8446.
[11]WU Ai-bin,XU Yu-fang,QIAN Xu-hong,et al.Novel naphthalimide derivatives as potential apoptosis-inducing agents:Design,synthesis and biological evaluation[J].Eur J Med Chem,2009,44(11):4674-4680.
[12]IHMELS H,OTTO D.Intercalation of organic dye molecules into double-stranded DNA:General principles and recent developments[J].Top Curr Chem,2005,258:161-204.
[13]LONG E C,BARTON J K.On demonstrating DNA intercalation[J].Acc Chem Res,1990,23(9):271-273.
[14]PALCHAUDHURI R,HERGENROTHER P J.DNA as a target for anticancer compounds:Methods to determine the mode of binding and the mechanism of action[J].Curr Opin Biotechnol,2007,18(6):497-503.
[15]WHEATE N J,BRODIE C R,ALDRICH-WRIGHT J R,et al.DNA intercalators in cancer therapy:Organic and inorganic drugs and their spectroscopic tools of analysis[J].Mini-Rev Med Chem,2007,7(6):627-648.
[16]NISHIMURA T,OKOBIRA T,KELLY A M,et al.DNA binding of tilorone:1H NMR and calorimetric studies of the intercalation[J].Biochemistry,2007,46(27):8156-8163.
[17]LI Feng,CUI Jing-nan,QIAN Xu-hong,et al.Molecular design,chemical synthesis,and biological evaluation of′4-1′pentacyclic aryl/heteroaryl-imidazonaphthalimides[J].Bioorg Med Chem,2007,15(15):5114-5121.
[18]SCATCHARD G,ANN N Y.The Attractions of proteins for small molecules and ions[J].Acad Sci,1949,51(4):660-672.
[19]GUPTA M,ALI R.Fluorescence studies on the interaction of furocoumarins with DNA in the dark[J].J Biochem,1984,95(5):1253-1257.
[20]楊源源,張志超,盛輝,等.一種苊并雜環有機小分子嵌入DNA的幾何學模式研究[J].高等學校化學學報,2007,28(3):453-457.
[21]劉振佳,司伊康,陳曉光.圓二色譜測定技術在小分子化合物與DNA相互作用研究中的應用[J].藥學學報,2010,45(12):1478-1484.
Interaction between 6-Aliphatic Amine Substituted Naphthalimide Derivatives and DNA
XIE Li-juan
(Institute of Molecular Mediacine,Huaqiao University,Quanzhou 362021,China)
The DNA-binding behavior of eight 6-aliphatic amine substituted naphthalimide derivatives was investigated by UV-vis absorption spectra,fluorescence spectra,circular dichroism (CD)and viscosity measurement.The significant fluorescence quenching of 3a,3b,3cand 3dhaving stronger DNA-binding efficiency was observed upon addition of DNA,while the significant fluorescence enhancement of 3e,3f,3g and 3hhaving weaker DNA-binding efficiency was seen.CD results indicated that the change the secondary DNA structure induced by the derivatives was different.In UV-vis and viscosity measument,no obvious difference in the interaction of the derivatives and DNA was found.Taking the spectra and viscosity measurement results,it was concluded that the naphthalimide derivatives bound to DNA via intercalation and there was differential in the degree of the interaction.
naphthalimide;calf thymus DNA;spectra;viscosity;interaction;intercalated binding
陳志賢 英文審校:劉源崗)
R 961
A
1000-5013(2012)01-0039-05
2011-09-19
解麗娟(1971-),女,工程師,主要從事小分子抗腫瘤藥物及基因載體的研究.E-mail:xielijuan@hqu.edu.cn.

