從粉煤灰中提取氧化鋁熟料的溶出過程動力學
孫培梅,童軍武,薛冰,趙喆,徐紅艷,張佼陽
(中國礦業大學(北京) 化學與環境工程學院,北京,100083)
目前,對從粉煤灰中提取有價化合物氧化鋁已成為粉煤灰綜合利用的一個重要方面[1?3]。從粉煤灰中制備氧化鋁的方法有多種,如酸溶法、蘇打燒結法、酸堿聯合法、石灰石燒結法等[4?7]。近年來,孫培梅等[8?9]對采用石灰石燒結熟料自粉化方法從粉煤灰中提取氧化鋁及對熟料的燒成過程和熟料的溶出過程工藝條件進行了系統實驗研究。熟料在碳酸鈉溶液中的溶出是石灰石燒結法從粉煤灰中提取氧化鋁的一個主要工序,它直接影響到提取過程氧化鋁的回收率,因此,研究熟料溶出過程動力學,探索溶出過程鋁的反應行為,找出過程的控制步驟,尋求溶出過程的強化措施,是粉煤灰中提高氧化鋁回收率的關鍵。近年來,張興法等[10?11]對含鋁物料如鋁土礦等的燒成熟料的溶出過程動力學行為進行了研究,但對粉煤灰燒成熟料中鋁的溶出動力學研究不多。為此,本文作者在對采用石灰石燒結法從粉煤灰中提取氧化鋁工藝研究的基礎上,進一步對燒成熟料在碳酸鈉溶液中的溶出過程動力學進行研究。
1 熟料溶出過程的基本原理
在采用石灰石燒結法從粉煤灰中提取氧化鋁的熟料燒成過程中,粉煤灰中以莫來石(3Al2O3·2SiO2)形態存在的氧化鋁和以石英(SiO2)形態存在的硅和石灰石反應,轉變為12CaO·7Al2O3和2CaO·SiO2。當在碳酸鈉溶液中溶出時,熟料中的氧化鋁和碳酸鈉反應生成鋁酸鈉進入溶液,主要反應為
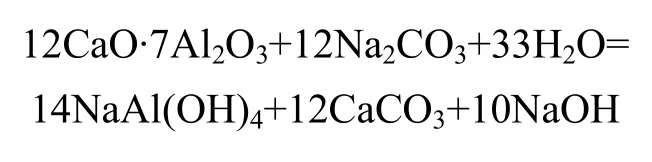
熟料在碳酸鈉溶液中的溶出屬液?固多相反應過程,提高溶出過程氧化鋁溶出率是保證從粉煤灰中提取氧化鋁回收率的關鍵。
2 試驗方法
2.1 試驗原料
溶出試驗所用原料為粉煤灰和石灰石燒結且粉化后的熟料。熟料燒成條件如下:生料配方CaO與Al2O3質量比為1.9,燒結溫度為1 360 ℃,保溫時間為60 min,出爐溫度為900 ℃,其化學成分如表1所示。用X線衍射法對熟料進行物相分析,結果表明熟料的主要成分為 12CaO·7Al2O3和γ-2CaO·SiO2及少量的β-2CaO·SiO2。

表1 熟料的化學成分(質量分數)Table 1 Chemical composition of sintered powder %
使用激光粒度儀器分析方法對熟料的粒度進行分析,表明熟料粒度為5~30 μm的質量分數達80.58% ,體積平均粒徑為11.197 μm。由于熟料粒度很小,故對熟料沒有進行分級處理,以混合料作為試驗原料。
2.2 試驗方法
熟料溶出過程動力學試驗在用電熱恒溫水浴加熱的三頸燒瓶內進行,用電動攪拌器進行攪拌。三頸瓶容量為 1 L,其瓶口裝有冷凝回流裝置,以防止試驗過程的水分蒸發。用水銀溫度計讀取溶液的真實溫度。
將配制好的 Na2CO3溶液放入三頸瓶中,在恒溫水浴中進行加熱并啟動攪拌。當瓶內溶液溫度達到試驗設定溫度并恒定后,將計量好的熟料迅速放入,同時計時。定時抽取液體并采用特定的方法迅速進行液固分離,然后分析溶液中的 Al2O3質量濃度,并計算Al2O3溶出率。
2.3 動力學試驗條件的確定
為了保證液固反應動力學所需要的條件,對實驗過程進行如下控制[12?13]。
2.3.1 溶出液的液固比和溶出劑質量濃度的確定
隨著溶出反應的進行,溶液中的碳酸鈉質量濃度不斷降低。采用碳酸鈉大量過剩的溶液體系,同時采用大的液固比,以保證反應過程中溶出劑質量濃度基本不變。
2.3.2 攪拌速度的確定
在液固反應的溶出過程中,可以通過加強機械攪拌來消除外擴散對溶出過程的限制作用。因此,進行攪拌速度對溶出率的影響試驗。在液固比為60,碳酸鈉的質量濃度為100 g/L,反應溫度為40 ℃,溶出時間為40 min的條件下改變攪拌強度(轉速),得到相應的氧化鋁溶出率和反應時間的關系,如圖1所示。
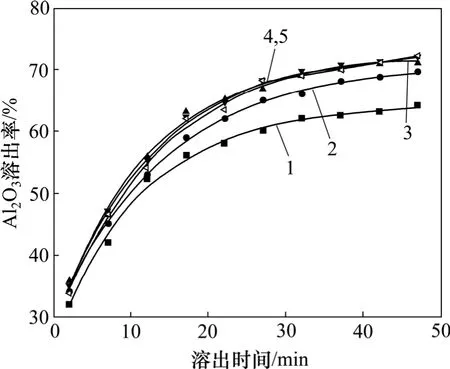
圖1 Al2O3溶出率與反應時間的關系Fig.1 Relationship between Al2O3 leaching ratio and reaction time
從圖1可以看出:當轉速達到500 r/min以上時,轉速對氧化鋁的溶出率影響已不明顯。因此,本試驗采用的轉速為500 r/min,在此轉速下足以消除外擴散對溶出過程的限制作用。
3 試驗結果和討論
3.1 溶出反應動力學曲線
在不同溫度下進行熟料中 Al2O3溶出率隨反應時間的變化試驗。
在液固比為60,碳酸鈉質量濃度為100 g/L,熟料為10 g,轉速為500 r/min的條件下,考察在溫度為7.5,11.0,16.0,21.0,30.0,35.0和40.0 ℃時,熟料中Al2O3溶出率(y)與反應時間(t)的關系,如圖2所示。
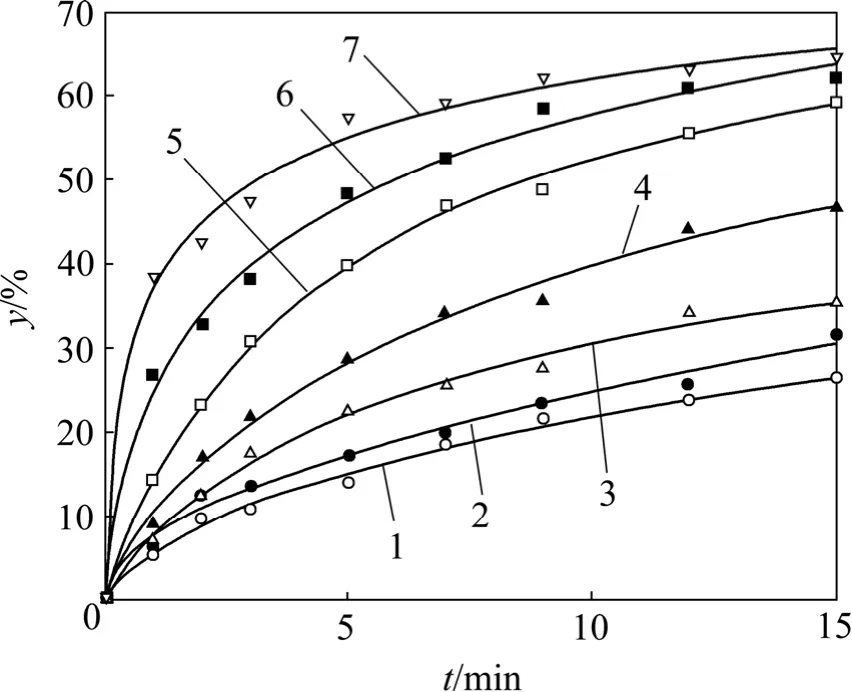
圖2 不同溫度下Al2O3溶出率與時間的關系Fig.2 Relationship between Al2O3 leaching ratio and reaction time at different temperatures
從圖2可以看出:Al2O3溶出率隨溫度的升高而增大,但在初始反應的初期增大較快;隨著時間的延長,Al2O3溶出率增大的趨勢減小。
由于本研究過程中熟料粒度分布范圍較大,難以按常規的反應核收縮模型處理數據,為此,借鑒Antonijevic等[14]在研究輝鉬礦浸出過程中使用的1個經驗動力學方程:
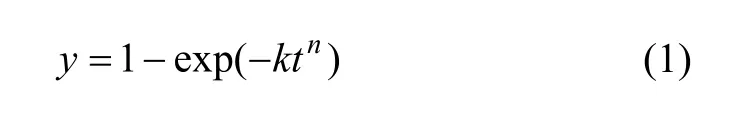
其中:y為溶出率;k和n為常數;t為浸出時間。式(1)可簡單變換為:ln(?ln(1?y))=lnk+nlnt,則可將圖 2中實驗結果處理作圖,如圖3所示。
從圖3可以看出:在7.5~40.0 ℃反應溫度范圍內,理論值與實驗值較吻合,說明所采用的模型可以很好地描述溶出過程。由圖3可以求出不同溫度下的lnk和n,如表2所示。
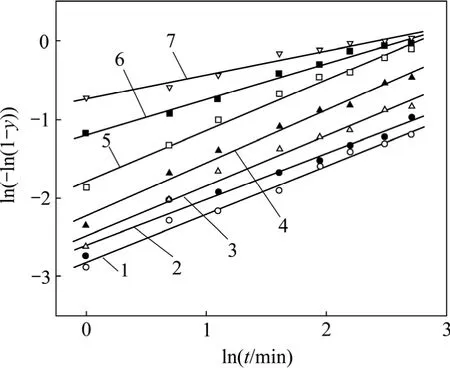
圖3 按式(1)擬合動力學方程的結果Fig.3 Fitted results of kinetics equation by Formula (1)
按阿倫尼烏斯公式,將lnk與1/T作圖得到圖4,由圖4可求出表觀反應活化能為47.0 kJ/mol,此值可以說明溶出過程為化學反應控制,其速度常數可表示為:
經過數學處理,n與溫度的關系可以用下式表示:
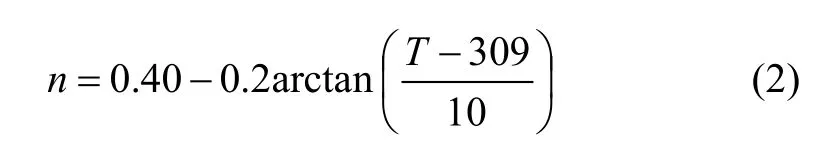
據式(2),n和溫度T的關系又可用圖5表示。與實驗結果進行對照,顯示出式(2)的計算值與實驗值較吻合。
3.2 溶出反應的表觀反應級數
在溶出溫度為40 ℃,熟料質量為1 0 g,液固比為60,轉速為500 r/min的條件下,考察在碳酸鈉質量濃度為40,50,60,80和100 g/L時Al2O3溶出率,如圖6所示。
同樣按式(1)對圖6進行處理,所得結果見圖7。
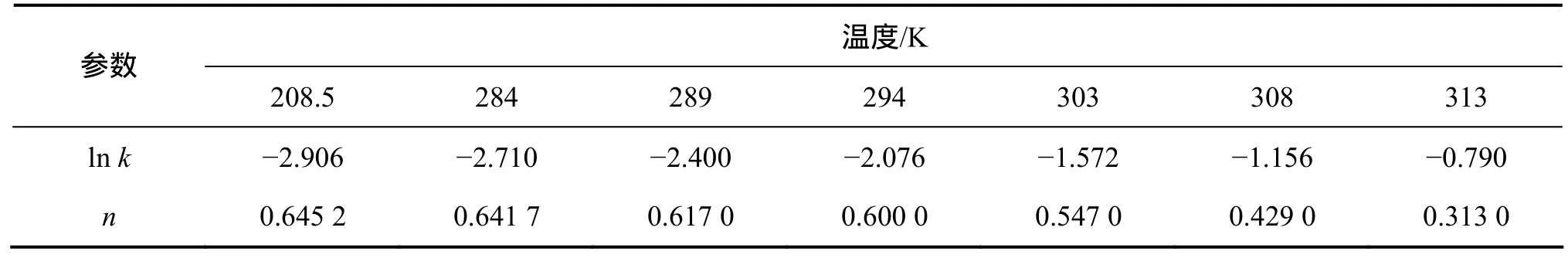
表2 不同溫度下的ln k和nTable 2 ln k and n at different temperatures
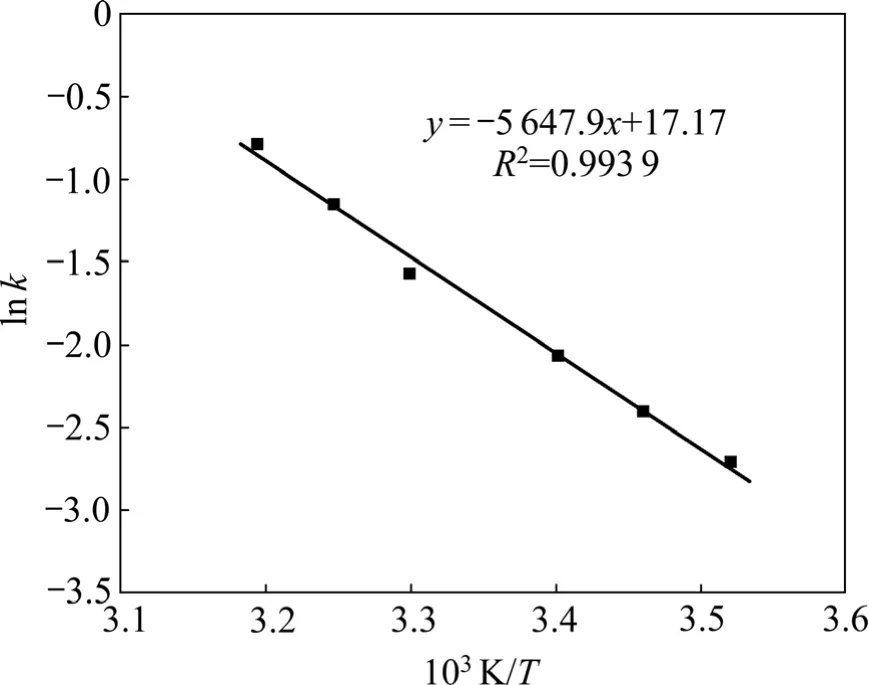
圖4 溶出過程的Arrhenius圖Fig.4 Arrhenius figure of leaching process
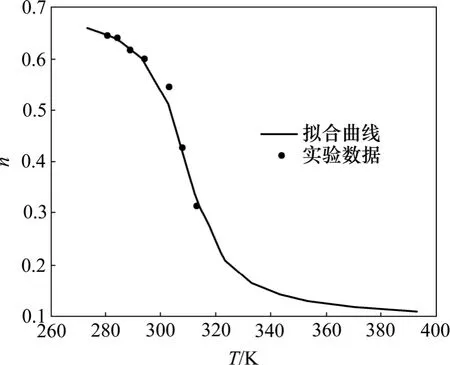
圖5 n對反應溫度T的關系Fig.5 Relationship between n and reaction temperature T
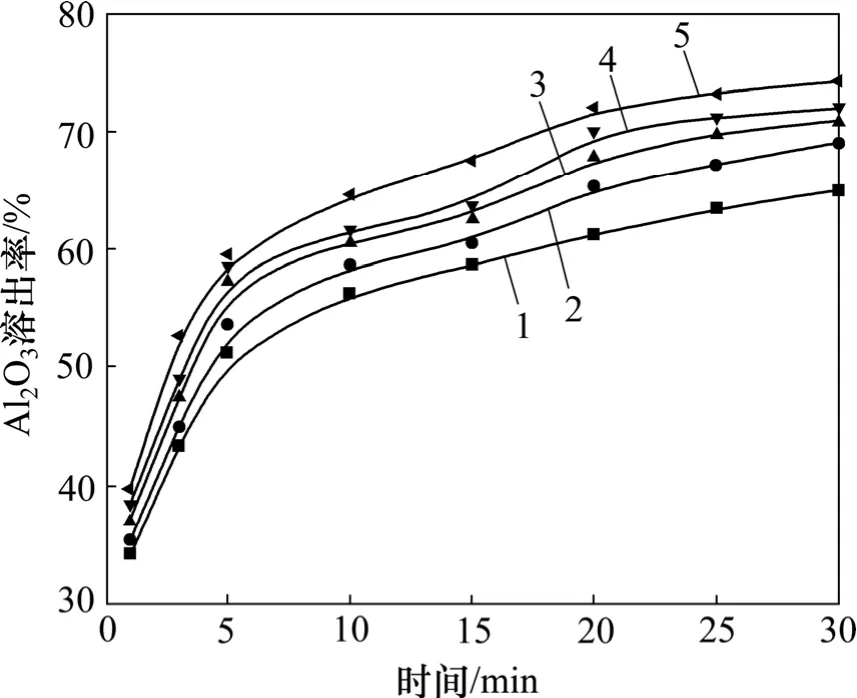
圖6 不同Na2CO3質量濃度下的Al2O3溶出率與反應時間的關系Fig.6 Relationship between Al2O3 leaching ratio and reaction time at different Na2CO3 mass concentrations

圖7 按式(1)擬合的不同Na2CO3質量濃度下動力學方程的結果Fig.7 Fitted results of kinetics equation by Formula(1) at different Na2CO3 mass concentrations
通過圖 7可以得到不同 Na2CO3質量濃度下的lnk,再用lnk對lnρ作圖得到圖8。
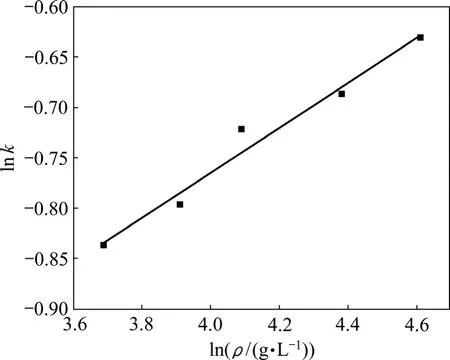
圖8 ln k對ln ρ關系圖Fig.8 Relationship between of ln k and ln ρ
通過擬合圖8計算出其斜率為0.224,即反應級數為0.224。
由于速率常數是在碳酸鈉質量濃度為100 g/L的條件下得到的,進一步綜合反應級數因素,可以得到:
3.3 溶出過程動力學方程
根據上述研究得到的速度常數k與反應溫度T,以及k與反應質量濃度ρ的關系可以導出整個熟料溶出過程的反應動力學方程為
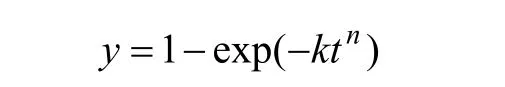
4 結論
(1) 對粉煤灰和石灰石的燒成熟料在碳酸鈉溶液中溶出過程的動力學進行了研究。根據不同溫度和不同碳酸鈉質量濃度下 Al2O3溶出率和反應時間的關系,計算了反應的表觀活化能和反應級數。
(2) 在7.5~40.0 ℃范圍內,反應表觀活化能為47.0 kJ/mol,符合化學反應控制的動力學特征;反應級數n=0.224。
(3) 通過對動力學數據的處理,得到溶出過程的動力學方程為:其中:
[1] 周金華. 粉煤灰制備氧化鋁的研究進展[J]. 遼寧化工, 2009,38(2): 116?118.ZHOU Jinhua. Research progress in preparation of alumina with fly ash[J]. Liaoning Chemical Industry, 2009, 38(2): 116?118.
[2] 蔣家超, 趙由才. 粉煤灰提鋁技術的研究現狀[J]. 有色冶金設計與研究, 2008, 29(2): 40?43.JIANG Jiachao, ZHAO Youcai. Current research situation of al extraction from fly ash[J]. Nonferrous Metals Engineering &Research, 2008, 29(2): 40?43.
[3] 童軍武, 孫培梅, 徐紅艷. 粉煤灰中有價元素的提取[J]. 湖南有色金屬, 2006, 22(5): 46?50.TONG Junwu, SUN Peimei, XU Hongyan. Extracting valuable elements from coal fly ash[J]. Hunan Nonferrous Metals, 2006,22(5): 46?50.
[4] Matjie R H, Bunt J R, Van Heerden J H P. Extraction of alumina from coal fly ash generated from a selected low rank bituminous South African coal[J]. Minerals Engineering, 2005, 18(3):299?310.
[5] 李來時, 翟玉春, 吳艷, 等. 硫酸浸取法提取粉煤灰中氧化鋁[J]. 輕金屬, 2006(12): 9?12.LI Laishi, ZHAI Yuchun, WU Yan, et al. Extracting alumina from fly ash by sulfuric acid[J]. Light Medals, 2006(12): 9?12.
[6] 唐云, 陳福林. 堿石灰燒結法提取粉煤灰中的氧化鋁[J]. 礦冶工程, 2008, 28(6): 73?75.TANG Yun, CHEN Fulin. Extracting alumina from fly ash by soda lime sintering method[J]. Mining and Metallurgical Engineering, 2008, 28(6): 73?75.
[7] 楊石波, 王際東, 屈一新, 等. 燒結法提取高鋁粉煤灰中氧化鋁的實驗研究[J]. 無機鹽工業, 2008, 40(7): 47?49, 57.YANG Shibo, WANG Jidong, QU Yixin, et al. Experimental study on extraction of alumina from high-aluminum fly ash by sintering method[J]. Inorganic Chemicals Industry, 2008, 40(7):47?49, 57.
[8] 孫培梅, 李廣民, 童軍武, 等. 從電廠粉煤灰中提取氧化鋁物料燒結過程工藝研究[J]. 煤炭學報, 2007, 32(7): 744?747.SUN Peimei, LI Guangmin, TONG Junwu, et al. Study on sintering process of raw materials in extracting alumina from fly ash of coal industry power plate[J]. Journal of China Coal Society, 2007, 32(7): 744?747.
[9] 孫培梅, 童軍武, 徐紅艷, 等. 從粉煤灰中提取氧化鋁熟料溶出過程工藝研究[J]. 中南大學學報: 自然科學版, 2010, 41(5):1698?1702.SUN Peimei, TONG Junwu, XU Hongyan, et al. Study on leaching process of sintered powder in extracting alumina from fly ash[J]. Journal of Central South University: Science and Technology, 2010, 41(5): 1698?1702.
[10] 李小斌, 周秋生, 彭志宏, 等. 活化焙燒一水硬鋁石礦增濃溶出過程動力學[J]. 中南工業大學學報: 自然科學版, 2000,31(3): 219?221.LI Xiaobin, ZHOU Qiusheng, PENG Zhihong,et al. Study on the kinetics of digesting roasted diaspore in the sweetening process[J]. Journal of Central South University of Technology:Natural Science, 2000, 31(3): 219?221.
[11] 佟志芳, 畢詩文, 于海燕, 等. 微波作用下鋁酸鈣爐渣非等溫浸出動力學[J]. 中國有色金屬學報, 2006, 16(2): 357?362.TONG Zhifang, BI Shiwen, YU Haiyan, et al. Leaching kinetics of non-constant temperature process of calcium aluminate slag under microwave radiation[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(2): 357?362.
[12] 華一新. 冶金過程動力學導論[M]. 北京: 冶金工業出版社,2004: 188?231.HUA Yixin. Kinetics introduction of metallurgical process[M].Beijing: Metallurgical Industry Press, 2004: 188?231.
[13] 李洪桂. 濕法冶金學[M]. 長沙: 中南大學出版社, 2002:69?120.LI Honggui. Hydrometallurgy[M]. Changsha: Central South University Press, 2002: 69?120.
[14] Antonijevic M M, Pacovic N V. Investigation of molybdenite oxidation by sodium dichromate[J]. Minerals Engineering, 1992,5(2): 223?233.

