金屬及金屬氧化物納米材料的放射性標記
芮玉奎,張艷北,桂 新,金婷婷,張智勇
(1. 中國農業大學 資源與環境學院,北京 100193;2. 中國科學院 高能物理研究所 核分析技術重點實驗室 納米生物效應與安全性重點實驗室,北京 100049)
納米材料指在三維空間中至少有一維處于納米尺度范圍或由它們作為基本單元構成的材料。與常規材料相比,納米材料表現出一些獨特的物理化學特性,如小尺寸效應、量子效應、巨大比表面積、高反應活性等。這些性質使得納米材料在進入生命體后與生命體相互作用所產生的生物效應與化學成分相同的常規物質有很大不同。另一方面,生命體中的化學或物理過程是生命活動的基礎,細胞內外通過弱相互作用進行的高效、高選擇性、低能耗的生物分子組裝通常都是在納米水平進行的。因此,納米水平的物質與生物體系相互作用成為近年來學術界關注的主要問題之一[1]。一批與之相關的新分支學科,如納米生物學、納米醫學、納米毒理學等迅速發展,如何對生物體內的納米材料實現定量檢測是目前面臨的共同難題。根據納米材料的化學成分、熒光、磁學等特性,已發展出一系列分析方法。對含金屬的納米顆粒可以用電感耦合等離子體質譜、原子吸收等無機元素分析方法測定樣品中特定金屬元素含量,然而如果這種元素的生物本底值較高,無疑將對分析結果造成干擾[2]。磁性納米顆粒(如納米氧化鐵)或熒光納米顆粒(如量子點)可以利用其磁性或熒光性質進行檢測。放射性同位素示蹤技術是以放射性同位素為示蹤劑,根據示蹤劑運動和變化來追蹤原來不易或不能辨認的運動和變化規律。這種方法具有靈敏度高、測量簡便,干擾少的特點,結合各種核成像技術,可分析物質在生物體內二維或三維空間實時分布的信息。與其他分析方法相比,放射性同位素示蹤技術具有不可替代的優勢,被認為是研究納米材料在生物體內吸收、分布、代謝和排泄以及環境行為的最佳方法[3]。穩定同位素示蹤技術亦可用于相關研究,Gulson等[4]對穩定同位素示蹤在納米安全性研究中的應用進行了展望,目前,應用于實際研究的僅有13C標記的碳納米管[5]和68Zn標記的納米氧化鋅[6],遠不及放射性同位素示蹤技術應用廣泛。
采用放射性同位素示蹤技術首先就要選擇合適的放射性核素,對研究對象實現放射性標記。碳納米材料和一些醫用高分子納米材料的放射性標記研究較多,而針對目前應用最為廣泛的金屬納米材料的放射性標記方法報道較少。本文綜述了金、銀、磁性氧化鐵、二氧化鈦、二氧化鈰、氧化鋅6種重要的金屬和金屬氧化物納米材料的放射性標記方法。其中,納米銀、納米二氧化鈦、納米二氧化鈰和納米氧化鋅是國際經濟與合作組織推薦需要對其環境健康效應進行重點研究的納米材料[7],而納米金和納米氧化鐵具有重要的生物醫學應用前景。
1 納米金的放射性標記
納米金因其良好的催化活性與光學特性被廣泛用于納米器件制造、納米生物技術、納米生物醫學、納米藥理學等領域[8]。金的放射性同位素198Au是β衰變核素,發射β和γ射線。主要γ射線能量為0.411 8 MeV,半衰期為2.695 d,適合于放射性示蹤實驗。此外,還可利用β射線(βmax=0.96 MeV)進行腫瘤治療。198Au可利用以下核反應制備:①197Au(n,γ)198Au、②198Pt(p,n)198Au、③197Au(d,p)198Au和④198Hg(n,p)198Au等。核反應①和③可以得到無載體的198Au,但制備大量198Au時,核反應①最有實用意義。需要注意的是,生成核198Au的熱中子吸收截面非常大,通過198Au(n,γ)199Au反應生成199Au。如果輻照條件選擇不好,不僅放射性雜質199Au會增長很快,而且還影響了198Au的增長速率。為獲得符合質量要求的198Au,常采用高中子注量率、短時間照射的方法把199Au的量限制在10%以下[9]。
Roy等[10]以H198AuCl4為原料,發展了一種直接合成放射性納米金顆粒的方法。放射性的198Au(III)在不加入任何萃取劑的情況下被PEG相定量萃取,用硫代硫酸鈉還原Au(III)為Au(0),得到放射性納米金顆粒。Jung等[11]將core-shell Au@SiO2NPs 置于反應堆中照射,得到198Au@SiO2納米顆粒。為確定Au@SiO2納米顆粒在強γ場中能否保持完整,作者用透射電鏡觀察了照射前后納米顆粒的外貌,未發現明顯變化。另有學者采用類似的方法還制備了各種放射性的功能化金納米顆粒,如PEG修飾的納米金[12]、用于腫瘤近距離治療的{198Au(0)}放射性復合納米器件[13]和阿拉伯膠糖蛋白修飾的納米金[14]。
125I是用途極為廣泛的一種放射性核素,發射的γ射線能量為0.03 548 MeV,半衰期60.14 d。如以放射性示蹤實驗為目的,與198Au相比,125I更易獲取,半衰期也更合適。Smith等[15]研究發現,金納米顆粒表面對碘離子有很強的親和力,據此發展了一種更為簡便的標記方法—室溫下將125I-NaI與金納米顆粒在去離子水中混合5 min,然后離心分離,即得到穩定的125I標記物,而且,納米顆粒表面用PEG修飾與否對反應無影響。Shao等[16]利用γ相機成像得到了靜脈注射后經PEG 5000修飾和未經PEG 5000修飾的125I標記納米金在SD大鼠體內的二維分布,結果示于圖1。從圖1可以看出,未修飾的納米金在5 min內即在肝、脾處富集,隨著時間的延長,這種蓄積更加明顯。而PEG修飾的納米金在血池中停留時間較長,在肝、脾中的含量較低。
納米金具有獨特的光學特性,采用放射性同位素標記以后,還能夠同時實現體內光聲成像和核成像的雙模態造影[17]。Xie等[18]將合成的雙功能聯接劑OPSS-PEG-DOTA與納米金耦合,再與64CuCl2反應,得到了64Cu標記的納米金。將標記物注射到荷瘤裸鼠體內,PET成像的結果表明,20 h后64Cu蓄積于腫瘤部位。
2 納米銀的放射性標記
納米銀具有獨特的電學、光學、機械和催化特性,并且具有良好的抗菌性,廣泛用于醫用材料、化工催化劑、陶瓷材料、污水處理、建筑材料、光吸收材料、涂料、傳感器、高性能電極材料等方面[19]。110Agm的衰變方式為β衰變,半衰期249.78 d,主要γ射線能量為0.65 776 MeV,通過109Ag(n, γ)110Agm反應制備,適合于放射性示蹤實驗。
Zuykov等[20]以110AgmNO3為原料,采用常規納米銀的合成方法(AgNO3與聚烯丙基胺回流,離心沉淀分離)制備了粒徑為20~35 nm的納米銀。隨后,以此為示蹤劑,比較了銀離子和納米銀在軟體動物紫貽貝體內的分布,結果示于圖2。圖2結果顯示,盡管銀離子和納米銀的化學形態不同,但在紫貽貝軟組織中的分布和向外套膜液的輸運行為極為相近。
Zhao等[21]建立了更為簡單的標記方法,將溶于0.1% HNO3的110AgmNO3加入納米銀懸浮液中,放射性銀離子吸附在納米銀顆粒表面,形成標記物。納米銀懸浮液濃度較高時(5 000 μg/L),標記率達99.1%;懸浮液濃度較低時(250 μg/L),標記率僅53.2%。導致標記率出現明顯差異的原因可能在于濃度高時納米顆粒與銀離子的作用幾率較高。
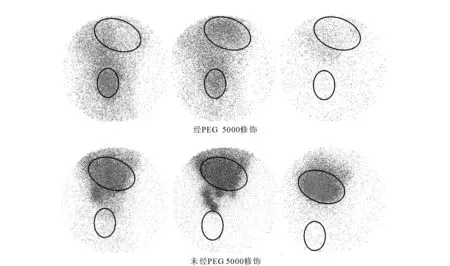
圖1 經PEG5000修飾和未經修飾的125I標記納米金在SD大鼠體內的二維分布[16]Fig.1 Two-dimensional distribution of 125I labeled PEGylated GNRs (upper) and bare GNRs (lower) in SD rats
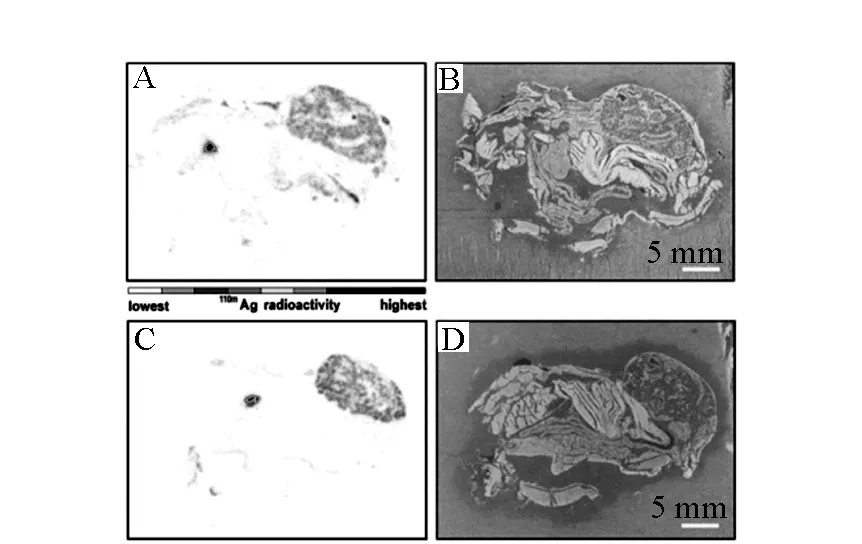
A,B——銀離子;C,D——鈉米銀圖2 紫貽貝攝取銀離子和納米銀后的全身放射性自顯影和光學照片[20]Fig.2 Whole-body autoradiography and optical images of Mytilus edulis after uptake experiment with free-ionic silver (A, B) and silver nanoparticles (C, D)
3 納米氧化鐵的放射性標記
納米氧化鐵(包括α- Fe2O3、γ- Fe2O3和Fe3O4等)具有良好的耐候性、耐光性、紫外線吸收和屏蔽效應以及奇特的磁性、催化性質和吸波性能,應用范圍除傳統的建筑、涂料、橡膠、陶瓷等領域外,在生物醫學、電子信息材料、軍事、環境保護等方面具有良好的應用前景[22]。具有超順磁特性的γ-Fe2O3和Fe3O4不僅可用作臨床磁共振成像對比劑,還可利用外加磁場將載藥系統靶向到達病灶部位,或實時追蹤粒子的生物分布。
常用于放射性示蹤實驗的鐵同位素為59Fe,β衰變,半衰期44.495 d,主要γ射線能量為1 099.245 keV和1 291.590 keV。早在2001年,范我等[23-24]就報道了磁性納米氧化鐵的制備方法:將59FeCl3溶液與FeCl3溶液混合,以n(FeCl3)∶n(FeCl2) = 2∶1的比例加入FeCl2溶液,滴加氨水,得到磁性氧化鐵。再用葡聚糖包埋得到均勻的磁性氧化鐵懸液(59Fe-SUMR),顆粒度小于20 nm,經穆斯波爾譜測定磁性氧化鐵的成份為Fe3O4。在59Fe-Fe3O4懸浮液中通入氧氣,即可得到59Fe標記的紅褐色的磁性γ-Fe2O3[25]。
多模態造影劑因能實現多種顯像模式優勢互補而備受關注[26],采用99Tcm、64Cu、18F等放射性同位素標記超順磁氧化鐵納米顆粒(Superparamagnetic Iron Oxide Nanoparticles,SPION),可以同時獲取標記物在生物體內核磁共振和核素成像的信息。而采用188Re等治療核素標記SPION,可利用外加磁場將藥物靶向到達病灶部位,實現放射性核素治療。Fu等[27]建立了99Tcm直接標記Fe3O4納米顆粒的方法。將99Tcm(Ⅶ)用氯化亞錫還原為99Tcm(Ⅴ),然后與新制備納米Fe3O4懸浮液混合,得到標記物。標記率大于99%,標記完成后前50 min內脫落小于5%,99Tcm與Fe3O4之間的作用應為物理吸附。而Lee[28]等則以二乙烯三胺五乙酸為聯接劑,用99Tcm間接標記了12 nm的SPION。采用正電子核素64Cu標記SPION時要用1,4,7,10-四氮雜環十二烷基-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclo-dodecane-1,4,7,10-tetraacetic acid,DOTA)螯合Cu2+,步驟較為繁瑣[29-30]。Wong等[31]建立了一種新穎、快速、基于微波爐合成技術,一步制備葡聚糖包被的摻Cu氧化鐵納米顆粒的方法。微波輔助合成能夠顯著縮短合成時間,降低放射性損耗,合成產物中放射性標記原子64Cu作為SPION完整結構的一部分,可能比表面螯合的64Cu具有更好的體內穩定性。而且,顆粒崩解時游離銅的釋放也比失去螯合銅更易分辨,因為這時會失去磁共振成像的信號。
18F是一種廣泛用于PET顯像的正電子核素,18F相對于64Cu有更高的靈敏度、更短的半衰期以及不可逆的共價結合能力,而且生產容易,更易獲得[32-33]。將18F引入功能化的復雜分子是核醫學領域的難題,已報道的多數方法需要苛刻的反應條件、很長的反應時間、復雜的合成步驟,而所得產物的產率很低。Devaraj等[33]采用了“點擊化學”(click chemistry)方法,可方便地將功能基團與復雜分子或生物分子結合。通過該方法得到了18F標記的交聯葡聚糖氧化鐵納米顆粒,該化合物可用于PET、熒光分子X線斷層攝影術和磁共振成像檢測。
治療核素188Re標記的SPION亦有報道,如Sun等[34]制備了188Re標記的甲氧基聚(乙烯基乙二醇)修飾的超順磁納米凝膠,Liang等[35]通過188Re直接標記連接在SPION上的抗人肝癌單克隆抗體Hepama-1,標記物有望用于磁靶向治療。
4 納米二氧化鈦的放射性標記
納米二氧化鈦因具有良好的光學催化特性、耐化學腐蝕性和熱穩定性等,在涂料、橡膠、化妝品、服裝、食品添加劑、抗菌防菌和廢水處理等領域的應用日益擴大[36]。鈦本身沒有適合于示蹤實驗的放射性同位素,只能采用其他核素標記。黃旋等[37]用鈦酸四正丁酯水解法制備了納米TiO2溶膠,通過光化學沉積得到110mAg/TiO2復合納米微粒。Ag與納米TiO2微粒的結合并不是簡單的物理吸附,Ag以微晶的形式沉積在納米TiO2表面,結合力很強,因此標記物有較好的穩定性。
Abbas等[38]用回旋加速器產生的質子轟擊納米二氧化鈦,利用(p,n)反應,部分48Ti生成了放射性的48 V(電子俘獲和β+衰變,T1/2=15.97 d),實現了納米二氧化鈦的放射性標記。離心實驗表明,在水中,48 V與納米顆粒結構結合穩定,X射線衍射未發現質子轟擊對納米顆粒的結構造成顯著改變。
5 納米二氧化鈰的放射性標記
納米二氧化鈰在功能陶瓷、催化劑、玻璃拋光劑、發光材料、氣體傳感器、燃料電池和紫外吸收劑等方面應用廣泛[39]。由于其在生物和環境條件下穩定存在、形貌多變、具有氧化還原活性等特性,常被用做研究氧化物納米材料生物、環境行為的模型化合物。Oughton等[40]將納米CeO2放入反應堆照射,利用(n, γ)反應得到放射性的141CeO2。Gibson等[41]和Simonelli等[42]則采用回旋加速器產生的氘核轟擊穩定的納米二氧化鈰,放射性產物包括139Ceg(電子俘獲衰變,T1/2=137.6 d)、141Ce(β衰變,T1/2=32.501 d)、143Ce(β衰變,T1/2=33.039 h)和140La(β衰變,T1/2=1.678 d),它們是來自多個氘核引發的核反應。其中141Ce最適合于放射性示蹤實驗。為優化141Ce的產率,經過計算,他們將氘核束流初始能量設計為19.5 MeV,在納米二氧化鈰上的能量為11.25 MeV,束流強度2 mA,轟擊5 h,預計141Ce的活度為1 MBq。冷卻一周后,短半衰期的140La和143Ce接近衰變完全,產品的放射性除少量139Ce外,主要為141Ce。照射前后納米二氧化鈰的粒徑分布和Zeta電位不變,Gibson等推測制備過程沒有引起納米顆粒物理化學特性的變化。
本實驗室以商品化的二氧化鈰為原料,在反應堆中照射,所得樣品用硝酸和過氧化氫在一定條件下溶解,得到141Ce(NO3)3。將141Ce(NO3)3溶液與六次甲基四胺溶液混合加熱3 h,即得到放射性的141CeO2納米顆粒。改變六次甲基四胺溶液的濃度可以控制納米二氧化鈰的粒徑,濃度越高粒徑越小。在此基礎上,制備了粒徑分別為7 nm和25 nm的放射性141CeO2納米顆粒,并開展了其在模擬水生態系統中的分布和歸趨、植物中的分布、呼吸暴露后在大鼠體內的分布、代謝和排泄等系列研究工作[43-46]。結果顯示,納米二氧化鈰進入模擬水生態系統后,快速從水體清除,底泥是主要沉積場所。水生生物對納米二氧化鈰的吸收和清除表現出不同的特性,金魚藻能大量富集納米二氧化鈰,清除緩慢。而麥穗魚和螺螄都是快速吸收,然后隨著水體納米二氧化鈰濃度的降低快速清除,沒有明顯的富集效應。納米二氧化鈰能夠被植物的根吸收并運輸到地上部位,圖3是在營養液中加入放射性納米二氧化鈰14 d后,黃瓜葉片放射性自顯影的結果。從圖3可以看到,從嫩葉到老葉,納米二氧化鈰有明顯的積累效應,而且二氧化鈰主要積累在葉緣,葉脈和葉柄中含量最低。葉脈和葉柄中有運輸礦質營養和水分的維管束,而葉緣正是維管組織的終點。為此,可以推測進入中柱導管后,納米二氧化鈰可以無阻礙地隨水流快速運輸,直至導管的頂端。

圖3 黃瓜植株在含有20 mg/L納米二氧化鈰的營養液中培養14 d后納米二氧化鈰在葉片中的分布Fi.g 3 Distribution of ceria nanoparticles in cucumber leaves after treatment with 20 mg/L ceria nanoparticle suspensions for 14 d
動物實驗結果顯示,納米二氧化鈰經氣管滴注進入大鼠體內后,在肺中長時間沉積,一小部分通過氣血屏障進入血液循環并在肝、脾等臟器積累,最終通過糞便排泄。
6 納米氧化鋅的放射性標記
納米氧化鋅廣泛應用于橡膠、電纜、化肥、陶瓷、涂料、紡織、食品、醫藥等行業。65Zn為電子俘獲和β+衰變,T1/2=244.06 d,主要γ射線能量為1.115 539 MeV。Chen等[47-48]將粒徑范圍為40~100 nm的氧化鋅置于反應堆中照射,通過64Zn(n, γ)65Zn得到放射性納米二氧化鈰。在反應堆中,由于中子轟擊和強g場誘導的分解作用以及靶核被中子活化后可能的反沖效應都會導致樣品分解或化學完整性發生變化。為檢驗這種可能性,Chen等采用了兩種方法。一是將制備的放射性納米氧化鋅的懸浮液高速離心,上清液中的放射性占總放射性活度的百分比<1.7%;二是將放射性納米氧化鋅的懸浮液置于截留相對分子質量為20 000的透析膜中透析,透析液中的放射性占總放射性活度的百分比<0.03%。這可能是中子轟擊未對納米氧化鋅的結構造成影響。
放射性的納米氧化鋅可以由65ZnCl2為原料直接合成。將65ZnCl2溶液與NaOH溶液混合,加入乙醇,超聲振蕩后攪拌過夜,即得到放射性標記的ZnO納米晶。
7 討 論
制備放射性標記的金屬和金屬氧化物納米材料的方法歸納起來主要有4種。
1)采用反應堆中子或加速器產生的帶電粒子直接活化穩定的納米材料。該方法可以直接用來做示蹤實驗,操作人員接觸的放射性劑量較小。然而,中子或帶電粒子轟擊過程中由于靶材料過熱、輻照損傷以及熱原子反沖造成的化學鍵斷裂有可能導致納米材料部分特性的不可逆改變。采用這種標記方法時,實驗者需要提供標記前后納米材料主要物理化學特性未發生變化的證據。
2)將放射性同位素摻入納米材料的合成原料直接合成。以這種方法制備的放射性標記納米材料與穩定的納米材料相比除具有放射性外其他物理、化學性質幾乎相同,缺點是在合成過程中,操作人員接觸的放射性劑量較大。
3)將納米顆粒化學修飾后標記。此方法常用于診斷及治療用納米藥物的標記,采用的放射性核素包括99Tcm、18F、64Cu等,可用于SPECT或PET成像,但標記過程往往很復雜。如果用于常規的納米毒理學研究,需要考慮到化學修飾對納米顆粒自身特性尤其是表面性質的影響,這將會大大影響納米顆粒在生物體內的行為。
4)物理吸附。依靠納米材料的強吸附能力,將溶液中的放射性離子或膠體吸附于表面形成標記物。這種方法操作十分簡單,但在體內復雜環境下標記的放射性核素可能出現脫落,因此,對標記物的穩定性需要進一步驗證。
放射性同位素示蹤是研究納米材料的生物效應、環境行為不可或缺的技術手段,但目前實現放射性標記的納米材料種類十分有限。相關學科的發展需要放射化學工作者建立更多、更簡便的納米材料放射性標記方法。
參考文獻:
[1] 白雪瑞, 熊國祥. 香山科學會議第396~400次學術討論會簡述[J]. 中國基礎科學, 2011, 25-31.
Bai Xuerui, Xiong Guoxiang. Brief introduction to Xiangshan Science Conferences of Nos.396-400 [J]. China Basic Science. 2011, 25-31(in Chinese).
[2] 張智勇. 納米毒理學與安全性研究方法[M]. 北京: 科學出版社, 2010: 66-75.
[3] Zhang ZY, Zhao YL, Chai ZF. Applications of radiotracer techniques for the pharmacology and toxicology studies of nanomaterials[J]. Chinese Science Bulletin, 2009, 54: 173-182.
[4] Gulson B, Wong H. Stable isotopic tracing: A way forward for nanotechnology[J]. Environmental Health Perspectives, 2006, 114(10): 1 486-1 488.
[5] Yang ST, Guo W, Lin Y, et al. Biodistribution of pristine single-walled carbon nanotubes in vivo[J]. Journal of Physical Chemistry C, 2007, 111(48): 17 761-17 764.
[6] Larner F, Rehk?mper M. Evaluation of stable isotope tracing for ZnO nanomaterials: New constraints from high precision isotope analyses and modeling[J]. Environmental Science and Technology, 2012, 46(7): 4 149-4 158.
[7] Kearns P, Gonzalez M, Oki N, et al. OECD work on the safety of manufactured nanomaterials[R/OL]. Paris: Environment Directorate OECD, [2008-10-08]. http://www.oecd.org/ dataoecd/54/27/41567645.ppt.
[8] 孔猛, 曾常春, 熊紅蓮, 等.納米金粒子對裸鼠胃癌組織近紅外光譜范圍的組織光學特性影響[J]. 光學學報, 2011, 31(3): 0317004.
Kong M, Zeng CC, Xiong HL, et al. Effect of gold nanoparticles on tissue optical properties of gastric tumor tissue in near-infrared spectral in nude mice [J]. Acta Optica Sinica, 2011, 31(3): 0317004(in Chinese).
[9] Akaboshi M, Alberto R, Ananthakrishnan M, et al. Manual for reactor produced radioisotopes[M]. Vienna: IAEA, 2003: 63-70.
[10] Roy K, Lahiri S. A green method for synthesis of radioactive gold nanoparticles[J]. Green Chemistry, 2006, 8: 1 063-1 066.
[11] Jung SH, Kim KI, Ryu JH, et al. Preparation of radioactive core-shell type198Au@SiO2nanoparticles as a radiotracer for industrial process applications[J]. Applied Radiation and Isotopes, 2010, 68: 1 025-1 029.
[12] Lipka J, Semmler-Behnke M, Sperling RA, et al. Biodistribution of PEG-modified gold nanoparticles following intratracheal instillation and intravenous injection[J]. Biomaterials, 2010, 31: 6 574-6 581.
[13] Khan MK, Minc LD, Nigavekar SS, et al. Fabrication of {198Au0} radioactive composite nanodevices and their use for nanobrachytherapy [J]. Nanomedicine: NBM, 2008, 4: 57-69.
[14] Chanda N, Kan P, Watkinson LD, et al. Radioactive gold nanoparticles in cancer therapy: therapeutic efficacy studies of GA-198AuNP nanoconstruct in prostate tumor-bearing mice[J]. Nanomedicine: NBM, 2010, 6: 201-209.
[15] Smith DK, Miller NR, Korgel BA. Iodide in CTAB prevents gold nanorod formation[J]. Langmuir, 2009, 25 (16): 9 518-9 524.
[16] Shao X, Agarwal A, Rajian JR, et al. Synthesis and bioevaluation of125I-labeled gold nanorods[J]. Nanotechnology, 2011, 22: 135102.
[17] Shao X, Zhang HN, Rajian JR, et al.125I-labeled gold nanorods for targeted imaging of inflammation[J]. ACS Nano, 2011, 5(11): 8 967-8 973.
[18] Xie H, Wang ZJ, Bao A, et al. In vivo PET imaging and biodistribution of radiolabeled gold nanoshells in rats with tumor xenografts[J]. International Journal of Pharmaceutics, 2010, 395: 324-330.
[19] 劉春華, 李春麗. 納米銀粒子的制備方法進展[J]. 化學研究與應用, 2010, 22(6): 670-673.
Liu Chunhua, LI Chunli. Research progress of the silver nanoparticles preparation methods [J]. Chemical Research and application, 2010, 22(6): 670-673(in Chinese).
[20] Zuykov M, Pelletier E, Demers S. Colloidal complexed silver and silver nanoparticles in extrapallial fluid of Mytilus edulis[J]. Marine Environmental Research, 2011, 71: 17-21.
[21] Zhao CM, Wang WX. Biokinetic uptake and efflux of silver nanoparticles in Daphnia magna[J]. Environmental Science and Technology, 2010, 44(19): 7 699-7 704.
[22] 樊亮, 彭同江, 孫紅娟, 等. 氧化鐵-云母納米薄膜材料的制備研究[J]. 中國礦業, 2005, 14(1): 84-87.
Fan L, Peng TJ, Sun HJ, et al. Preparation on iron oxide micro- nano- membrane materials [J]. China Mining Magazine, 2005, 14(1): 84-87(in Chinese).
[23] 范我, 楊凱, 錢建華, 等.59Fe示蹤法測定納米級磁性氧化鐵在小鼠體內的分布[J]. 同位素, 2001, 14(1): 31-35.
Fan Wo, Yang Kai, Qian Jianghua, et al. Determining the distribution of nano-particles magnetic iron oxide in mice by 59Fe tracer [J]. Journal of isotopes, 2001, 14(1): 31-35(in Chinese).
[24] 范我, 胡明江, 寧萍, 等. 納米磁性氧化鐵溶液的顆粒度測定[J]. 同位素, 2004, 17(4): 228-231.
Fan Wo, Hu Mingjiang, Ning Ping, et al. Determination of particle size of magnetic iron oxide solution [J]. Journal of isotopes, 2004, 17(4): 228-231(in Chinese).
[25] 尹其華, 劉璐, 顧寧, 等.59Fe示蹤谷氨酸包被三氧化二鐵納米顆粒的制備及其在小鼠體內的生物學分布[J]. 醫學研究生學報, 2005, 18(4): 312-317.
Yin Qihua, Liu Lu, Gu Ning, et al. Determing the biodistr ibution of nano-Fe2O3-Glu in mice by 59 Fe tracer and preparation [J]. Journal of Medical Postgraduates, 2005, 18(4): 312-317(in Chinese).
[26] 賈紅梅, 劉伯里. 中國放射性藥物的現狀與展望[J]. 同位素, 2011, 24(3): 129-139.
Jia Hongmei, Liu Boli. Current status and prospects of radiopharmaceuticals in China [J]. Journal of isotopes, 2011, 24(3): 129-139(in Chinese).
[27] Fu CM, Wang YF, Chao YC, et al. Directly labeling ferrite nanoparticles with Tc-99m radioisotope for diagnostic applications[J]. IEEE Transaction on Magnetics, 2004, 40(4): 3 003-3 005.
[28] Lee CM, Jeong HJ, Kim EM, et al. Superparamagnetic iron oxide nanoparticles as a dual imaging probe for targeting hepatocytes in vivo[J]. Magnetic Resonance in Medicine, 2009, 62: 1 440-1 446.
[29] Jarrett BR, Gustafsson B, Kukis DL. Synthesis of64Cu-labeled magnetic nanoparticles for multimodal imaging[J]. Bioconjugate Chemistry, 2008, 19, 1 496-1 504.
[30] Xie J, Chen K, Huang J, et al. PET/NIRF/MRI triple functional iron oxide nanoparticles[J]. Biomaterials, 2010, 31: 3 016-3 022.
[31] Wong RW, Gilbert DA, Liu K, et al. Rapid size-controlled synthesis of dextran-coated,64Cu-doped iron oxide nanoparticles[J]. ACS Nano, 2010, 6(4): 3 461-3 467.
[32] 謝波, 胡睿. 放射性同位素18F在核醫學中的研究進展[J]. 同位素, 2009, 22(4): 247-252.
Xie Bo, Hu Rui. Development of radioisotope 18F in nuclear medicine [J]. Journal of isotopes, 2009, 22(4): 247-252(in Chinese).
[33] Devaraj NK, Keliher EJ, Thurber GM, et al.18F Labeled nanoparticles for in vivo PET-CT imaging[J]. Bioconjugate Chemistry, 2009, 20(2): 397-401.
[34] Sun HW, Zhang LY, Zhang XL.188Re-labeled MPEG-modified superparamagnetic nanogels: preparation and targeting application in rabbits[J]. Biomedical Microdevices, 2008, 10: 281-287.
[35] Liang S, Wang YX, Yu JF, et al. Surface modified superparamagnetic iron oxide nanoparticles: as a new carrier for bio-magnetically targeted therapy[J]. Journal of Material Sciences: Materials in Medicine, 2007, 18: 2 297-2 302.
[36] 陳春英. 二氧化鈦納米材料生物效應與安全應用[M]. 北京: 科學出版社, 2010: 115-138.
[37] 黃旋, 李晴暖, 李宇國, 等. 放射性(110Agm)Ag/TiO2復合納米微粒的研制[J]. 核技術, 2003, 26(3): 229-232.
Huang Xu, Li Qingnuan, Li Yuguo, et al. Preparation of (110Agm) Ag/TiO2radioactive nano-particles [J]. Nuclear Techniques, 2003, 26(3): 229-232.
[38] Abbas K, Cydzik I, Torchio RD, et al. Radiolabelling of TiO2nanoparticles for radiotracer studies[J]. Journal of Nanoparticle Research, 2010, 12: 2 435-2 443.
[39] 范方強, 余林, 孫明, 等. 超聲模板法制備納米二氧化鈰的研究[J]. 功能材料, 2010, 41(1): 135-138.
Fan Fangqiang, Yu Lin, Sun Ming, et al. Synthesis of CeO2 nanoparticles by ultrasonic template method [J]. Journal of Functional Materials, 2010, 41(1): 135-138(in Chinese).
[40] Oughton DH, Hertel-Aas T, Pellicer E, et al. Neutron activation of engineered nanoparticles as a tool for tracing their environmental fate and uptake in organisms[J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1 883-1 887.
[41] Gibson N, Holzwarth U, Abbas K, et al. Radiolabelling of engineered nanoparticles for in vitro and in vivo tracing applications using cyclotron accelerators[J]. Archives of Toxicology, 2011, 85(7): 751-773.
[42] Simonelli F, Marmorato P, Abbas K, et al. Cyclotron production of radioactive CeO2nanoparticles and their application for in vitro uptake studies[J]. IEEE Trans Nanobioscience. 2011, 10(1): 44-50.
[43] Lu K, Zhang ZY, He X, et al. Bioavailability and distribution and of ceria nanoparticles in simulated aquatic ecosystems, quantification with a radiotracer technique[J]. Journal of Nanoscience and Nanotechnology, 2010, 10 (12): 8 658-8 662.
[44] Zhang P, He X, Ma YH, et al. Distribution and bioavailability of ceria nanoparticles in an aquatic ecosystem model[J]. Chemosphere, 2012, 89: 530-535.
[45] Zhang ZY, He X, Zhang HF, et al. Uptake and distribution of ceria nanoparticles in cucumber plants[J]. Metallomics, 2011, 3 (8): 816-822.
[46] He X, Zhang HF, Ma YH, et al. Lung deposition and extrapulmonary translocation of nano-ceria after intratracheal instillation[J]. Nanotechnology, 2010, 21: 285103.
[47] Chen JK, Shih MH, Peir JJ, et al. The use of radioactive zinc oxide nanoparticles in determination of their tissue concentrations following intravenous administration in mice[J]. Analyst, 2010, 135, 1 742-1 746.
[48] Yeh TK, Chen JK, Lin CH, et al. Kinetics and tissue distribution of neutron-activated zinc oxide nanoparticles and zinc nitrate in mice: effects of size and particulate nature[J]. Nanotechnology, 2012, 23: 085102.

