MicroRNAs在植物響應金屬毒性中的作用
肖 莉,劉 春,向世鵬,彭晚霞
(1.衡南縣煙草公司,衡陽市煙草公司煙草科學研究所,湖南 衡陽 421001;2.衡陽師范學院 生命科學系,湖南 衡陽 421008;3.中國煙草中南農業試驗站,湖南 長沙 410128;4.中國科學院亞熱帶農業生態研究所,湖南 長沙 410125)
金屬毒性是影響作物產量的一個主要脅迫因子。包括植物必需的金屬,如銅、鐵、鋅、錳,和非必需金屬,如鎘、鋁、鈷、汞。高濃度的鋁、銅、鎘或汞等金屬對植物的一個主要且普遍的影響是抑制根的生長。金屬毒性能觸發活性氧的積累從而導致脂質、蛋白質和DNA的損傷。植物對金屬毒性的響應涉及幾個需要在轉錄和轉錄后水平被精確調控的生物過程。microRNAs(miRNAs)是一種小的,類似于siRNA的分子,由高等真核生物基因組編碼,miRNA通過和靶基因mRNA的堿基配對引導沉默復合體(RISC)降解mRNA或阻礙其翻譯。miRNAs在物種進化中相當保守,在植物、動物和真菌中發現的miRNAs只在特定的組織和發育階段表達,miRNA的組織特異性和時序性,決定了組織和細胞的功能特異性,表明miRNA在細胞生長發育和生物與非生物脅迫響應的調節過程中起多種作用。
1 植物對金屬毒性的響應
隨著人類活動對地球生態系統的影響加劇,植物不斷暴露于眾多的非生物和生物脅迫中。一種重要的非生物脅迫是金屬毒性。重金屬如銅(Cu)、鐵(Fe)和鋅(Zn)對于植物生理和生化過程來說是必需的,而鎘(Cd)、鈷(Co)、汞(Hg)和鋁(Al)等則不是必需的。然而,高濃度的任何金屬類型對植物都是有毒的。
根尖是根最敏感的部位,因此Al、Cu、Cd和Hg等金屬的毒性主要表現在抑制根的生長[1]。植物對金屬毒性的響應和處理包括合成參與脫毒的多種蛋白質,如金屬硫蛋白(Metallothionein)、植物螯合肽(Phytochelatin)和谷胱甘肽(Glutathione),它們具有選擇性和高親和力重金屬結合位點。根分泌檸檬酸、草酸、蘋果酸和組氨酸等有機酸至根際是一個重要的生理響應,因為這些復合物能與重金屬形成復合物從而脫毒[2]。
幾種金屬轉運蛋白的表達對于金屬毒性耐受性是必需的。ABC轉運蛋白(ATP-binding cassette)家族介導Al和Cd的轉 運[3]。NRAMP(natural resistance-associated macrophage protein)家族能對Cd、Mn和Zn的轉運進行調控[4]。CDF(cation diffusion facilitator)家族參與二價金屬陽離子的細胞質分泌和液泡隔離,從而在Zn、Cd、Co、Ni或Mn等金屬脫毒方面起作用[5]。已把源自P型ATP酶離子泵系統的轉運蛋白與Cu、Zn、Cd和Pb等重金屬的轉運體聯系起來[6]。
金屬毒性脅迫會觸發活性氧(ROS)的積累,抗氧化酶類的活性被這種脅迫上調而失去平衡[7]。氧化脅迫導致脂質、蛋白質和DNA的損傷。
植物對非生物脅迫如金屬毒性的響應涉及轉錄和轉錄后水平對基因表達的精確調控。調控可以通過來自MYB、bZIP、ERF和WRKY等 不 同 家 族 的 轉 錄 因 子 而 實 現[5,8-10]。已在生長素調控基因—parA等金屬響應基因的啟動子區域鑒定出順式作用元件,parA在煙草(Nicotiana tabacum)中參與對Cd的響應[11]。已在來自綠藻(Chlamydomonas reinhardtii)的糞生素氧化酶和細胞色素c6基因的啟動子中鑒定出具有共有序列GTAC的銅響應元件(CuRE)[12]。來自Phaseolus vulgaris的PvSR2基因的兩個啟動子區域含有重金屬響應元件(HMREs)[13]。
小和/或大的非蛋白質編碼RNAs(npcRNAs)可能參與金屬毒性響應的調控/信號轉導[14]。研究得最多的一類npcRNAs是microRNAs(miRNAs)。miRNAs是21個核苷酸的npcRNAs,在轉錄后水平調控植物的基因表達。具不完美的發夾結構的前體miRNA(pre-miRNA)被加工成成熟的miRNA并整合到RNA誘導的沉默復合物(RISC)中從而啟動與其堿基互補的靶mRNA(s)的降解/清除[15]。雖然在擬南芥中鑒定出的大部分miRNAs與植物的發育有關,但有證據表明miRNAs在植物響應包括金屬毒性在內的不同非生物脅迫方面也發揮作用[16]。
2 響應金屬毒性的miRNAs及其靶標
對暴露于金屬毒性下的植物的小RNAs表達譜的分析表明miRNA及其靶標是差異表達的,從而揭示了它們在調控/信號轉導途徑中的可能作用。為確定特異miRNA的作用,對其靶標的功能以及它們與金屬毒性響應相關信號轉導途徑之間可能的互作分析是重要的。大部分響應金屬毒性的保守性miRNAs的預測靶標是一些主要參與植物發育的轉錄因子(表1)。某種miRNA的上調導致其靶標的降解可能表明靶標作為對金屬毒性響應的負調節子而起作用。最近高通量基因組技術和其他遺傳學途徑拓展了我們有關miRNAs的現有知識,以及它們在幾種植物響應金屬毒性的信號轉導途徑中的靶標[17-20]。
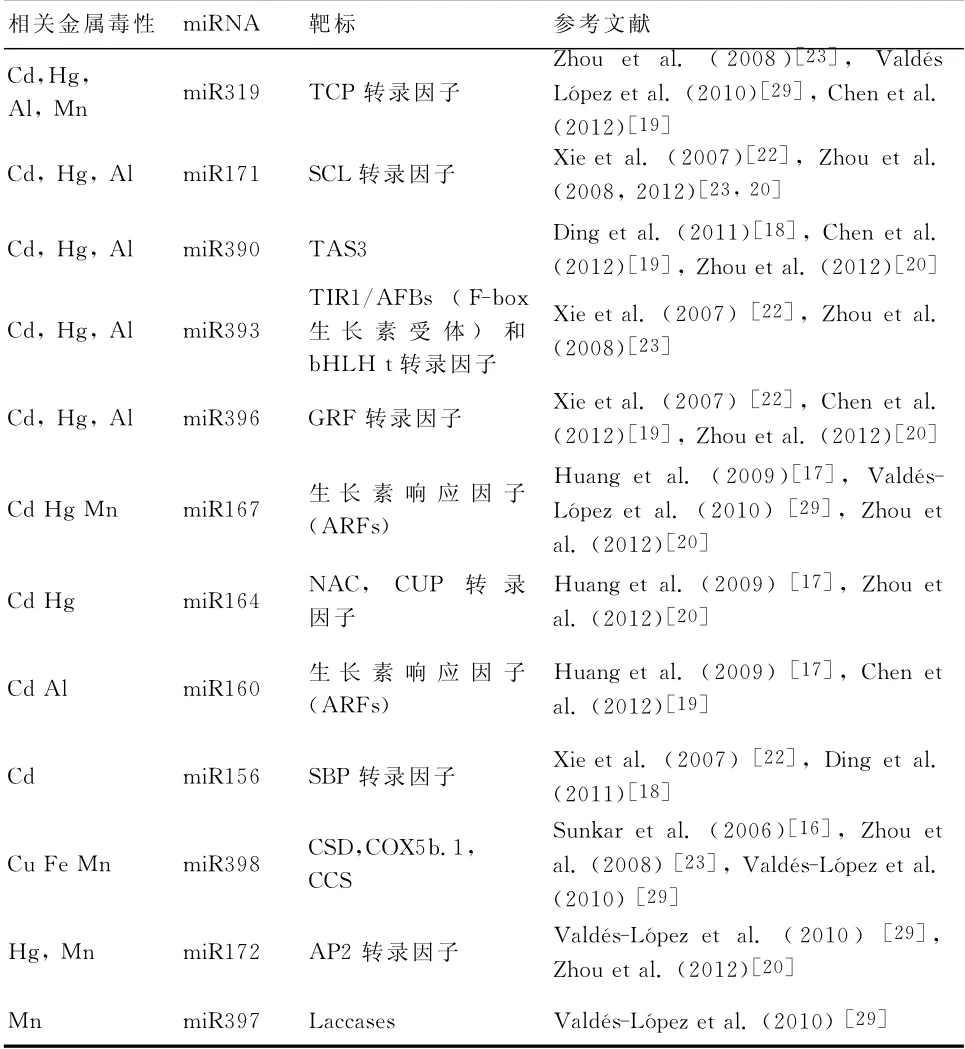
表1 響應金屬毒性的miRNAs
關于響應Cd毒性的miRNAs:miR160、miR164和miR167以及新的Osa-miR602和Osa-miR604,已從暴露于Cd的水稻幼苗的小RNAs庫中鑒定出來[17]。Osa-miR602在暴露于高Cd濃度下12小時的水稻根部中被上調,它的預測靶標是木葡聚糖內轉糖基化酶/水解酶。Osa-miR604在用毒性水平的Cd處理6小時后的葉片中被上調,脂質轉移蛋白(LPT)被下調[17]。這類蛋白質響應環境脅迫并被認為參與角質和蠟質的組裝以及植物對病原菌的防御[21]。水稻微陣列數據顯示在Cd脅迫下miR528被上調,而miR162、miR166、miR171、miR390、miR168和miR156家 族 被 下調[18]。搜索可能的響應金屬的順式作用元件揭示了一個類MRE序 列(5’-TGCGCNC-3’)存 在 于 大 多 數 響 應Cd的miRNA基因的啟動子區域[18]。與不同非生物脅迫相關的其他順式作用元件如ARE(anaerobic-responsive element)、ABRE(ABA-responsive element)、GARE(gibberellins-responsive element)、ERE(ethylene-responsive element)、HSE(heat stress-responsive element)和LTR(low temperatureresponsive element)等也發現存在于這些miRNA基因的啟動子中,從而暗示這些miRNAs可能響應除金屬毒性以外的其他脅迫信號[18]。暴露于Cd下8小時后的油菜根中的miR393、miR171、miR156和miR396被下調[22]。
暴露于Cd、Hg和Al 24小時后的模式豆科植物Medicago truncatula葉子中的miR393、miR171、miR319和miR529被上調,而miR166和miR398被下調[23]。一高通量小RNA測序方法揭示在對Al的響應中miR159、miR160、miR319、miR396和miR390被下調[19]。新近利用類似方法的一項研究在Medicago truncatula鑒定出了響應Hg毒性的miRNAs如miR167、miR172、miR169、miR164、miR395家族被上調,而miR396、miR390和miR171被下調。此外,在M.truncatula中鑒定出一個新的響應Hg的miRNAs如靶向編碼TIR-NBSLRR病抗性蛋白轉錄因子的miR2681[20]。
有關不同植物響應金屬的miRNAs的現有信息揭示了miR319、miR390、miR393和miR398具有普遍的相關作用。
3 miR319、miR390、miR393和miR398的作用
3.1 miR319
植物的生長和衰老是受金屬毒性影響的過程[24]。幼苗對Al和Cu毒性的常見反應包括葉片細胞和超微結構的改變,光合活性的降低導致葉片黃化和壞死,總的葉片數量和大小降低,以及幼苗的生物量減少[25]。此外,Cu毒性會導致葉片的快速衰老。有趣的是,miR319及其靶標TCP(Teosinte Branched/Cycloidea/PCF)轉錄因子(表1),涉及生長調控,在大多數響應金屬毒性的miRNAs研究中已被證明是差異化表達的。結合啟動子元件的TCP家族成員對于增殖細胞核抗原(PCNA)基因的表達是必需的[26]。其他的TCPs參與幼苗側生器官形態發生[27]。近來,已證明miR319在葉片衰老方面起作用,該作用是通過茉莉酸生物合成和重要的衰老正調控子如WRKY53來正調控涉及葉片衰老的TCPs實現的[28]。
圖1描述了miR319和TCP的作用模式。在葉片中,高Cd、Hg和Al誘導的miR319導致TCP的降解從而影響生長和衰老。在根中,miR319在對Al的響應中被抑制但在對Mn毒性的響應中被誘導[19,29]。當土壤中兩種金屬都豐富時,Al可能對Mn的吸收發揮拮抗作用從而減輕Mn毒性[30]。目前沒有有關當植物根暴露于Al和Mn組合時miR319調控的報道,我們發現關于這個問題的推測是困難的,因為在植物中特異作用將依賴于金屬濃度、暴露時間、環境條件等幾個變量。

圖1 對金屬毒性的響應中miR319、miR393和miR398的作用模式圖
3.2 miR390
在不同植物中的miR390及其靶標TAS3(表1)均表現出與響應金屬毒性有關。miR390誘導的TAS3轉錄本的切割起始ta-siRNAs(trans-acting small inter-ference RNAs)的生物發生,導致在側根發育中起關鍵作用的ARFs(auxin response factors)的降解[31]。在Cd、Hg和Al毒性下植物根中的miR390被抑制,而使完整的TAS3轉錄本積累和tasiARFs的減少,最終導致抑制側根的生長(圖1)[20]。
暴露于高Cu下的擬南芥植株顯示減少了主根的生長而增加了短側根的密度。同樣,在暴露于Cu下的植株中觀察到其主根和次生根根尖中有絲分裂活性、生長素和細胞因子在積累方面的改變[1]。我們可以推測miR390及其靶標可能也響應Cu毒性,但目前沒有有關Cu脅迫響應中存在miR390調控的信息。
3.3 miR393
miR393受Cd、Hg和Al毒性的誘導[22-23]。這些金屬在葉片中誘導產生miR393,這將導致其靶標F-box生長素受體TIR1/AFBs和bHLH轉 錄 因 子 受 到 抑 制(表1)[32]。TIR1正調控生長素信號轉導,miR393的增加導致生長素信號轉導受到抑制從而使TIR1處于較低的水平。研究顯示miR393在葉片發育、根系形態建成和根的生長方面起著重要的調控作用(圖1)[33]。這個miRNA也響應Pseudomonas syringae細菌感染和鹽分脅迫[32]。
根是受土壤中高濃度金屬影響的主要器官,常見的表型響應是株型的改變[34]。在這樣的響應中miR393和miR390可能起了相關的調控作用。
3.4 miR398
miR398是在受氧化脅迫的調控中鑒定出的第一個miRNA,其靶標是Cu/Zn超氧化物歧化酶(CSD)酶類:胞質CSD1和膜CSD2如COX5b.1、線粒體細胞色素氧化酶的5b亞基(表1)。CSDs是清除超氧自由基從而釋放分子氧和過氧化氫的酶類[35]。CSD2mRNA序列與miR398的互補序列位于編碼序列內而CSD1和COX5b.1轉錄本在5’UTR中含miR398互補序列[36]。
miR398啟動子含有響應Cu的具有重要特征的GTAC序列[37]。這一模序能被SPL7轉錄因子識別,該轉錄因子能結合miR398并調控miR398的表達。此外,這個轉錄因子也調控其他Cu相關miRNAs如miR397、miR408和miR857等的表達[38]。GTAC啟動子序列也出現在其他重要的Cu響應基因如在Cu缺乏下能增強Cu吸收能力的CPX1(coproporphyrinogen oxidase)和Cyc6(cytochrome 1c6)中[12]。
氧化脅迫抑制miR398的表達對于CSD1和CSD2轉錄本的積累是必不可少的(圖1)。暴露于Cu2+和Fe3+[16]等重金屬下miR398被下調,Cu2+和Fe3+能參與Fenton式反應且有產生羥自由基的潛力[39]。此外,miR398在對強光和甲基紫精的響應中被下調,此時CSD1和CSD2的轉錄本水平通常是增加的[16]。
過表達miR398前體的共抑制轉基因品系顯示在幼苗發育和脂質過氧化速率方面對Cu2+和MV脅迫的耐受性增強[16]。相反,一些報道指出同時過表達miR398b和miR398c是可能的且過表達品系表現出降低了CSD1和CSD2水平,但COX5b.1、mRNA和蛋白質水平沒受影響[40]。
蔗糖是miR398表達的一個重要信號,它正調控miR398的積累。蔗糖水平與CSD1和CSD2蛋白質水平相一致,但COX5b.1的水平隨著蔗糖水平的增加而降低。通過蔗糖而增加的miR398水平在存在和缺乏Cu的情況下都能維持,因此蔗糖和Cu對miR398的調控是獨立的[40]。
最近鑒定出超氧化物歧化酶(SOD)的Cu分子伴侶是miR398的一個靶標,當Cu缺乏時它的mRNA切割是受miR398介導的[41]。Beauclair等(2010)[41]認為通過miR398的SOD調控能響應未改變的CSD1和CSD2的蛋白質水平,該蛋白質水平是在表達抗miR398形式的CSD1或CSD2的植物研究中出現的[40]。
顯然,非生物脅迫如Cu2+、Fe3+、強光、MV、臭氧、鹽分和生物脅迫的共用信號是ROS的積累。ROS的產生和活性抗氧化酶類的合成均是對金屬毒性的一個普遍反應。特異響應的miR398或其他ROS響應的miRNAs可能會根據金屬種類和暴露于金屬脅迫下的時間而變化(圖1)。
4 結 論
通過對響應不同金屬毒性的miRNAs的分析和鑒定,表明它們參與植物適應這些非生物脅迫的調控網絡。由此我們可以預測更多新的響應金屬脅迫的miRNAs的存在。為深入理解miRNAs及其靶標、以及闡明其作為植物響應環境改變的信號轉導途徑之一的機理,進一步的研究是必要的。而且我們應當考慮不同植物物種生長習性和基因型背景的差異而可能存在對金屬脅迫差異響應的miRNAs。暴露于金屬下的時間長短、金屬的不同濃度和不同種類金屬的組合誘導的miRNAs及其靶標動力學的詳細研究將有助于我們深刻理解miRNAs在脅迫調控中的詳細作用機制,這將有助于設計出增強作物脅迫耐受性的更好的策略。
[1]Lequeux H,Hermans C,Lutts S,et al.Response to copper excess in Arabidopsis thaliana:impact on the root system architecture,hormone distribution,lignin accumulation and mineral profile[J].Plant Physiol Biochem,2010,48:673-682.
[2]Hall JL.Cellular mechanisms for heavy metal detoxification and tolerance[J].J Exp Bot,2002,53:1-11.
[3]Huang CF,Yamaji N,Chen Z,et al.A tonoplast-localized half-size ABC transporter is required for internal detoxification of aluminum in rice[J].Plant J,2012,69:857-867.
[4]DalCorso G,Farinati S,Furini A.Regulatory networks of cadmium stress in plants[J].Plant Signal Behav,2010,5:663-667.
[5]Krámer U,Talke IN,Hanikenne M.Transition metal transport[J].FEBS Lett,2007,581:2263-2272.
[6]Lee S,Kim YY,Lee Y,et al.Rice P1B-type heavy-metal ATPase,OsHMA9,is a metal efflux protein[J].Plant Physiol,2007,145:831-842.
[7]Romero-Puertas MC,Corpas FJ,Rodriguez-Serrano M,et al.Differential expression and regulation of antioxidative enzymes by cadmium in pea plants[J].J Plant Physiol,2007,164:1346-1357.
[8]Jacoby M,Weisshaar B,Vicente-Carbajosa J,et al.bZIP transcription factors in Arabidopsis[J].Trends Plant Sci.2002,7:106-111.
[9]Wei W,Zhang Y,Han L,et al.A novel WRKY transcriptional factor from Thlaspi caerulescens negatively regulates the osmotic stress tolerance of transgenic tobacco[J].Plant Cell Rep,2008,27:795-803.
[10]Farinati S,DalCorso G,Varotto S,et al.The Brassica juncea BjCdR15,an ortholog of Arabidopsis TGA3,is a regulator of cadmium up take,transport and accumula-tion in shoots and confers cadmium tolerance in transgenic plants[J].New Phytol,2010,185:964-978.
[11]Kusaba M,Takahashi Y,Nagata T.A multiple-stimuliresponsive as-7-related element of parA gene confers responsiveness to cadmium but not to copper[J].Plant Physiol,1996,111:1161-1167.
[12]Quinn JM,Barraco P,Eriksson M,et al.Coordinate copper and oxygen-responsive Cyc6and Cpx1expression in Chlamydomonas is mediated by the same element[J].J Biol Chem,2000,275:6080-6089.
[13]Qi X,Zhang Y,Chai T.Characterization of a novel plant promoter specifically induced by heavy metal and identification of the promoter regions conferring heavy metal responsiveness[J].Plant Physiol,2007,143:50-59.
[14]Ben Amor B,Wirth S,Merchan F,et al.Novel long non-protein-coding RNAs involved in Arabidopsis differentiation and stress responses[J].Genome Res,2009,19:57-69.
[15]Jones-Rhoades MW,Bartel DP,Bartel,B.MicroRNAs and their regulatory roles in plants[J].Annu Rev Plant Biol,2006,57:19-53.
[16]Sunkar R,Kapoor A,Zhu JK.Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J].Plant Cell,2006,18:2051-2065.
[17]Huang SQ,Peng J,Qiu CX,et al.Heavy metal-regulated new microRNAs from rice[J].J Inorg Biochem,2009,103:282-287.
[18]Ding Y,Chen Z,Zhu C.Microarray-based analysis of cadmium-responsive microRNAs in rice(Oryza sativa)[J].J Exp Bot,2011,62:3563-3573.
[19]Chen L,Wang T,Zhao M,et al.Identification of aluminum-responsive microRNAs in Medicago truncatula by genome-wide high-throughput sequencing[J].Planta,2012,235:375-386.
[20]Zhou ZS,Zeng HQ,Liu ZP,et al.Genome-wide identification of Medicago truncatula microRNAs and their targets reveals their different regulation by heavy metal[J].Plant Cell Environ,2012,35:86-99.
[21]Kim TH,Park JH,Kim MC,et al.Cutin monomer induces expression of the rice OsLTP5lipid transfer protein gene[J].J Plant Physiol,2008,165:345-349.
[22]Xie FL,Huang SQ,Guo K,et al.Computational identification of novel microRNAs and targets in Brassica napus[J].FEBS Lett,2007,581:1464-1474.
[23]Zhou ZS,Huang SJ,Yang ZM.Bioinformatic identification and expression analysis of new microRNAs from Medicago truncatula[J].Biochem Biophys Res Commun,2008,374:538-542.
[24]Maksymiec W.Signaling responses in plants to heavy metal stress[J].Acta Physiol Plant,,2007,29:177-187.
[25]Panou-Filotheou H,Bosabalidis AM,Karataglis S.Effects of copper toxicity on leaves of oregano(Origanum vulgare subsp.hirtum)[J].Ann Bot,2001,88:207-214.
[26]Kosugi S,Ohashi Y.PCF1and PCF2specifically bind to cis elements in the rice proliferating cell nuclear antigen gene[J].Plant Cell,9:1607-1619.
[27]Li C,Potuschak T,Colón-Carmona A,et al.Arabidopsis TCP20links regulation of growth and cell division control pathways[J].Proc Natl Acad Sci U.S.A,2005,102:12978-12983.
[28]Schommer C,Palatnik JF,Aggarwal P,et al.Control of jasmonate biosynthesis and senescence by miR319targets[J].PLoS Biol.2008,6,e230.doi:10.1371/journal.pbio.0060230.
[29]Valdés-López O,Yang SS,Aparicio-Fabre R,,et al.MicroRNA expression profile in common bean(Phaseolus vulgaris)under nutrient deficiency stresses and manganese toxicity[J].New Phytol,2010,187:805-818.
[30]Yang ZB,You JF,Xu MY,et al.Interaction between aluminum toxicity and manganese toxicity in soybean(Glycine max)[J].Plant Soil,2009,319:277-289.
[31]Marin E,Jouannet V,Herz A,et al.miR390,Arabidopsis TAS3tasiRNAs,and their AUXIN RESPONSE FACTOR targets define an autoregulatory network quantitatively regulating lateral root growth[J].Plant Cell,2010,22:1104-1117.
[32]Navarro L,Dunoyer P,Jay F,et al.A plant miRNA contributes to antibacterial resistance by repressing auxin signaling[J].Science,2006,312:436-439.
[33]Chen ZH,Bao ML,Sun Y Z,et al.Regulation of auxin response by miR393-targeted transport inhibitor response protein 1is involved in normal development in Arabidopsis[J].Plant Mol Biol,2011,77:619-629.
[34]Kochian LV,Pi?eros MA,Hoekenga OA.The physiology,genetics and molecular biology of plant aluminum resistance and toxicity[J].Plant Soil,2005,274:175-195.
[35]Kliebenstein DJ,Monde RA,Last RL.Superoxide dismutase in Arabidopsis:an eclectic enzyme family with disparate regulation and protein localization[J].Plant Physiol.1998,118:637-650.
[36]Sunkar R,Zhu J.Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J].Plant Cell,2004,16:2001-2019.
[37]Yamasaki H,Hayashi M,Fukazawa M,et al.SQUAMOS A promoter binding protein-like 7is a central regulator for copper homeostasis in Arabidopsis[J].Plant Cell,2009,21:347-361.
[38]Ding YF,Zhu C.The role of microRNAs in cooper and cadmium homeostasis[J].Biochem Biophys Res Commun.2009,386:6-10.
[39]Estevez MS,Malanga G,Puntarulo S.Iron-dependent oxidative stress in Chlorella vulgaris[J].Plant Sci.2001,161:9-17.
[40]Dugas DV,Bartel B.Sucrose induction of Arabidopsis miR398represses two Cu/Zn superoxide dismutases[J].Plant Mol Biol,2008,67:403-417.
[41]Beauclair L,Yu A,BouchéN.MicroRNA-directed cleavage and translational repression of the copper chaperone for superoxide dismutase mRNA in Arabidopsis[J].Plant J.2010,62:454-462.

