響應面法優化嗜麥芽窄食單胞菌產蛋白酶發酵培養基
顧瑾麟,張紅發,夏永軍,任 靜
(光明乳業股份有限公司乳業研究院,乳業生物技術國家重點實驗室,上海200436)
蛋白酶是催化蛋白質水解的一類酶,主要存在于動物內臟、植物莖葉、果實和微生物中[1],既可以從動植物組織中提取,也可以通過微生物發酵工藝進行生產,是一類廣泛應用于食品、紡織、醫藥、有機合成、洗滌劑及制革脫毛等方面的重要工業和研究用酶,其份額占整個酶制劑市場的一半以上[2]。微生物來源的蛋白酶,生產周期短、生產成本低、不受土地和季節限制,多為胞外酶,純化制備相對容易,規模化生產的成本會大大降低。
考察培養基組分對產酶影響的傳統方法有單因子實驗、全因子實驗等。因其未考慮各因素之間的交互作用,故不能實現真正的最優化,且當因素較多時,實驗次數太多[3]。響應面法(Response surface methodology,RSM)是一種集實驗設計、模型建立、各因素重要性的評估和各因素最優水平的確定的一種統計學方法,是重要的過程優化工具,它能迅速高效地確定多因子系統的最佳條件[4]。近年來采用響應面法對微生物發酵產酶培養基優化已有一些報道,并取得了較好的優化結果。Papagora C等[5]從干腌橄欖中分離得到菌株Debaryomyces hansenii YLL29,通過響應面法優化,其胞外脂肪酶活力達7.44U/m L,是未優化前的2.28倍。K N Niladevid等[6]通過響應面法將絲狀菌鏈霉菌psammoticus ATCC 7334深層發酵產漆酶的含量提高了3倍。Yishan Su等[7]從泰山分離到產熱穩定木聚糖酶菌株Thermomyces lanuginosus SDYKY-1,通過中心組合設計與響應面法優化,將其木聚糖酶活力提高144%,為3078U/m L。
本文以實驗室分離保存的一株對脫脂乳平板有明顯水解圈的菌株為實驗對象,經鑒定為嗜麥芽窄食單胞菌(Kx-7),原始酶活為146.43U/m L。為了提高Kx-7產蛋白酶活力,以單因素實驗為基礎,并以篩選出的因素水平為變量,以蛋白酶酶活為響應值,運用響應面法對培養基進行優化,以期獲得最佳發酵培養基配比。
1 材料與方法
1.1 材料與儀器
嗜麥芽窄食單胞菌(Kx-7) 由本實驗室分離保存;脫脂奶粉、福林試劑、碳酸鈉、三氯乙酸、磷酸二氫鈉、磷酸氫二鈉、干酪素、氫氧化鈉、酪氨酸、葡萄糖、D-果糖、蔗糖、α-乳糖、淀粉、麥芽糖、酪蛋白、胰蛋白胨、酵母浸出粉、大豆蛋白胨、硝酸鈉、尿素、硫酸銨、Triton X-100、十二烷基硫酸鈉(SDS)、吐溫-60、吐溫-20、吐溫-80 均為國產分析純;種子培養基(LB培養基) 胰蛋白胨10g/L、酵母提取物5g/L、氯化鈉10g/L,pH自然;原始發酵培養基 D-果糖30g/L、酪蛋白5g/L、Na2HPO4·2H2O 6g/L、KCl 1g/L、MgSO4·7H2O 0.1g/L,pH自然。以上培養基于121℃滅菌20m in。
BPH-9082恒溫培養箱 上海一恒科技有限公司;ZHWY-2102C雙層恒溫搖床 上海智成分析儀器制造有限公司;Purifier RlogicTM 4英尺TypeA2生物安全柜 美國LABCONCO;MLS-3750高壓滅菌鍋日本SANYO;M inispin p lus臺式離心機 德國艾本德eppendorf;AL104梅特勒分析天平、PL2002梅特勒便攜式天平 瑞士梅特勒-托利多;SpectraMax M 5酶標儀 美國Molecular Devices公司。
1.2 實驗方法
1.2.1 蛋白酶活力測定方法 參考行業標準《蛋白酶活力測定法》[8]。酶活力單位定義為:在 40℃下每分鐘水解酪蛋白產生lμg酪氨酸,定義為1個蛋白酶活力單位。
1.2.2 單因素實驗
1.2.2.1 碳源對酶活的影響 以接種量為5%(v/v)的菌液轉接于分別添加了6種不同碳源的發酵培養基中,碳源分別為α-乳糖、蔗糖、淀粉、麥芽糖、D-果糖、葡萄糖,均30g/L;180r/m in,30℃振蕩培養,30h后測定發酵液中蛋白酶活力。
1.2.2.2 氮源對酶活的影響 以接種量為5%(v/v)的菌液轉接于分別添加了7種不同氮源的發酵培養基中,氮源分別為大豆蛋白胨、胰蛋白胨、酵母侵出粉、硫酸銨、尿素、硝酸鈉、酪蛋白,均5g/L;以1.2.2.1中蛋白酶活力最高的因素為碳源,180r/m in,30℃振蕩培養,30h后測定發酵液中蛋白酶活力。
1.2.2.3 表面活性劑對酶活的影響 以接種量為5%(v/v)的菌液轉接于分別添加了5種表面活性劑的發酵培養基中,表面活性劑分別為吐溫20、吐溫60、吐溫80、Triton X-100均4m L/L,SDS 0.2g/L;以1.2.2.1和1.2.2.2中影響酶活最高的因素為碳源和氮源,同時以不添加表面活性劑為空白對照,180r/m in,30℃的條件下振蕩培養,30h后測定發酵液中蛋白酶活力。
1.2.3 響應面實驗設計 根據單因素實驗結果確定最佳碳源、氮源、表面活性劑及其相應濃度范圍后,用Design Expert 7.0軟件,根據Box-Behnken模型的中心組合實驗原理設計三因素三水平的Box-Behnken實驗。以D-果糖(X1)、酪蛋白(X2)和Triton-100(X3)三個因素為自變量,以蛋白酶酶活(Y)為響應值,對實驗數據進行回歸性分析,用t檢驗驗證回歸系數的顯著性,用F檢驗評價模型方程的顯著性,方程的擬合性由R2確定。實驗設計因素及水平見表1。
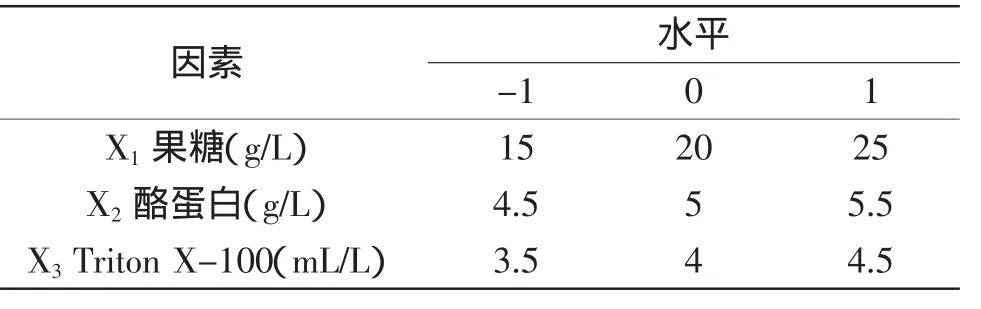
表1 響應面法分析因素及水平表Table1 Factors and levels for response surface analysis
2 結果與討論
2.1 單因素實驗結果
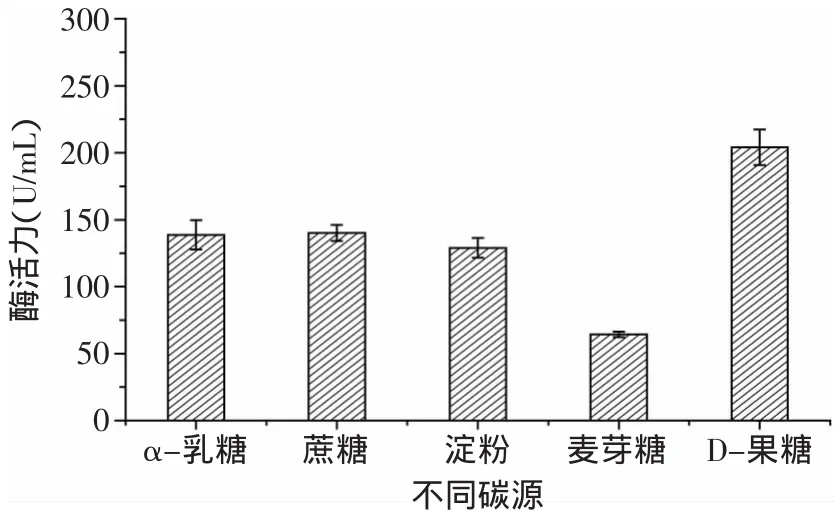
圖1 不同碳源對蛋白酶酶活的影響Fig.1 Effectof different carbon sources on enzyme activity of protease
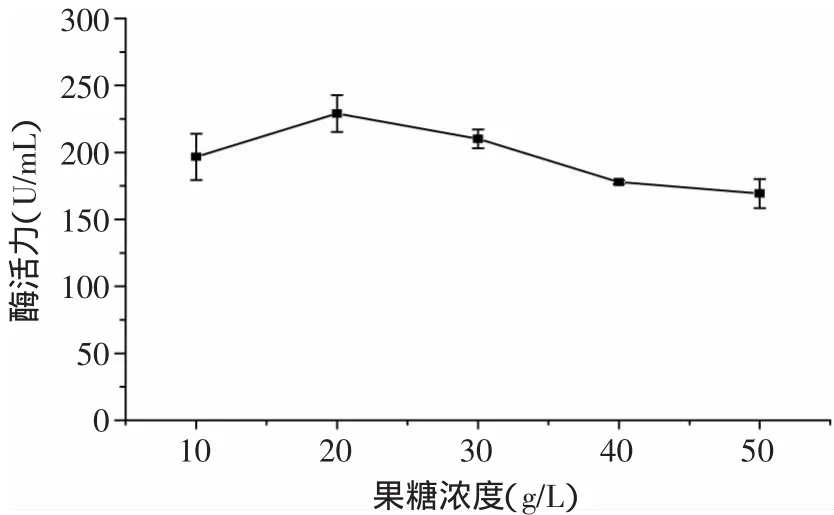
圖2 D-果糖濃度對蛋白酶酶活的影響Fig.2 Effect of D-fructose concentration on enzyme activity of protease
2.1.1 不同碳源對酶活的影響 微生物細胞含碳量約占干重的50%,故除水分外,碳源是需要量最大的營養素[9],因此選擇合適的碳源對菌體的生長以及產酶都極為重要。由圖1可見,當以酪蛋白為氮源時,碳源對Kx-7產酶的影響依次是D-果糖>蔗糖>α-乳糖>淀粉>麥芽糖。碳源為D-果糖時,蛋白酶活力最高為204.04U/m L,具有顯著效應。可能由于D-果糖為單糖,不需要再水解,相對于雙糖和多糖更便于Kx-7吸收所利用。由圖2可見,當D-果糖濃度為20g/L時,蛋白酶活力最高為229.02U/m L,過高或過低的糖濃度都不利于該菌株生長。這是由于糖濃度過低不能提供足夠的能量和物質來源;而糖濃度過高一方面會引起發酵液中滲透壓過高,使細胞失水,生長受到抑制,另一方面糖濃度過高使代謝產物增加,發酵液pH降低,不利于菌株生長。
2.1.2 氮源對酶活的影響 由圖3可見,氮源對Kx-7產酶的影響依次是酪蛋白>胰蛋白胨>大豆蛋白胨>硝酸鈉>尿素,使用有機氮源(酪蛋白、胰蛋白胨、大豆蛋白胨)時,Kx-7產酶酶活明顯高于無機氮源(尿素、硝酸鈉),其原因可能是有機氮源中含有的無機鹽、較豐富的B族維生素及生長因子促進了蛋白酶的產生[10],無機氮源成分較單一,影響產酶量。3種有機氮源中,酪蛋白效果最好,酶活力達到257.67U/m L,可見酪蛋白具有顯著效應。其原因可能是動物蛋白(酪蛋白、胰蛋白胨)比植物蛋白(大豆蛋白胨)對Kx-7產酶具有更好的促進作用。由圖4可見,當酪蛋白濃度為5g/L時,蛋白酶活力最高為261.05U/m L,這是因為濃度過高導致C/N比降低,不利于蛋白酶積累;濃度過低不能得到理想的菌濃度,同樣不利于蛋白酶的產生。
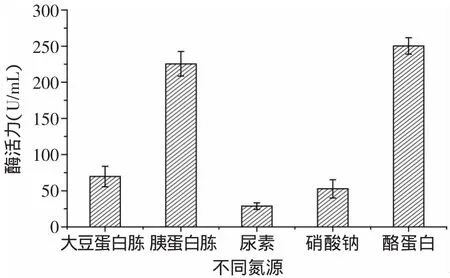
圖3 不同氮源對蛋白酶酶活的影響Fig.3 Effectof nitrogen sources on enzyme activity of protease
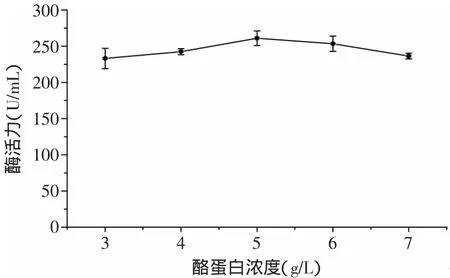
圖4 酪蛋白濃度對蛋白酶酶活的影響Fig.4 Effectof casein concentration on enzyme activity of protease
2.1.3 表面活性劑對酶活的影響 由圖5可見,表面活性劑對Kx-7產酶的影響依次為Triton X-100>SDS>空白對照>吐溫-60>吐溫-20>吐溫-80。Triton X-100和SDS對Kx-7產蛋白酶活力有較大的促進作用,酶活分別達到290.72U/m L和283.79U/m L,可見Triton X-100具有顯著效應。而表面活性劑吐溫-20、吐溫-60、吐溫-80對Kx-7產蛋白酶活力沒有明顯影響。由圖6可見,當Triton X-100濃度為4m L/L時,蛋白酶活力最高為284.50U/m L。表面活性劑在微生物發酵中的主要作用是提高細胞膜的滲透性,減少氧及營養物質進入細胞的傳遞阻力,從而提高目標產物的產量[11]。蛋白酶活力與Triton X-100呈現一定程度的濃度依賴性,低濃度時對蛋白酶活力有促進作用,高濃度則有抑制作用。
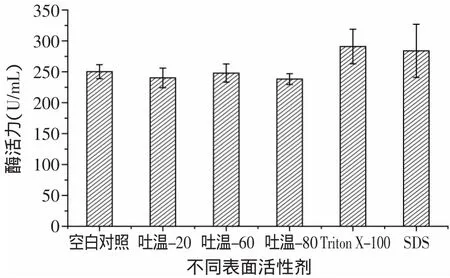
圖5 不同表面活性劑對蛋白酶酶活的影響Fig.5 Effectof Surfactants on enzyme activity of protease

圖6 Triton X-100濃度對蛋白酶酶活的影響Fig.6 Effectof Triton X-100 concentration on enzyme activity of protease
2.2 響應面分析
2.2.1 響應面回歸模型的建立和分析 根據單因素實驗結果,確定D-果糖、酪蛋白、Triton X-100為影響Kx-7產蛋白酶的關鍵因素,實驗設計及結果如表2所示。實驗數據進行二次多項式回歸擬合后,獲得嗜麥芽窄食單胞菌Kx-7產酶酶活對D-果糖、酪蛋白、Triton X-100的二次多項式回歸方程為:

此模型相關系數R2=0.9425,這說明預測值與實測值之間有較好的擬合度。該二次項方程及各項方差分析如表3所示,模型p值為0.0127,說明模型顯著(p<0.05),失擬項p值為0.1217,說明由誤差引起模型偏差的概率為12.17%,模型失擬項不顯著(p>0.05)。方程中獨立變量X1、X2、X3不顯著性,這表明僅隨單因素濃度的增加蛋白酶活力增加不顯著。在交互項中,X1X2、X1X3顯著(p<0.05)。X、X、X對響應值影響顯著(p<0.05)。
2.2.2 交互作用分析 經Design Expert軟件分析可得到3個顯著影響因子之間的響應面分析圖(如圖7~圖9所示),相比于二次回歸方程,響應面圖能直觀的顯示3種因素的交互作用和對Kx-7產蛋白酶的影響,每組響應面圖譜都有明顯的頂峰,證實影響因素的最佳值落在實驗設計的取值范圍內。通過響應面圖3種因素的最佳值可以得到預測,最大蛋白酶活力值在響應面的最高點處[12]。3種因素中X1與X2,X1與X3之間有顯著的交互作用,X2與X3的交互作用不顯著(p>0.05)。三因素的交互響應曲面圖見圖7~圖9。
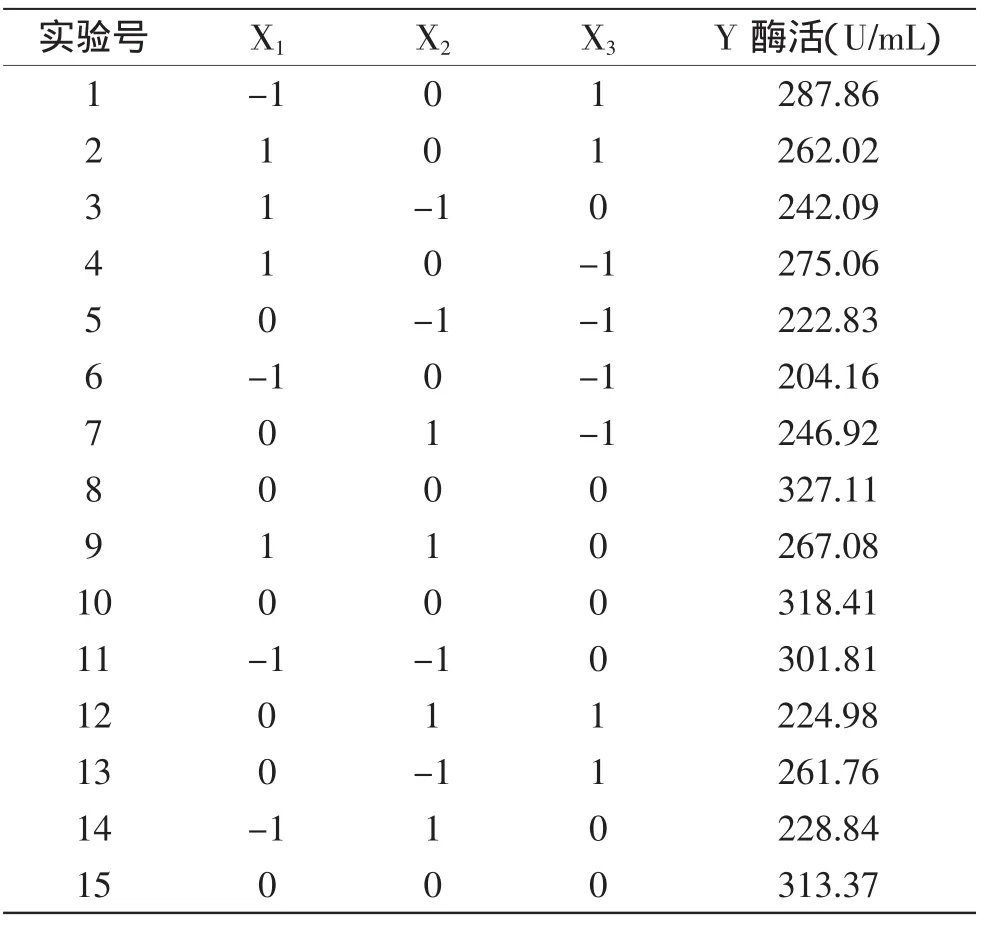
表2 Box-Behnken實驗設計及結果Table2 Design and results of Box-Behnken experiment

表3 響應面結果方差分析Table3 Variance analysis of response surfacemethod design result
2.3 嗜麥芽窄食單胞菌(Kx-7)產蛋白酶最優培養基配方的獲取與驗證
對回歸方程進行進一步分析,得到的最優發酵培養基組成為D-果糖19.15g/L,酪蛋白4.05g/L,Triton X-100 5.10m L/L時,理論上嗜麥芽窄食單胞菌(Kx-7)產蛋白酶活力的最大值為321.30U/m L。根據上述回歸分析結果和響應面實驗特點,通過實驗驗證,發酵30h后實際蛋白酶活力為(324.56±0.31)U/m L,與理論值較接近,預測精度達98.99%,可見該模型能較好地預測Kx-7實際產蛋白酶情況。從而用響應面法優化的發酵培養基可為今后Kx-7的培養和開發利用提供必要的理論基礎。

圖7 D-果糖和酪蛋白交互作用對蛋白酶活力的影響Fig.7 Effectof D-fructose and casein on enzyme activity of protease
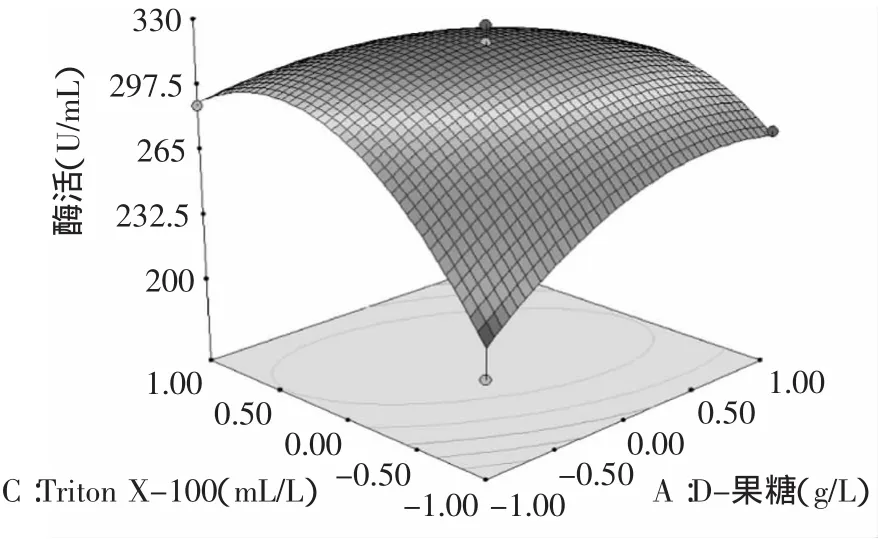
圖8 D-果糖和曲拉通-100交互作用對蛋白酶活力的影響Fig.8 Effectof D-fructose and Triton X-100 on enzyme activity of protease

圖9 酪蛋白和曲拉通-100交互作用對蛋白酶活力的影響Fig.9 Effect of casein and Triton X-100 on enzyme activity of protease
3 結論
蛋白酶具有重要的工業和研究應用價值,通過篩選高產菌種,優化發酵條件來提高蛋白酶產量是降低其工業應用成本的有效手段。影響微生物產酶的因素主要有3方面,即微生物菌株的自身優劣,培養基組成和培養條件[13]。嗜麥芽窄食單胞菌(Kx-7)為本實驗室篩選的蛋白酶高產菌株,從優化培養基組分出發,首先采用單因素實驗確定了嗜麥芽窄食單胞菌Kx-7產蛋白酶適宜的碳源、氮源及表面活性劑,分別為果糖,酪蛋白和Triton X-100,并分別確定了各自的適宜濃度范圍。利用Box-Behnken實驗對Kx-7產蛋白酶的發酵培養基進行優化,結果表明當果糖的濃度為19.15g/L,酪蛋白濃度為4.05g/L,曲拉通的濃度為5.1m L/L時,Kx-7的蛋白酶活力達到324.56U/m L,比優化前提高了1.2倍。該結果表明,采用響應面法來提高嗜麥芽窄食單胞菌(Kx-7)蛋白酶產量是可行的,具有一定實用價值。
[1]馬桂珍,暴增海,王淑芳,等.高產蛋白酶細菌的分離篩選及其種類鑒定[J].食品科學,2011,32(21):183-187.
[2]宋鵬,陳亮,郭秀璞,等.產蛋白酶菌株的鑒定及酶學特性[J].食品科學,2012,33(13):152-155.
[3]湯斌,潘海波,張慶慶,等.基于響應面法優化匍枝根霉TP-02液態發酵纖維素酶條件[J].工業微生物,2010,40(2):30-34.
[4]Majumder A,Bhandari S,Purama RK,et al.Enhanced production of a novel dextran from Leuconostoc mesenteroides NRRLB-640 by response surfacemethodology[J].Ann Microbiol,2009,59(2):309-315.
[5]Papagora C,Roukas T,Kotzekidou P.Optimization of extracellular lipase production by Debaryomyces hansenii isolates from dry-salted olives using response surface methodology[J].Food and BioproductsProcessing,doi:10.1016/j.fbpo,2013,02,008.
[6]Niladevi K N,Sukumaran R K,Jacob N,et al.Optimization of laccase production from a novel strain-Streptomyces psammoticus using response surface methodology[J].Microbiological Research,2009,164(1):105-113.
[7]Su Y S,Zhang X Y,Hou ZW,et al.Improvement of xylanase production by thermophilic fungus Thermomyces lanuginosus SDYKY-1 using response surface methodology[J].New Biotechnology,2011,28(1):40-46.
[8]中華人民共和國衛生部中國國家標準化管理委員會.GB/T 5009.9-2008食品中淀粉的測定[S].北京:中國標準出版社,2008.
[9]周德慶.微生物學教程[M].北京:高等教育出版社,2005.
[10]郭艾英,凌云,張志雯.產低溫蛋白酶海洋細菌的篩選及發酵條件[J].河北科技師范學院學報,2011,25(3):58-63.
[11]呂哲喆,劉曉俠,孫詩清,等.表面活性劑對天然紅色素發酵的影響藥物生物技術[J].藥物生物技術,2012,19(4):324-327.
[12]Cai MH,Zhou XS,Sun XQ,et al.Statistical optimization ofmedium composition for aspergiolide A production bymarinederived fungus Aspergillusglaucus[J].JInd Microbiol Biotechnol,2009,36:381-389.
[13]劉明啟,關榮發,陳文偉.黑曲霉固體發酵產木聚糖酶的響應面優化設計及其酶學性質的研究[J].農業生物技術學報,2010,18(1):52-60.

