七種試劑對單針藻的絮凝作用
劉平懷,張 玲,羅 寧
(海南大學材料與化工學院,海南大學熱帶作物種質資源保護與開發利用教育部重點實驗室,海南海口570228)
單針藻(Monoraphidium sp.)是具有較高的科研及經濟價值的微藻,有著極大地應用潛力。研究發現,單針藻是生產生物柴油的優良藻株[1-3],亦可用來生產蝦青素[4]。單針藻細胞為不規則的寬紡錘形,呈直或略彎,細胞寬約4~8μm,長約12~26μm,由于其特殊的微小個體,采用傳統的固液分離方法會堵塞濾膜而使得過濾失效;另外,微藻細胞懸浮于水中無法自然沉降,且在開放培養體系中濃度很低(一般為0.5~3g/L)[5],極大地增加了離心收集的成本。有研究表明,微藻的采收成本占其生產成本的20%~30%[6],因此尋找高效的采收技術以降低微藻培養成本十分重要,國內外通常采用的方法是將微藻培養液濃縮。在藻液中添加絮凝劑是微藻采收過程中常用的一種技術[7],常用的絮凝劑包含無機和有機試劑,如硫酸鋁、硫酸鋁鉀、氫氧化鈣、聚合氯化鋁、聚丙烯酰胺和殼聚糖等。目前國內外較少報道關于單針藻的絮凝采收。本文考察了硫酸鋁鉀、硫酸鋁、氫氧化鈣、氯化鐵、氯化鋁、聚丙烯酰胺、殼聚糖7種試劑對單針藻的絮凝效應,以期找到適合單針藻濃縮的絮凝劑,為單針藻采收提供理論依據。
1 材料與方法
1.1 材料與儀器
單針藻(Monoraphidium sp.) 分離自海南儋州,現保存于海南大學生物工程實驗室;硫酸鋁鉀(KA l(SO4)2,AR,純度>99.5%)、氫氧化鈣(Ca(OH)2, AR,純度>95.0%)、聚丙烯酰胺(AR,純度>90.0%)天津永大化學試劑;硫酸鋁(Al2(SO4)3,AR,純度>99.0%)、氯化鐵(FeCl3,AR,純度>99.0%)、氯化鋁(AlCl3,AR,純度>97.0%) 廣州化學試劑;殼聚糖BR,脫乙酰度80.0%~95.0%,國藥集團化學試劑。
CR22GⅡ型高速冷凍離心機日立;LGJ-25C型冷凍干燥機 北京四環儀器;IX71型倒置顯微鏡 奧林帕斯;TU-1810型紫外可見分光光度計 普析通用。
1.2 培養基及培養條件
單針藻培養采用BG-11液體培養基(參照美國德州大學藻種庫配方),100L大桶通氣培養,大桶置于室外陽臺,培養10d后取藻液,8000r/min離心,收集藻泥,冷凍干燥機凍干,藻粉存儲于-20℃冰箱備用。
1.3 實驗設計
1.3.1 單針藻藻體干重與光密度值的關系
1.3.1.1 單針藻最大吸收波長的確定 稱取一定量的單針藻藻粉,用蒸餾水配制成濃度為0.3125、0.6250、1.2500、2.5000、5.0000g/L的藻液,采用紫外可見分光光度計做全波長掃描,根據光密度值確定其在不同濃度下的最大吸收波長。
1.3.1.2 單針藻藻體干重與光密度值標準曲線的繪制 取單針藻藻粉,用蒸餾水配制成濃度為0.05、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6g/L,在最大吸收波長下測定其吸光度值,依據吸光度值繪制藻體干重與光密度值的標準曲線:y=a x+b,其中x為藻體干重,y為吸光度值。
1.3.2 不同絮凝劑對單針藻絮凝效率的研究 本次實驗共采用7種絮凝劑,分別為:KA l(SO4)2、A l2(SO4)3、Ca(OH)2、FeCl3、A lCl3、聚丙烯酰胺、殼聚糖。取絮凝劑以0.1、0.2、0.4、0.6、0.8、1.0g/L七種濃度,添加到單針藻藻液中(OD680值約為2.5),其中殼聚糖組使用醋酸調節pH至5.5。混合液迅速攪拌數秒,每隔一段時間測定吸光度值,每組設置2個平行實驗,以絮凝效率衡量,計算公式如下:
絮凝效率(%)=(y0-yt)/(y0-b)×100
式中,y0為單針藻藻液的初始吸光度值,yt為時間t測得藻液吸光度值,b為標準曲線(y=ax+b)中截距b。
1.3.3 絮凝劑對單針藻細胞破壞程度的研究 取單針藻絮凝層,加入到24微孔細胞培養板中,采用倒置顯微鏡觀察單針藻細胞絮凝狀態,考察不同絮凝劑對單針藻細胞破壞程度。
2 結果與分析
2.1 單針藻藻體干重與光密度值的關系
不同濃度的單針藻藻液全波長掃描結果如圖1所示,由圖1可知,在濃度為0.3125、0.6250、1.2500、2.5000、5.0000g/L下,單針藻藻液最大吸收波長均為680nm,這一結果與目前大部分文獻中微藻培養檢測所采用的波長一致,由此可以確定單針藻培養過程中的檢測波長為680nm。
由單針藻藻體干重與光密度值的關系所得標準曲線如圖2所示,由圖2可知,在藻液濃度為0.05~1.2g/L的范圍內,單針藻藻體干重與吸光度值存在線性關系,即,y=2.06x+0.201,R2=0.9814。因此,在此濃度范圍內可根據所測得的吸光度值計算藻液中藻體干重。
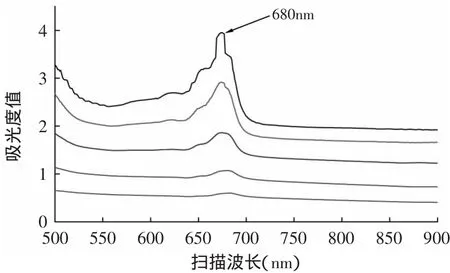
圖1 單針藻500~900nm下波譜掃描Fig.1 Spectrum of the absorbency of different concentrations of Monoraphidium sp.at differentwavelength
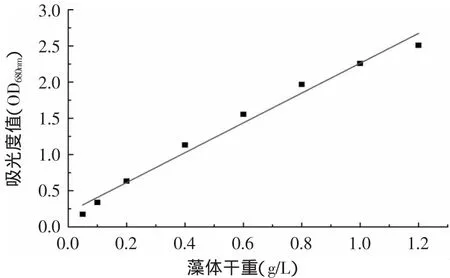
圖2 藻體干重與吸光度值的關系Fig.2 Relation of cell dry weight and OD680
2.2 不同絮凝劑對單針藻絮凝效率的研究
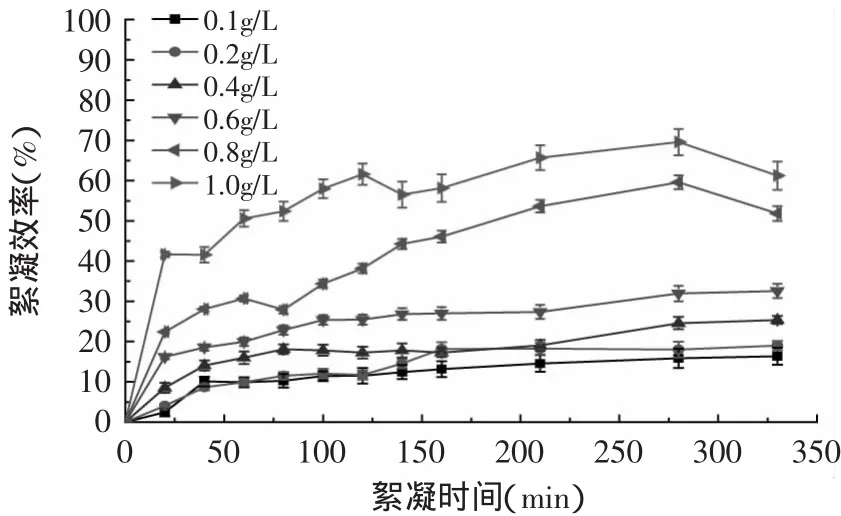
圖3 KA(l SO4)2對單針藻絮凝效率Fig.3 Flocculation efficiency of Monoraphidium sp.with aluminium potassium sulfate
2.2.1 KA l(SO4)2對單針藻的絮凝效率研究 如圖3所示,KAl(SO4)2對單針藻的絮凝效率隨濃度的增加而增強。當KAl(SO4)2濃度為0.1~0.6g/L時,絮凝效果不明顯,330m in后絮凝效率仍低于30%;當KA l(SO4)2濃度為0.8g/L時,280m in后55%以上的藻體絮凝;當KAl(SO4)2濃度為1.0g/L時,20min后40%以上的藻體絮凝,280m in后65%以上的藻體絮凝。KA l(SO4)2對不同微藻絮凝效率不同,對銅綠微球藻和牟氏角毛藻絮凝效率較高,而對湛江等鞭金藻絮凝效率較差[8]。本次實驗結果顯示高濃度的KAl(SO4)2對單針藻具有較好的絮凝效率,但消耗大量KA l(SO4)2會極大增加微藻生產成本,因此,KAl(SO4)2不適合用于單針藻大規模培養絮凝采收。
2.2.2 A l2(SO4)3對單針藻的絮凝效率研究 如圖4所示,A l2(SO4)3對單針藻的絮凝效率較高,隨著濃度的增加絮凝效果較為明顯。Al2(SO4)3濃度低于0.2g/L時,280m in后60%以上藻體絮凝;當A l2(SO4)3濃度大于0.4g/L時,單針藻藻體絮凝較快,10m in后70%以上的藻體絮凝,25m in后藻體完全絮凝。作為一種常用的無機絮凝劑,Al2(SO4)3在絮凝采收小球藻[9]、球等鞭金藻[10]、微綠球藻和三角褐指藻[11]等微藻時均獲得了較好的效果。本次實驗結果顯示A l2(SO4)3對單針藻具有較好的絮凝效果,可用于單針藻的絮凝采收。
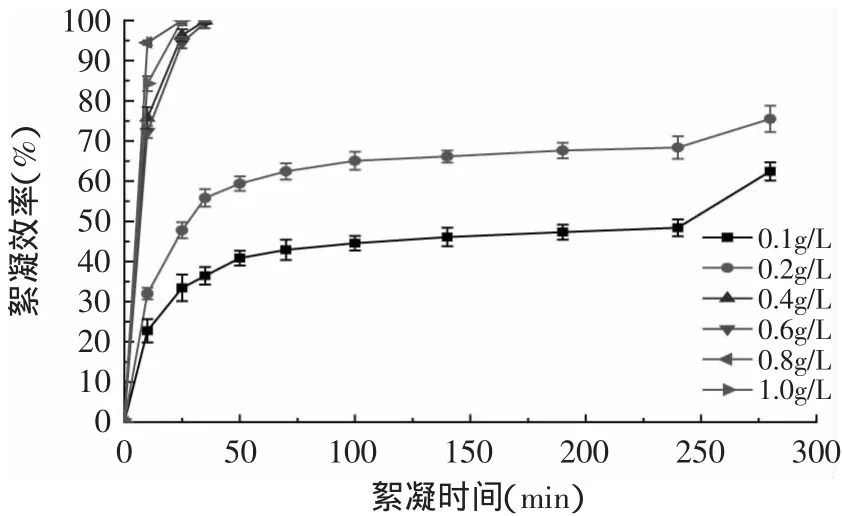
圖4 Al2(SO4)3對單針藻絮凝效率Fig.4 Flocculation efficiency of Monoraphidium sp.with aluminum sulfate
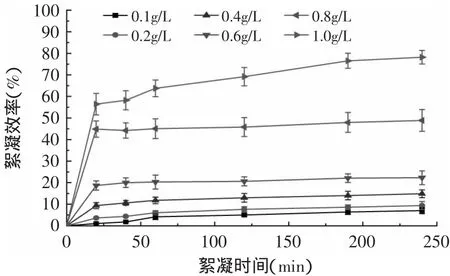
圖5 Ca(OH)2對單針藻絮凝效率Fig.5 Flocculation efficiency of Monoraphidium sp.with calcium hydroxide
2.2.3 Ca(OH)2對單針藻的絮凝效率研究 如圖5所示,Ca(OH)2對單針藻的絮凝效率較低,其絮凝效率隨濃度的增加而增大。當Ca(OH)2濃度低于0.6g/L時,240min后藻體絮凝效率低于20%,當Ca(OH)2濃度為0.8g/L時,20m in后有45%的藻體絮凝,但隨著時間的增加剩余藻體未絮凝;當Ca(OH)2濃度為1.0g/L時,240m in后有70%的藻體絮凝。實驗結果顯示低濃度Ca(OH)2對單針藻絮凝效率低,高濃度的Ca(OH)2能夠較好的絮凝單針藻,但由于Ca(OH)2濃度過高不僅會增加采收成本,還會極大增加藻液pH進而破壞藻體,因此不適合用于單針藻絮凝采收。
2.2.4 FeCl3對單針藻的絮凝效率研究 如圖6所示,在FeCl3濃度低于0.4g/L的條件下,單針藻的絮凝效率隨濃度的增加而增大,但FeCl3濃度高于0.6g/L時,絮凝效率下降。當FeCl3濃度為0.1g/L時,藻體10m in后即能絮凝40%,且隨著時間增加藻體基本不再絮凝;當FeCl3濃度為0.2~0.4g/L時,絮凝效果較好,25m in即能絮凝95%以上藻體,50min后藻體完全絮凝;當FeCl3濃度為0.6g/L時,絮凝效率下降,僅為80%,當濃度增加到0.8~1.0g/L時,絮凝效果不明顯,藻體在240m in后絮凝效率仍低于40%。絮凝劑過多不僅會破壞藻細胞,而且會使藻液中正電荷增多,過量的正電荷在系統中相互排斥,進而影響絮凝效果[9,12]。

圖6 FeCl3對單針藻絮凝效率Fig.6 Flocculation efficiency of Monoraphidium sp.with ferric chloride
2.2.5 AlCl3對單針藻的絮凝效率研究 如圖7所示,A lCl3對針藻的絮凝效率和FeCl3類似,隨A lCl3濃度的增加而增大,但過高的濃度會影響藻體的絮凝。當A lCl3濃度為0.1g/L時,藻體僅能絮凝25%;當A lCl3濃度為0.2g/L時,藻體僅能絮凝45%;當AlCl3濃度為0.4~0.8g/L時,藻體在20min后能完全絮凝;當AlCl3濃度增加到1.0g/L時,藻體基本不絮凝。

圖7 AlCl3對單針藻絮凝效率Fig.7 Flocculation efficiency of Monoraphidium sp.with aluminum chloride
2.2.6 聚丙烯酰胺對單針藻的絮凝效率研究 由圖8可知,聚丙烯酰胺對單針藻幾乎無絮凝作用。不同濃度下,藻液的沉降效果無明顯差異,240m in后藻體基本不絮凝。
2.2.7 殼聚糖對單針藻的絮凝效率研究 采用濃度梯度為0.1、0.2、0.4、0.6、0.8、1.0g/L的殼聚糖在pH=5.5的情況下絮凝單針藻,結果顯示,當濃度大于0.1g/L時,15m in后單針藻能夠完全絮凝。為考察殼聚糖最佳用量,設置濃度梯度為0.01、0.02、0.03、0.04、0.05g/L,結果如圖9所示,當殼聚糖濃度為0.01g/L時,絮凝效率僅為10%;當濃度為0.02、0.03g/L時,最終絮凝效率為70%;當濃度為0.04、0.05g/L時,15m in后絮凝效率為100%。由此可見,殼聚糖的最佳用量為0.04g/L。殼聚糖作為一種天然高分子化合物,生物相容性好,無毒,能夠生物降解,不會造成2次污染,使用殼聚糖采收的微藻可以應用于食品、醫藥和能源行業[13],利用殼聚糖絮凝采收微藻后上清液可以再次利用培養微藻[14]。研究證實,殼聚糖在收集微藻中取得較好的效果[15-16]。實驗結果顯示殼聚糖有望用作單針藻大規模培養采收絮凝濃縮試劑。
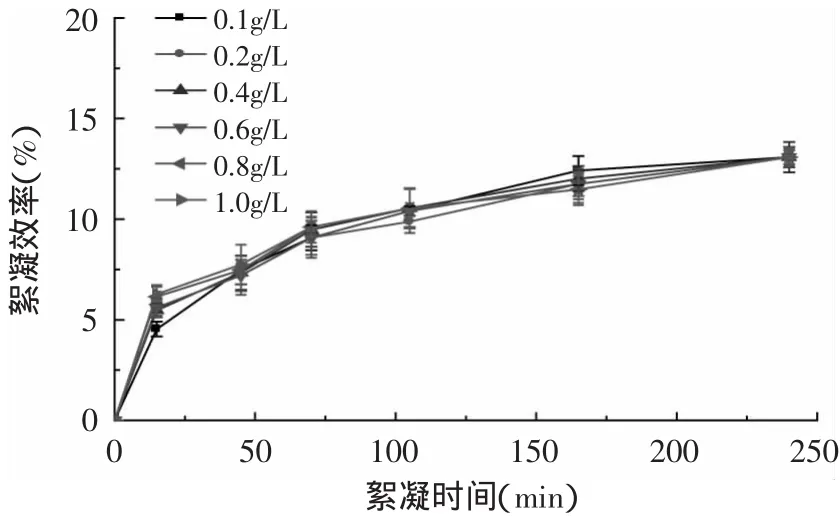
圖8 聚丙烯酰胺對單針藻絮凝效率Fig.8 Flocculation efficiency of Monoraphidium sp.with polyacrylamide
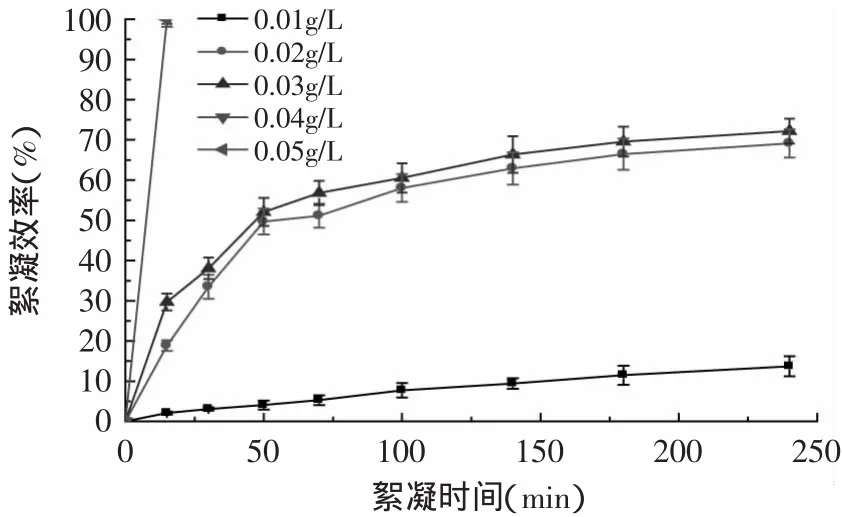
圖9 殼聚糖對單針藻絮凝效率Fig.9 Flocculation efficiency of Monoraphidium sp.with chitosan
2.3 絮凝劑對單針藻細胞完整性的影響
由不同絮凝劑對單針藻絮凝效率的研究可知,不同絮凝劑(聚丙烯酰胺除外)對單針藻的絮凝都有最適的絮凝濃度,本實驗選取各絮凝劑的最適濃度和(或)最高濃度進行細胞完整性實驗。取絮凝層藻液加入細胞培養板,采用倒置顯微鏡觀察,考察不同絮凝劑對單針藻細胞破壞程度,結果如圖10所示。
由圖10可知,Ca(OH)2對單針藻細胞破壞較嚴重,部分藻細胞破裂,藻液中出現較小的碎片(圖10d)。藻液中添加KA l(SO4)2、A l2(SO4)3后,單針藻細胞形成較大的絮凝塊,大部分細胞保持較好的完整性(圖10b~c)。向單針藻藻液中添加0.2g/L的FeCl3后,細胞絮凝較為明顯,細胞損傷較小(圖10e);當FeCl3濃度為1.0g/L,藻細胞呈均勻分散,細胞完整性較好,但藻細胞基本不絮凝(圖10f);單針藻細胞在高、低濃度FeCl3中呈現不同的絮凝狀態,可能原因是低濃度的FeCl3能夠通過吸附架橋和網捕沉淀作用使單針藻細胞形成較大的絮凝塊而沉淀,但過高濃度的FeCl3(>0.6g/L)引入過量正電荷形成了較為均勻的分散體系而使得藻細胞無法絮凝。添加0.4g/L的AlCl3后,藻細胞形成較大的絮凝塊,當A lCl3濃度增加到1.0g/L時,絮凝塊變小,且細胞出現脫水(圖10g~h),由此可見,高濃度的A lCl3會對單針藻細胞產生破壞而影響其絮凝效果。添加聚丙烯酰胺后細胞基本不絮凝,細胞形態也未受到影響(圖10i)。添加殼聚糖后,單針藻細胞呈現均勻的整體絮凝塊,細胞基本無損壞(圖10j)。從絮凝劑對細胞破壞程度來看,采用殼聚糖絮凝采收單針藻對藻細胞影響較小,因此,選擇殼聚糖為最佳絮凝劑。
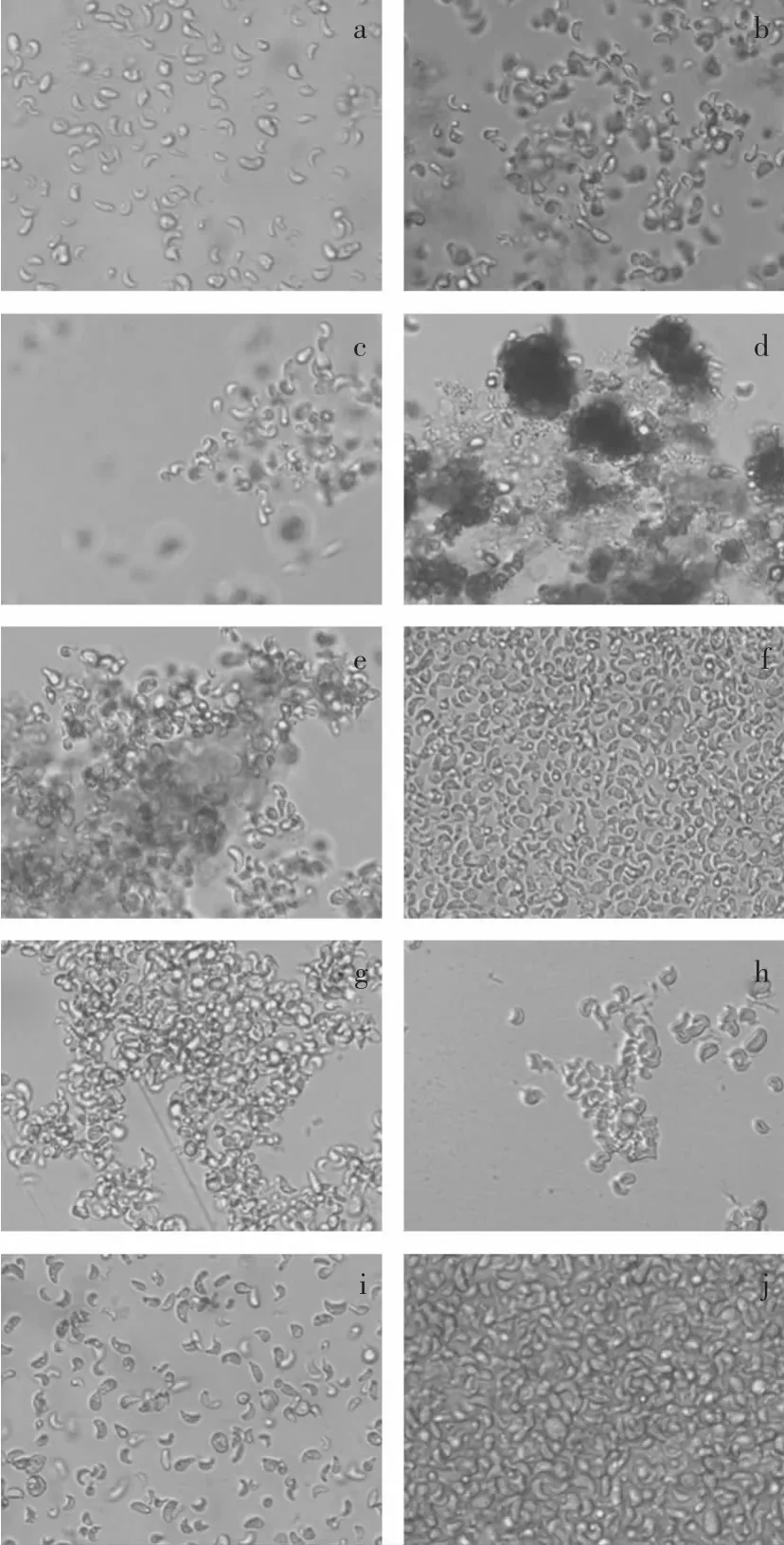
圖10 絮凝劑對單針藻細胞完整性的影響(×400)Fig.1 0 Effectof flocculants on Monoraphidium sp.cell integrity(×400)
3 結論
在所選7種試劑中,殼聚糖為單針藻濃縮采收的最佳試劑,當殼聚糖用量為0.04g/L時,15m in即能達到100%的絮凝效率,顯微鏡檢發現殼聚糖基本不破壞單針藻細胞。本次實驗殼聚糖的最低用量高于其他文獻[14,17],分析原因可能是藻種不同從而導致絮凝效率不同。對殼聚糖絮凝單針藻的實驗條件進行優化,減少其用量,進而降低生產成本將是后續實驗的研究重點。
在實驗濃度范圍內聚丙烯酰胺對單針藻細胞基本無絮凝作用。KAl(SO4)2和Ca(OH)2對單針藻絮凝效率較低,在實驗濃度范圍內隨著絮凝劑用量增加絮凝效率增加,當絮凝劑用量為1.0g/L時,在實驗測定時間內絮凝效率僅能達到70%;KA l(SO4)2對單針藻細胞損害較小,Ca(OH)2對單針藻細胞有較大的破壞。A l2(SO4)3、FeCl3、A lCl3絮凝效果較好,當用量分別為0.4、0.2、0.4g/L時,即能達到100%的絮凝效率,但過量的FeCl3、A lCl3反而不利于單針藻的絮凝;在實驗濃度范圍內,Al2(SO4)3、FeCl3對單針藻細胞損傷較小,高濃度的A lCl3(1.0g/L)會破壞單針藻細胞。
[1]Yu XY,Zhao P,He C,et al.Isolation of a novel strain of Monoraphidium sp.and characterization of its potentialapplication as biodiesel feedstock[J].Bioresource Technology,2012,121:256-262.
[2]Bogen C,Klassen V,Wichmann J,et al.Identification of Monoraphidium contortum as a promising species for liquid biofuel production[J].Bioresource Technology,2013,133:622-626.
[3]黃力,賀賜安,趙鵬,等.碳源、氮源對異養單針藻Monoraphidium sp.FXY-10油脂積累和脂肪酸組成的影響[J].2013,中國生物工程雜志,2013,33(2):59-64.
[4]Fujii K,Nakajima H,Anno Y.Potential of Monoraphidium sp.GK12 for energy-saving astaxanthin production[J].Journal ofChemical Technology and Biotechnology,2008,83(11):1578-1584.
[5]Danquah M,Gladman B,MoheimaniN,etal.Microalgalgrowth characteristics and subsequent influence on dewatering efficiency [J].Chemical Engineering Journal,2009,151(1-3):73-78.
[6]Zittelli GC,Rodolfi L,Biondi N,et al.Productivity and photosynthetic efficiency of outdoor cultures of Tetraselmis suecica in annular columns[J].Aquaculture,2006,261(3):932-943.
[7]Salim S,Bosma R,Vermue MH,etal.Harvesting ofmicroalgae by bio-flocculation[J].Journal of Phycology,2011,23(5):849-855.
[8]黃振華,柯愛英,池偉,等.7種試劑對3種餌料微藻絮凝效應的研究[J].安徽農業科學,2010,38(15):7734-7736.
[9]薛蓉,陸向紅,盧美貞,等.絮凝法采收小球藻的研究[J].可再生能源,2012,30(9):80-84.
[10]柯愛英,黃振華,池偉,等.球等鞭金藻3011絮凝效應的研究[J].安徽農業科學,2010,38(29):16271-16273.
[11]季高華,王麗卿,張瑞雪.四種化學試劑對三種藻液的濃縮實驗[J].水產科技情報,2006,33(4):157-160.
[12]劉振強.微藻優化培養、采收及沼液培養微藻的研究[D].浙江:浙江工業大學,2012.
[13]李若慧,葉曉,程艷玲.殼聚糖絮凝微藻富集的研究進展[J].安徽農業科學,2012,40(3):1626-1628.
[14]張鵬,李興銳,張永奎.用殼聚糖絮凝法采收小球藻及上清液再利用的研究[J].大連海洋大學學報,2012,27(2):162-165.
[15]RenaultF,Sancey B,BadotPM,etal.Chitosan for coagulation/ flocculation processes-An eco-friendly approach[J].European Polymer Journal,2009,45(5):1337-1348.
[16]翟珗,楊哲,安陽,等.殼聚糖凝聚去除景觀水中微囊藻的研究[J].凈水技術,2009,28(6):58-60,68.
[17]Ahmad AL,Mat Yasin NH,Derek CJC,etal.Optimization of microalgae coagulation process using chitosan[J].Chemical Engineering Journal,2011,173(3):879-882.

