水源地水庫沉積物中生物硅的測定
李世雄,郭沛涌,明迅,韓文亮
(華僑大學 化工學院,福建 廈門361021)
生物硅(biogenic silica)是指生源無定形硅,主要由硅藻、海綿骨針和金藻等硅質浮游植物形成,它們吸收利用水中的溶解性硅酸鹽硅Si(OH)4,在體內的同化作用下形成硅質細胞壁.由于人類活動,水體中兩大重要營養元素N,P的輸入不斷增加,為水華爆發提供了物質基礎,導致了硅質浮游植物生物量的增加,加速生物硅的沉積.隨著水體中溶解態硅的不斷消耗,將會造成硅藻生長的硅限制,從而降低硅藻在浮游植物群落中的數量,并發生非硅質有害藻華,如棕囊藻(Phaeocystissp.)、膝溝藻(Gonyaulaxsp.)、金色藻(Chrysochromulinasp.)等 .這些有毒藻類會釋放出多種藻毒素,同時藻華也會造成水體缺氧,增加水體的渾濁度和過量毒性物質的產生[1],給水源及人類健康帶來威脅,危害飲用水的供水安全.生物硅在沉積物中的積累,還可反映不同歷史時期由于人類活動導致的水體的富營養化情況[2],也可用于表征上層水體中硅質種群的生產力狀況[3-4],其產率也反映了水庫區域的水質環境條件 .因此,生物硅的測定對于保證水源地水庫水環境健康有重要的參考價值.但是由于缺乏標準品,對于生物硅的測定還沒有一個普遍被接受的方法,各國學者所采用生物硅測定方法各不相同[5-8].生物硅的研究主要集中在海洋方面,有關水源地水庫沉積物中生物硅的測定還未見報道.因此,本文在前人對海洋沉積物中的生物硅測定的研究基礎上,通過實驗建立一套針對水源地水庫沉積物中的生物硅的Na2CO3堿液提取的測定方法.
1 材料與方法
1.1 儀器和試劑
1.1.1 儀器 UV-VIS 2550型紫外可見分光光度計(日本島津公司),KQ3200DE型數控超聲波清洗器(江蘇蘇州江東精密儀器有限公司),HH-4型數顯恒溫水浴鍋(江蘇金壇恒豐儀器制造有限公司),L-550型臺式低速大容量離心機(湖南湘儀離心機儀器有限公司).
1.1.2 試劑 鹽酸、過氧化氫、鉬酸銨、硫酸、草酸、對甲氨基酚硫酸鹽、硝酸、亞硫酸鈉、碳酸鈉、氟硅酸鈉、氫氟酸(均為分析純,上海國藥集團化學試劑有限公司);超純水(電阻率為18.2 MΩ·cm).
所有試劑均儲存在聚乙烯瓶中,離心管為50 m L的聚丙烯管,使用前用硝酸-氫氟酸洗液清洗,玻璃儀器使用鉻酸清洗.
1.2 分析方法
活性硅酸鹽的檢測采用GB 17378.4-2007《海洋監測規范》中的硅鉬藍法.使用在105℃烘干1 h的氟硅酸鈉配制硅標準溶液,其標準曲線如圖1所示.
1.3 生物硅樣品采集
2011年5月在石兜-坂頭水庫石兜庫區設置8個采樣站位,如圖2(a)所示 .圖2(a)中:站位S8位于庫區進水口;站位S6~S7位于庫區上游;站位S4~S5位于庫區中游;站位S2~S3位于庫區下游;站位S1位于庫區出水口(大壩前).
在石兜-坂頭水庫坂頭庫區設置7個采樣站位,如圖2(b)所示 .圖2(b)中:站位B1位于庫區進水口;站位B2~B4位于庫區上游;站位B5位于庫區中游;站位B6位于庫區下游;站位B7位于庫區出水口(大壩前).
利用彼得遜采泥器獲得水庫的表層沉積物樣品.風干后,研磨過200目篩,用樣品袋保存待測.在采集沉積物樣品同時采集水庫表層水,分析其總氮、總磷.
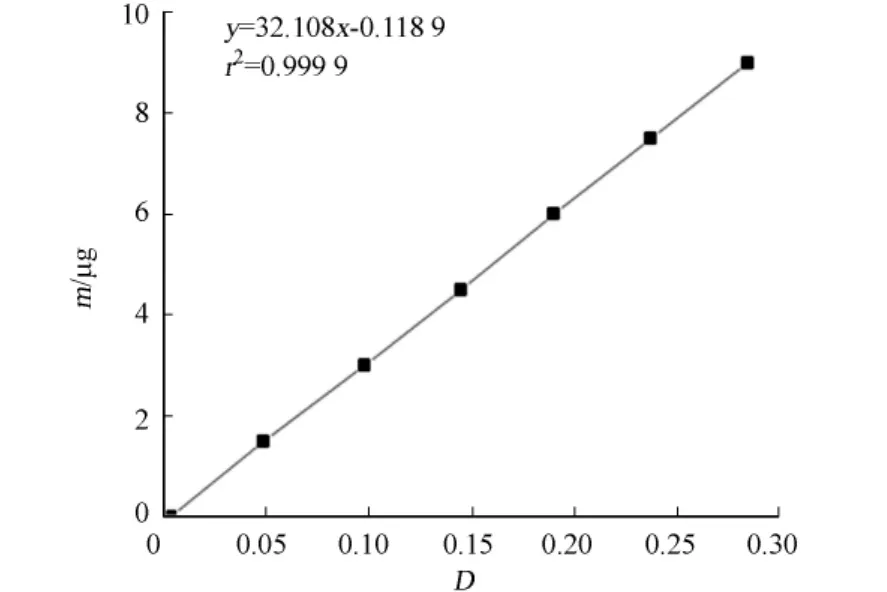
圖1 硅標準曲線Fig.1 Silica standard curve
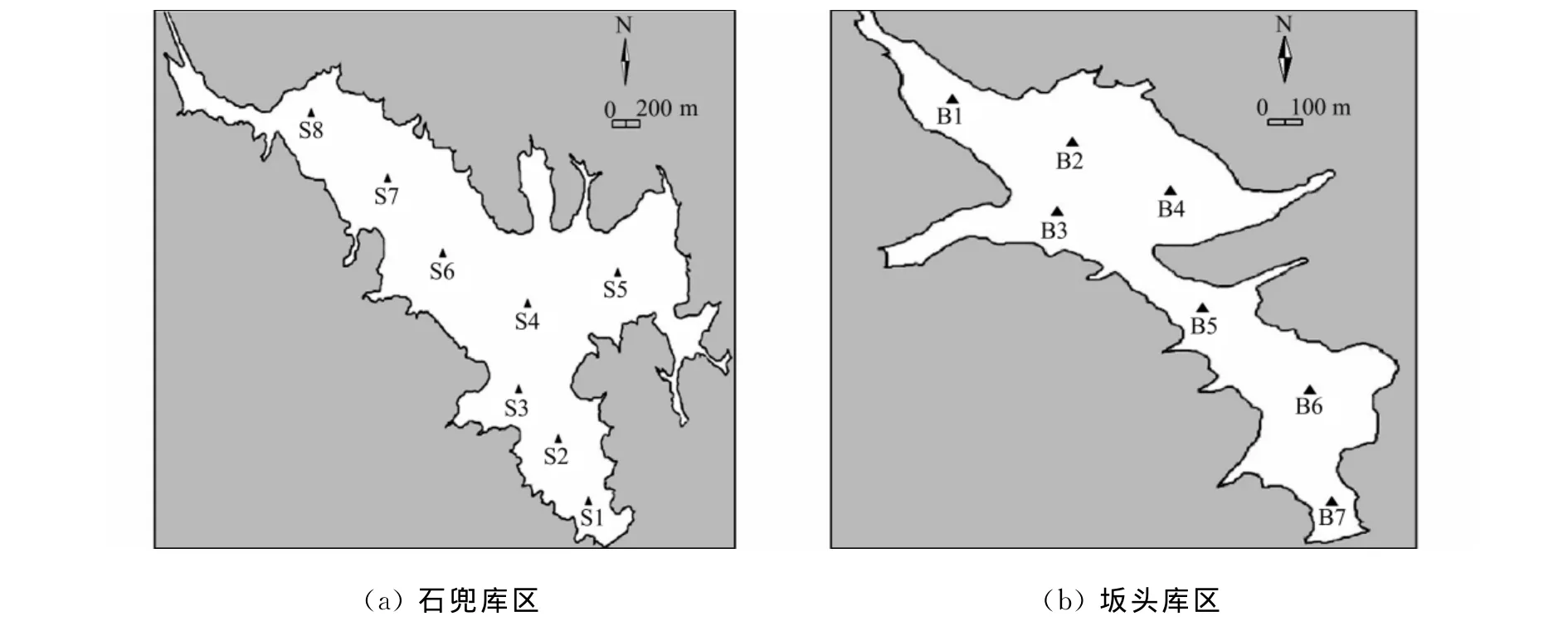
圖2 采樣點分布圖Fig.2 Distribution diagrams of sampling sites
2 結果與討論
2.1 樣品預處理過程的優化
根據預處理過程設計了如下3組不同的流程:第1組是樣品經過全部預處理;第2組是樣品不經過任何預處理;第3組是樣品僅經過10%的H2O2和1.0 mol·L-1的HCl處理.
全部預處理流程即使用10%的H2O2和1.0 mol·L-1的HCl去除碳酸鹽和有機質等稀釋相,分散沉積物使其與溶液充分接觸,有利于生物硅的溶出;然后,離心并移除上清液,加入超純水洗滌,離心移除上清液,樣品放入烘箱,在60℃下烘干12 h.由于樣品中仍然含有大量的粘土礦物,因此不能將樣品干燥至發硬,而應保持濕潤以便提取時分散樣品.
實驗結果發現:第1組經過全部預處理的樣品測得的生物硅質量分數為(2.15±0.050)%,比第2組未進行預處理的樣品質量分數為(2.29±0.026)%要低.這是因為經過12 h的烘干,樣品已完全干燥,樣品再次結塊不利于樣品的分散及生物硅的提取 .第3組僅經過H2O2和HCl處理的樣品所測得的生物硅質量分數最高為(2.84±0.035)%.這是因為經過預處理,使得沉積物表面的鐵、鋁皮膜去除,有利于生物硅的進一步溶出,且由于沒有進行烘干處理,樣品在提取液中的分散性好.
經過H2O2和HCl處理有利于樣品中生物硅的溶出,而烘干過程中要使得樣品還保持在濕潤狀態,條件較難控制,會造成樣品不同程度的再結塊 .因此對于預處理過程,僅使用H2O2和HCl對樣品進行處理,但不進行烘干處理.
2.2 提取液濃度對于生物硅提取的影響
考慮到石兜-坂頭水庫沉積物的沉積年齡新,且主要是硅藻為主的生物硅沉積物樣品,分別考察提取液碳酸鈉不同濃度(c)對生物硅提取的影響,結果如圖3所示.圖3中:w為生物硅的質量分數.
由圖3可知:隨著提取液濃度的增大,生物硅質量分數也隨之逐漸增大;當提取液濃度在0.1~1.0 mol·L-1變化時,生物硅量增加的量較大;而當提取液濃度在1.0~2.0 mol·L-1變化時,生物硅質量分數幾乎沒有變化,曲線斜率較小,溶出的速度極慢,溶出與吸附已接近平衡.因此,使用1.0 mol·L-1的碳酸鈉溶液作為提取液.
2.3 提取溫度對于生物硅提取的影響
在提取液為1.0 mol·L-1碳酸鈉溶液的條件下,生物硅的溶出量會隨著溫度的升高而不斷增加,特別是在40℃以后,硅的溶出量會成倍地增加.分別考察不同提取溫度(t)對生物硅提取的影響,結果如圖4所示.
由圖4可知:當提取溫度從80℃升高到100℃時,測得的生物硅質量分數增加了74.42%.溫度過低會限制生物硅的溶出,溫度高會加速生物硅溶解,但與此同時也加大非生物硅的干擾程度.在堿液提取后,用顯微鏡觀察樣品,發現85℃條件下提取的沉積物樣品中的微化石已經完全溶解,而90,95,100℃條件下測得的生物硅質量分數較高,主要是非生物硅組分(如粘土礦物中的硅)的溶出造成干擾所致.因此,選擇85℃作為生物硅的最優提取溫度.

圖3 提取液濃度對于生物硅提取的影響Fig.3 Influence of extracting liquid concentration on biogenic silica extraction

圖4 提取溫度對于生物硅提取的影響Fig.4 Influence of extracting temperature on biogenic silica extraction
2.4 固液比對于生物硅提取的影響
固液比變化對于生物硅測定的影響是十分明顯的.在40 m L,1 mol·L-1Na2CO3提取液中,考察不同固液比(ρ)對生物硅提取的影響,結果如圖5所示.
由圖5可見,固液比變化對生物硅測定值的影響非常明顯的.同一濃度提取液提取不同質量的樣品,隨著取樣量增加,所提取的生物硅量逐漸減少.當取樣量從20 mg增至50 mg時,測得的生物硅質量分數下降了30%左右;當增至100 mg,測得的生物硅質量分數下降了50%.
造成生物硅減小可能有兩個原因 .其一是吸附損失影響.隨著取樣量的增加,固液比也在不斷升高,樣品在提取過程中溶解的硅可能會重新吸附回樣品表面,溶解硅向沉積物表面的不可逆吸附引起了生物硅的損失使得測定結果偏小.其二是樣品與提取液接觸面積的影響.當樣品取樣量增大時,樣品無法與提取液充分接觸,因而測得生物硅值相對偏低.但固液比過小的提取液會加快沉積物中非生物硅的過度溶出,造成對實驗結果的干擾.
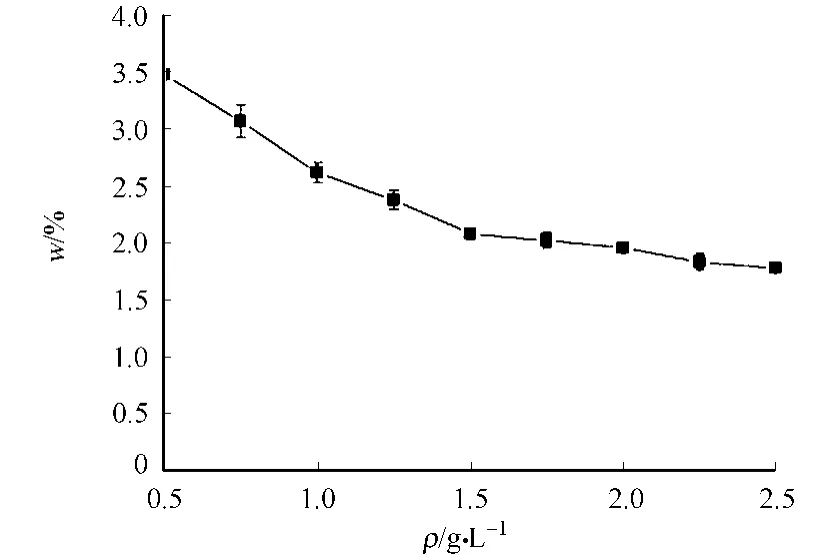
圖5 固液比對于生物硅提取的影響Fig.5 Influence of solid/liquid ratio on biogenic silica extraction
因此,針對固液比對于生物硅測定的影響,可以通過使用50 m L圓底離心管增大樣品與提取液的接觸面積.有研究表明,當固液比在0.625~2.500 g·L-1范圍內,不存在明顯的吸附損失[9].鏡檢結果發現,固液比為0.75 g·L-1的樣品中沒有微化石殘存 .因此,選定石兜-坂頭水庫沉積物生物硅測定的固液比為0.75 g·L-1,即取樣量為30 mg.
2.5 正交實驗
結合上述的單因素試驗結果,以預處理方式(A)、提取液濃度(B)、提取溫度(C)及固液比(D)為因素,選用L9(34)正交實驗表(表1)設計正交實驗,對生物硅的提取進行工藝優化,結果如表2所示.表1中:預處理方式的1~3分別代表樣品經過全部預處理,不經過任何預處理和僅經過10%的H2O2和1.0 mol·L-1的 HCl處理 .表2中:γ為生物硅的提取率.
由表2可知:影響生物硅提取的因素的主次順序為預處理>固液比>溫度>濃度;預處理最優水平是僅經過H2O2和HCl處理的樣品,固液比為0.5 g·L-1,提取溫度為90℃,提取液濃度為0.8 mol·L-1.方差檢驗發現:在a=0.10水平上,4個因素對生物硅測定的影響都不顯著 .這主要是由于誤差自由度小,使檢驗的靈敏度降低,掩蓋了考察因素的統計學意義.

表1 正交水平因素表Tab.1 Orthogonal level factors table

表2 正交實驗結果Tab.2 Result of orthogonal text
根據正交實驗的結果,可以發現提取溫度、固液比對生物硅測定的影響分別隨著因素水平的不斷增大而增大和減小,不能作為確定該因素適宜水平的依據 .在實驗范圍內,提取液濃度對生物硅測定的影響最小.正交實驗中,對于F檢驗不顯著的因素,適宜的水平可以是任意的.因此,結合單因素實驗和正交實驗,選擇最優實驗條件:預處理方式為僅使用HCl和H2O2對樣品進行預處理;提取液碳酸鈉濃度為1 mol·L-1;提取溫度為85℃;固液比為0.75 g·L-1.
根據前述分析的提取實驗條件,確定了如下的水源地水庫沉積物生物硅的測定方法.
1)準確稱取30 mg樣品,置于50 m L的聚丙烯離心管中,加入5 m L,10%的H2O2,放置30 min,再加入5 m L,1.0 mol·L-1的HCl,封蓋并超聲波震蕩30 min;然后,在相對離心力為4 200 g條件下離心5 min,棄上清液.最后,再加入20 m L超純水洗滌,充分搖勻,使沉積物樣品分散完全,在相對離心力為4 200 g條件下,離心5 min,棄上清液,以去除殘余H2O2和HCl.
2)加入40 m L碳酸鈉溶液,封蓋后,放置于85℃水浴鍋中提取生物硅.在水浴過程中每隔1 h搖勻一次,水浴結束后立即取出聚丙烯離心管,在相對離心力為4 300 g條件下,離心5 min.然后,吸取一定的上清液進行測定.
每個采樣點沉積物樣品設定3個平行樣,生物硅測定結果的相對標準偏差均小于10%.
3 水源地水庫生物硅的測定
水庫表層沉積物中的生物硅主要來源于硅藻,通過硅藻可以指示硅藻生物量的空間分布情況,從而推斷出水庫營養鹽的變動過程以及初級生產力的水平分布情況.為了檢驗該方法的適用性,對福建廈門市一級水源保護地石兜-坂頭水庫的沉積物樣品進行采樣分析,庫區生物硅質量分數分布如圖6所示.采樣站點的布設如圖2所示.
由圖6可知:石兜-坂頭水庫的石兜庫區的生物硅質量分數為(3.44±0.12)%~(6.25±0.04)%,平均值為4.48%;坂頭庫區的生物硅質量分數為(3.06±0.02)%~(7.30±0.48)%,平均值為4.73%.兩個庫區出水口區域(石兜1~3號采樣站點,坂頭6,7號采樣站點)生物硅質量分數較高,這主要是因為隨著過水面積增大,水流流速從庫尾到壩前逐漸減緩,泥沙與硅質類浮游生物不斷沉積;入水口區域(石兜6~8號采樣站點,坂頭1,2號采樣站點)都是水庫的入流區域,水體淺且水流流速大,水庫底部受到強烈的沖刷,沉積物多為侵蝕殘留的物質;石兜庫區3號采樣站點生物硅質量分數高,主要是由于3號采樣站點處于一支流的入庫并流區域,該支流流域的山坡地、耕地種植水果、茶葉及農作物等,受到農業面源污染較為嚴重,硅藻類浮游植物生長迅速并且沉積到水庫底部.
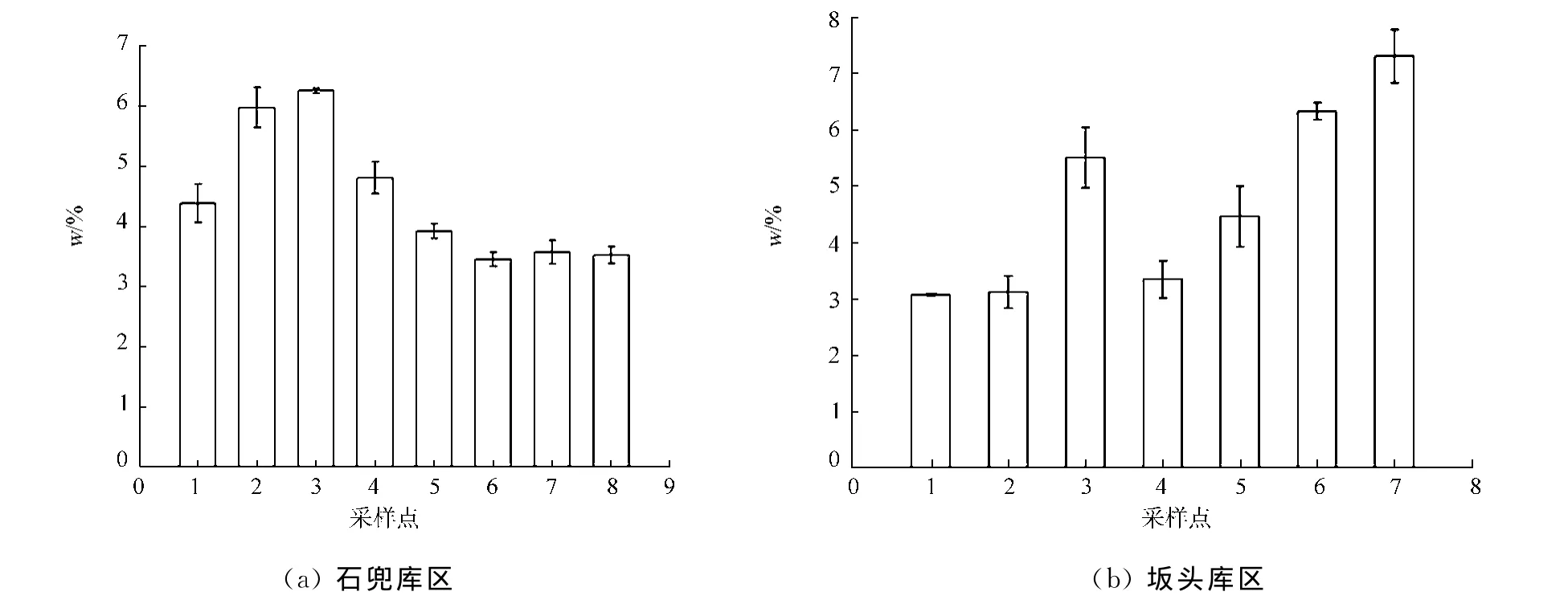
圖6 庫區生物硅質量分數分布Fig.6 Content distribution of biogenic silica in reservoir
與長江口[10]、膠州灣[11]等相比,石兜-坂頭水庫沉積物中的生物硅質量分數較高,這主要是由于湖內的硅藻類浮游植物的大量增長,使得生物硅在沉積物中的積累增加.生物硅質量分數可以作為硅藻生產力的一個指標,進而代表全部浮游植物的生產力水平 .石兜-坂頭水庫沉積物中相對較高的生物硅質量分數,說明該水庫擁有較高的初級生產力水平.石兜庫區表層水中的總磷和總氮的平均質量濃度為0.037 mg·L-1和0.233 mg·L-1,坂頭庫區表層水的總磷和總氮的平均質量濃度為0.043 mg·L-1和0.256 mg·L-1.由此可以發現,上層水體中的氮、磷營養鹽質量分數相對較少,這主要是由于高生產力消耗了水體中的營養鹽.春季的石兜-坂頭水庫處于低溫,低強度光照和高濁度,高營養鹽濃度的狀態,這種條件十分適合硅藻的生長,大量硅藻的生長消耗了水庫水體中大量的營養鹽.綜合可知,水源地水庫沉積物中的生物硅質量分數與水庫的初級生產力是相對應的,并且這一對對應關系可以通過氮、磷營養鹽的狀況體現出來.
4 結束語
針對水源地水庫沉積物中的生物硅的測定建立了一套測定方法:使用HCl和H2O2對樣品進行預處理,然后利用1 mol·L-1的碳酸鈉溶液在85℃水浴條件下進行單點提取,固液比為0.75 g·L-1.該方法優化了樣品的預處理過程,使得測定過程更加簡便、準確.通過對廈門一級水源保護地石兜-坂頭水庫的沉積物樣品的測定,證明了該方法的適用性,可以應用于其他類似水源地水庫沉積物中生物硅的測定,為水庫的營養鹽變動和初級生產力分布的監測,防治水源水體富營養化提供了科學工具.
[1] STRUYF E,SMIS A,DAMME S V,et al.The global biogeochemical silicon cycle[J].Silicon,2009,1(4):207-213.
[2] WESSELS M,MOHAUPT K,KüMMERLIN R,et al.Reconstructing past eutrophication trends from diatoms and biogenic silica in the sediment and the pelagic zone of Lake Constance,Germany[J].Journal of Paleolimnology,1999,21(2):171-192.
[3] PENSA M A,CHAMBERS R M.Trophic transition in a lake on the virginnia coastal plain[J].Journal of Enviromental Quality,2004,33(2):576-580.
[4] KRAUSE J W,NELSON D M,BRZEZINSKI M A.Biogenic silica production and the diatom contribution to primary production and nitrate uptake in the eastern equatorial Pacific Ocean[J].Deep Sea Research PartⅡ:Topical Studies in Oceanography,2010,58(3/4):434-448.
[5] CONLEY D J.An interlaboratory comparison for the maesurement of biogenic silica in sediments[J].Marine Chemistry,1998,63(1/2):39-48.
[6] OHLENDORF C,STUR M M.A modified method for biogenic silica determination[J].Journal of Paleolimnol,2008,39(1):137-142.
[7] SCHLüTER M,SAUTER E.Biogenic silica cycle in surface sediments of the Greenland Sea[J].Journal of Marine Systems,2000,23(4):333-342.
[8] KHALIL K,RABOUILLE C,GALLINARI M,et al.Constraining biogenic silica dissolution in marine sediments:A comparison between diagenetic models models and experimental dissolution rates[J].Marine Chemistry,2007,106:223-238.
[9] GEHLEN M,RAAPHORST W.Early diagenesis of silica in sandy North Sea sediment:Quantification of the solid phase[J].Marine Chemistry,1993,42(2):71-83.
[10] 侯立軍,劉敏,閆惠敏,等.長江口潮灘沉積物生物硅的分布及其影響因素[J].中國環境科學,2007,27(5):665-669.
[11] 李學剛,宋金明,袁華茂,等.膠州灣沉積物中高生源硅含量的發現:膠州灣浮游植物生長硅限制的證據[J].海洋與湖沼,2005,36(6):572-579.

