磷石膏分解制備硫化鈣的試驗分析
鄭紹聰,寧 平,成飛翔,賀池先
(1.曲靖師范學院 化學化工學院,曲靖 655011;2.昆明理工大學 環境科學與工程學院,昆明 650093)
磷石膏分解制備硫化鈣的試驗分析
鄭紹聰1,寧 平2,成飛翔1,賀池先1
(1.曲靖師范學院 化學化工學院,曲靖 655011;2.昆明理工大學 環境科學與工程學院,昆明 650093)
在N2氣氛下進行磷石膏還原分解制備硫化鈣的研究,選擇粒度分析儀測定原料粒徑大小,XRD和掃描電鏡表征原料和分解物固相特征。考察了原料摩爾配比、反應溫度、反應時間和反應氣氛等對磷石膏還原分解制備硫化鈣的影響。結果表明:在N2氣氛下,通過無煙煤過量形成充分的還原性氣氛,磷石膏中硫酸鈣被C或CO還原生成硫化鈣。最佳的反應條件∶無煙煤∶磷石膏(C∶S)=2.4∶ 1;反應最佳溫度900~1 000℃;反應時間2 h,磷石膏轉化率可達97.60%。
磷石膏;無煙煤;熱分解;硫化鈣
磷石膏是濕法磷酸生產過程中磷礦與硫酸反應生成的工業廢渣,每生產1 t磷酸約產生4~5 t磷石膏[1-2]。磷石膏的主要成分CaSO4·2H2O,硫含量大于20%,CaO含量達到40%以上,是一種優質的硫和鈣資源[3]。2010年中國國際磷石膏堆放及綜合利用技術開發與推廣研討會在北京召開,關于磷石膏熱分解研究仍是磷石膏應用研究的熱點問題之一。四川大學開展以硫為還原劑分解磷石膏制取高濃度SO2的研究[4],與傳統煤為還原劑研究成果相比,磷石膏分解溫度更低,SO2體積濃度≥12%;昆明理工大學開展高硫煤還原磷石膏制SO2聯產水泥熟料的研究,提高了分解尾氣SO2濃度,并進行中試研究[5];劉少文,鄭敏,Peter Lewis Silveston等[6-10]進行磷石膏熱分解的研究,為磷石膏熱分解技術提供了可供參考實驗數據。然而,上述研究工作仍停留在實驗室和理論階段[11-12],磷石膏工程化應用研究還有待繼續。總之,從磷石膏中回收硫和鈣資源[13-14],無論對環境保護或資源回收利用,還是為了磷肥工業的可持續發展均具有重要的意義。
采用磷石膏制硫酸聯產水泥熟料技術研發,實現了磷石膏中硫鈣資源的循環利用。國內最早實現磷石膏制硫酸聯產水泥原料技術的單位是山東魯北集團[15],由于磷石膏中CaSO4含量變化大,雜質多而雜,工藝條件難以穩定控制,SO2轉化率低、能耗高等缺點[16],使得該技術推廣較為困難。本文擬進行無煙煤還原磷石膏制備CaS,再通過CaS反應制備硫化氫和鈣鹽,實現磷石膏資源的綜合利用。
1 實驗原理
根據磷石膏還原分解制備硫化鈣的研究思路[8],磷石膏可能發生的化學反應式如下
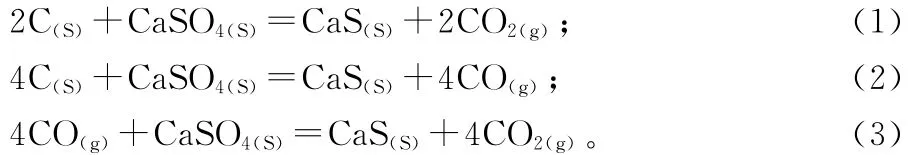
根據物料守恒原理,1 mol CaSO4對應生成1 mol CaS,所以磷石膏還原制備硫化鈣的轉化率X可按下式計算

M是磷石膏還原后硫化鈣成品的摩爾量,mol;M0是參與反應的磷石膏中硫酸鈣的摩爾量。磷石膏還原制硫化鈣研究以轉化率作為主要指標,同時考慮摩爾配比、反應溫度和反應時間等影響因素。
2 材料與方法
2.1 實驗儀器
中美合資合肥科晶材料技術有限公司生產GSL1600X高溫管式爐;德國馬爾文儀器有限公司Nano-ZS90激光衍射粒度分析儀;北京光學儀器廠WRT-2C智能型熱重分析儀;固相產物物相表征使用日本制造的Shimadzu XD-5A型X射線衍射儀(XRD);日本JSM-6301F型掃描電鏡。
2.2 實驗原料
磷石膏是濕法磷酸生產過程中的副產物,樣品取自云天化集團下屬富瑞化工廠,樣品經自然風干、篩分等預處理,化學成分見表1。經預處理后的磷石膏為粉狀顆粒,采用德國激光粒度測定儀對磷石膏顆粒級配進行了測定,結果見圖1及表2。
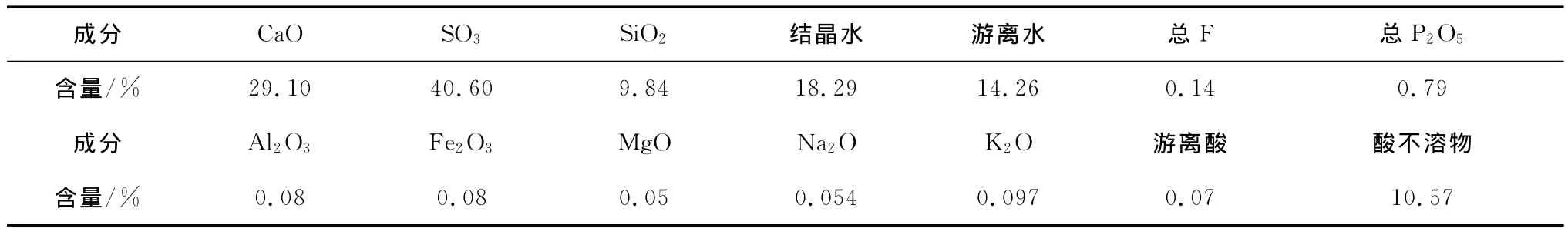
表1 磷石膏的化學成分%
根據磷石膏粒徑分布曲線圖1,磷石膏顆粒粒徑分布呈正態分布,主要集中在100~250μm之間。根據磷石膏粒度分布表2,磷石膏粒徑分布在95~300μm之間,其平均粒徑為117μm。
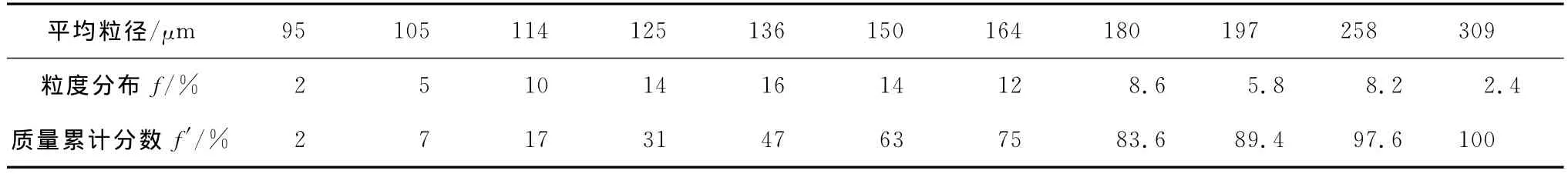
表2 磷石膏粒度分布
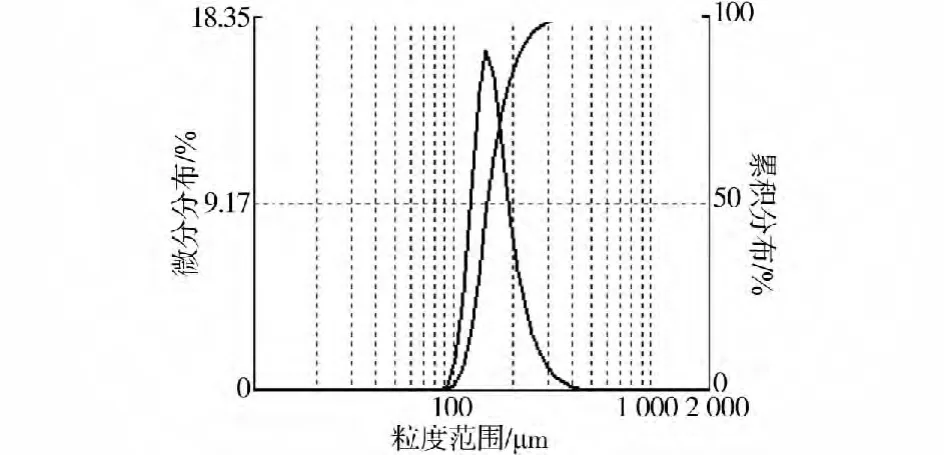
圖1 磷石膏粒徑分布曲線
無煙煤采自云南安寧某煤礦,樣品經風干后破碎,制成不同顆粒尺寸樣品,主要化學組成見表3。

表3 無煙煤的化學成分
2.3 實驗方法
稱取一定量磷石膏與煤粉,混均,壓實后放入坩堝,連接好實驗裝置,通入100 m L/min N2作為保護氣氛,實驗過程中通過給坩堝加蓋制造相對密閉的小空間,可以有效制造出還原氣氛,在高溫條件下通過反應式(1)~(3)還原制備硫化鈣。
3 結果與討論
3.1 無煙煤還原磷石膏熱重分析
磷石膏與煤粉分別過100目標準篩,按C與S摩爾比為2∶1混勻,摸擬實驗室電阻爐的升溫速率進行非等溫熱重實驗。設定升溫速率:在25~800℃范圍內以10℃/min升溫、在800~1 100℃以5℃/min升溫;N2流量:50 mL/min。熱反應失重曲線如圖2。
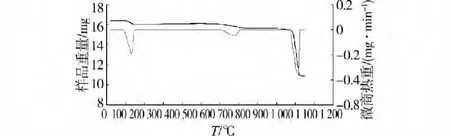
圖2 磷石膏與煤粉熱反應失重曲線
由圖2可知,DTG的2個峰與TG曲線上失重的臺階相對應,TG/DTG曲線表明磷石膏在溫度20~1 100℃范圍內的熱分解分2步進行。第一步失重的溫度范圍為120~200℃,失重率為10~15%,是磷石膏失去2個結晶水的過程,與文獻報到的一致;第二步失重的溫度范圍為900~1 100℃,主要集中在1 000℃范圍內。采用XRD分析分解固體樣品,結果見圖3,CaS峰值最大,CaO和CaSO4峰值最小,說明分解樣渣中主要產物為CaS,含有少量CaO和未分解的CaSO4。結果說明在溫度范圍為800~1 000℃時,磷石膏發生了生成硫化鈣的主反應。
3.2 摩爾配比的影響
為了研究磷石膏摩爾比對實驗的影響,設定反應溫度900℃和反應時間2 h,按實驗方法2.3進行實驗。實驗過程中通過壓實制塊使物料之間接觸緊密,大大增加磷石膏片狀晶體與煤粉塊狀顆粒之間的接觸面積,減小顆粒間距,有利于磷石膏的還原分解反應。在金相顯微鏡下觀察磷石膏與煤粉顆粒的接觸方式,結果見圖4。
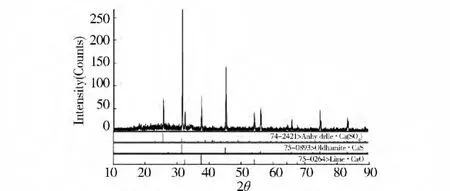
圖3 熱重產物的XRD分析

圖4 磷石膏與煤粉混合物掃描電子顯微相圖
從圖4中可以看出,細小的片狀磷石膏晶體不規則地粘附在煤粉顆粒表面。經過壓實制塊可以使磷石膏晶體緊密粘附在煤粉顆粒表面,大大增加磷石膏與煤粉的接觸面積,減小顆粒間距。
準確稱取10 g磷石膏,考察無煙煤煤粉過量0%、5%、10%、15%、20%和25%(即 C∶S分別為2∶1、2.1∶1、2.2∶1、2.3∶1、2.4∶1和2.5∶1)時,磷石膏還原制備CaS的影響,結果如圖5。

圖5 碳過量百分比對轉化率的影響
由圖5可知,轉化率隨著煤粉用量的增加而不斷增加,但遞增的幅度卻越來越小。當煤粉的用量超過20%時,轉化率增加不大。綜合考慮,選擇C過量20%作為后續實驗研究的優選配比,在此條件下磷石膏轉化率達到95.30%以上。
3.3 反應溫度的影響
設定反應時間2 h,無煙煤與磷石膏摩爾配比2.4∶1,按實驗方法2.3。考察反應溫度對磷石膏還原制備CaS的影響,實驗結果如圖6。
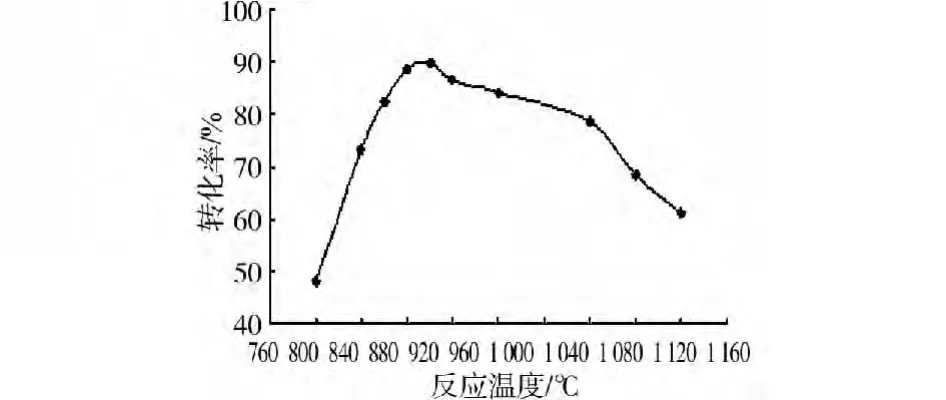
圖6 反應溫度對轉化率的影響
由圖6可知,在反應時間和反應物配比固定時,隨著反應溫度的上升,硫酸鈣還原為硫化鈣的轉化率逐漸增加,達到最大值94.60%,但繼續升高溫度時轉化率開始緩慢下降。溫度是磷石膏還原制硫化鈣的重要影響因素。當溫度較低時,不利于磷石膏生成硫化鈣主反應的進行;當溫度高于一定值,磷石膏還原生成氧化鈣的量增加,不利于硫化鈣的制備。綜合考慮,選擇反應溫度900℃作為實驗研究的最佳溫度。
3.4 反應時間的影響
設定反應溫度900℃,無煙煤與磷石膏摩爾配比2.4∶1,按實驗方法2.3。考察反應時間(0.5、1、1.5、2、2.5和3 h)對磷石膏還原制備CaS的影響,實驗結果如圖7。
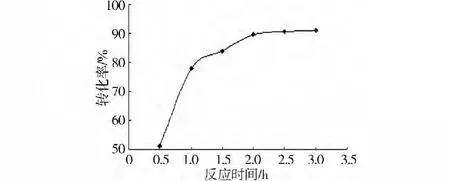
圖7 高溫反應時間對轉化率的影響
由圖7可知,磷石膏還原為硫化鈣的轉化率隨著高溫煅燒時間的延長而遞增,但當時間超過2 h之后,轉化率增加緩慢,轉化率可達97.30%。在穩定充分的還原氣氛下,當高溫煅燒時間足夠長時,大部分硫酸鈣已被還原為硫化鈣,隨著高溫反應時間的繼續增加,轉化率上升的幅度不大。所以選擇反應時間2 h作為實驗研究的最佳反應時間。反應時間h。
3.5 反應氣氛對磷石膏還原制備硫化鈣的影響
確定磷石膏與無煙煤摩爾配比為2:1,反應時間2 h,探討不同反應氣氛下磷石膏還原制備硫化鈣的反應機理,實驗條件及結果見表4、圖8和圖9。
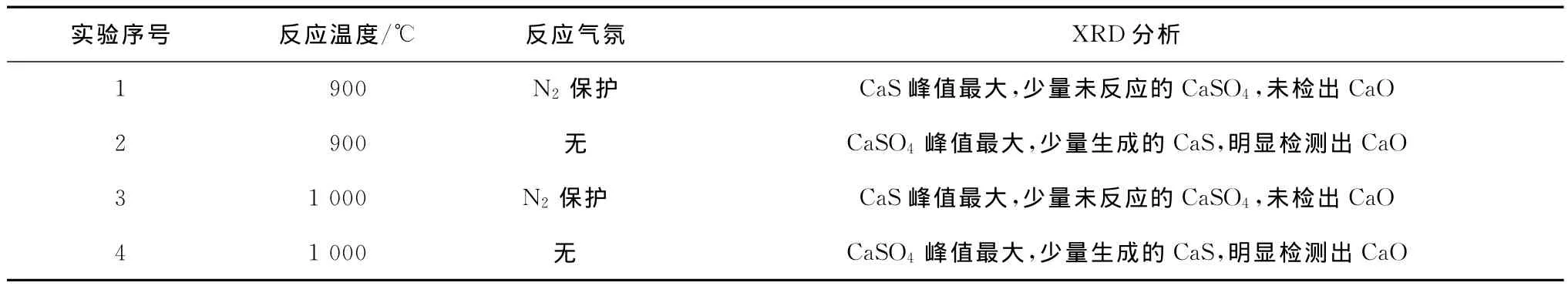
表4 反應氣氛對磷石膏制備硫化鈣的影響
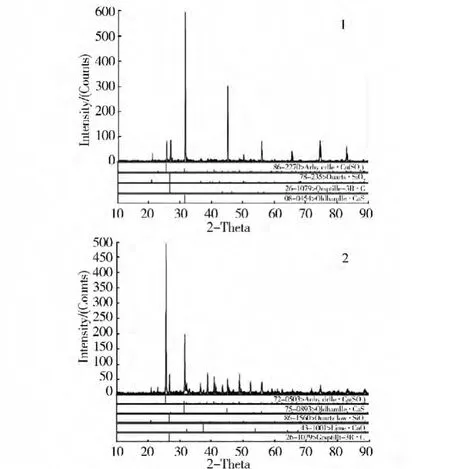
圖8 在900℃時分解產物XRD分析
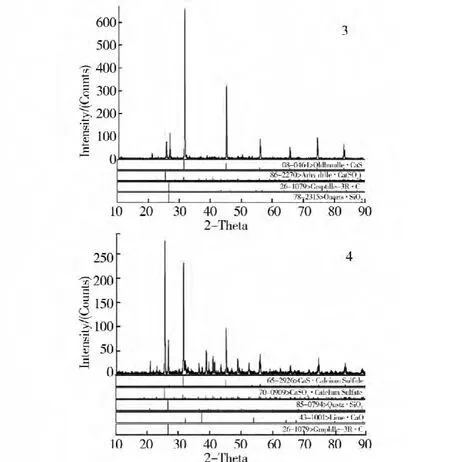
圖9 在1000℃時分解產物XRD分析
分別在900℃和1 000℃條件下,通過N2保護調節反應氣氛,研究磷石膏還原制備硫化鈣的反應機理,結果表明,N2保護的還原氣氛有利于磷石膏還原制備硫化鈣,而且能抑制磷石膏生成氧化鈣副反應。無N2保護條件下,還原劑碳粉可能發生氧化而消耗,不利于磷石膏還原制備硫化鈣反應,如圖8和圖9中2號和4號XRD圖譜所示,會有大量沒反應的硫酸鈣,分解產物中僅有少量的硫化鈣,同時檢測出氧化鈣產物,說明在無N2保護條件下,磷石膏還原分解反應復雜,不利于還原分解制備硫化鈣。
4 結 論
磷石膏熱分解制高濃度SO2聯產水泥原料的研究已成為研究熱點之一。但是磷石膏熱分解具有能耗高,原料氣濃度不穩定等缺點,研究進展緩慢。采用磷石膏熱分解制備硫化鈣,再通過硫化鈣實現磷石膏的資源化利用。實驗研究得出以下結論:
1)用磷石膏和無煙煤還原制備硫化鈣的研究是可行的,該工藝是在有N2保護條件下,通過無煙煤過量形成還原性氣氛制備硫化鈣,最佳反應條件:無煙煤:磷石膏(C∶S)=2.4∶ 1;反應最佳溫度900~1 000℃;反應時間2 h,磷石膏轉化率可達97.60%。
2)通過反應氣氛對磷石膏還原制備硫化鈣的機理研究表明,在N2保護條件下,磷石膏還原分解在充分還原性氣氛下,反應機理如反應式(1)~(3),分解渣的XRD結果表明,磷石膏大部分轉化為硫化鈣,僅有少量未分解的硫酸鈣,未檢測出氧化鈣;無N2保護條件下,分解渣XRD結果表明,分解渣中含有大量未分解的硫酸鈣,僅有少量的硫化鈣和氧化鈣生成,說明在此條件下磷石膏分解反應比較復雜。
[1]Ning P,Zheng S C,Ma L P.Kinetics and thermodynamics studies on the decompositions of phosphogypsum in different atmospheres[J].Advanced Materials Research,2010,160-162:842-848.
[2]Ma L P,Ning P,Zheng S C.Reaction mechanism and kinetic analysis of the decomposition of phosphogypsum via a solid-state reaction[J].Industrial & Engineering Chemistry Research,2010,49(8):3597-3602.
[3]Ma L P,Niu X K,Hou J.Reaction mechanism and influence factors analysis for calcium sulfide generation in the process of phosphogypsum decomposition [J]. Thermochimica Acta,2011,526:163-168.
[4]Yang X S,Zhang Z Y,Wang X L.Thermodynamic study of phosphogypsum decomposition by sulfur[J].The Journal of Chemical Thermodynamics,2013,57:39-45.
[5]Ma L P,Ning P. An equipment for phosphogypsum decomposition with circulating fluidization bed and heat reusing[P].Patent(China),ZL 2008 20081540.7
[6]劉少文,冉祥蘭,陳升.磷石膏流態化分解的實驗[J].武漢工程大學學報,2011(33):46-52.
[7]Zheng S C,Ning P,Ma L P.Reductive decomposition of phosphogypsum with high-sulfur-concentration coal to SO2in an inert atmosphere [J].Chemical Engineering Research and Design,2011,89:2736-2741.
[8]Da Z,Lu H L,Sun X Y.Reaction mechanism of reductive decomposition of FGD gypsum with anthracite [J].Thermochimica Acta,2013(559):23-31.
[9]Ma L Z,Ning P,Qing S.Study on influence factors between high sulfur coal and phosphogypsum [J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2009(48):85-88.
[10]Peter Lewis Silveston.Chapter 8-Catalytic Gas-Solid reactions[J].Perodic Operation of Chemical Reactors,2013:205-233.
[11]萬甜明,張志業,鐘本和,等.磷石膏和硫化鈣反應過程的熔融特性研究[J].現代化工,2011,13(12):63-67
[12]楊秀山,劉荊風,鐘本和,等.磷石膏制硫酸的研究進展[J].現代化工,2010,30(9):8-12.
[13]鄭敏,沈來宏,肖軍.化學鏈燃燒鈣基載氧體CaSO4與CO在不同溫度下的反應行為[J].化工學報,2008,59(11):2812-2818.
[14]Satoshi O,Naoto M,Ken K,et al.Recovery of CaO by reductive decomposition of spent gypsum in a CO-CO2-N2atmosphere[J].Ind.Eng.Chem.Res,2003,42:6046-6052.
[15]牛學奎,馬麗萍,鄭紹聰,等.磷石膏還原分解過程中CaS的產生機理分析[J].環境科學研究,2010,23(10):1306-1311.
[16]Ma L Z,Wang H,Ning P.Study on the influence factors between novel reducer and phosphogypsum [C].Proceedings of the International Conference on Power Engineering 2009(Icope-09),2009,3:221-225.
(編輯 侯 湘)
Experimental Study of Preparation of Calcium Sulfide from Thermal Decomposition of Phosphogypsum
Zheng Shaocong1,Ning Ping2,Cheng Feixiang1,He Chixian1
(1.College of Chemistry and Chemical Engineering,Qujing Normal University,Qujing 655011,P.R.China;2.Faculty of Environmental Science and Engineering,Kunming University of Science and Technology,Kunming 650093,P.R.China)
In this paper,it was carried out for reduction decomposition of phosphogypsum to calcium sulfide under N2atmosphere.The size of phosphogypsum was measured by Nano-ZS90 Zetasizer.Scanning electron microscopy and XRD-ray diffraction were used to analyze the raw-material and decomposition solid production.These conditions were also studied on a carbon to CaSO4molar ratio,reaction temperature,reaction time,and reaction atmosphere in the N2atmosphere.The results showed that the optimal conditions for production of CaS are found to be a carbon to CaSO4molar ratio of 2.4 to 1,a temperature of 900~1000℃,a reaction time of 2 h,and reductive atmosphere.Under these conditions the conversion rate of CaS from phosphogypsum amount to no less than 97.60%.
phosphogypsum;anthracite;thermal decomposition;calcium sulfide
X705
A
1674-4764(2013)S2-0160-04
10.11835/j.issn.1674-4764.2013.S2.042
2013-09-30
鄭紹聰,男,博士,主要從事環境工程研究,(E-mail)zhscong2008@sina.com。

