毛霉F-32產β-葡聚糖酶發酵條件優化及其對麥芽溶解性的影響
趙志超,贠建民*,艾對元,張紊瑋,李懷生
(甘肅農業大學食品科學與工程學院,甘肅 蘭州 730070)
毛霉F-32產β-葡聚糖酶發酵條件優化及其對麥芽溶解性的影響
趙志超,贠建民*,艾對元,張紊瑋,李懷生
(甘肅農業大學食品科學與工程學院,甘肅 蘭州 730070)
為提高微生物制麥過程中毛霉菌株F-32產β-葡聚糖酶酶活力以及改善麥芽溶解性,在單因素試驗基礎上,采用響應面試驗設計法優化產酶條件,利用Design Expert 7.0軟件對產酶結果進行二次回歸分析,獲得最佳的發酵條件:發酵溫度30℃、發酵時間81h、接種量7.2%、初始pH6.0;對該條件下的菌株產酶情況進行驗證,產酶力達到15.8775U/mL。并通過微生物制麥實驗,該毛霉菌株F-32可以有效地提高甘啤4號大麥品種的制麥溶解性。
β-葡聚糖酶;產酶條件;響應面;優化;麥芽溶解性
β-葡聚糖酶是一類能降解谷物中β-葡聚糖的水解酶類的總稱。該酶類包括內-β-1,3葡聚糖酶、外-β-1,3葡聚糖酶、外-β-1,4葡聚糖酶、內-β-(1,3-1,4)-葡聚糖酶[1]。它們能夠準確地作用于β-葡聚糖分子中的糖苷鍵,將大分子的β-葡聚糖降解成小分子量片段,失去親水性和黏性,提高了富含β-葡聚糖的谷物類加工過程中的溶解速率[2],因而在農產品加工和食品生產領域應用非常廣泛。
麥芽是啤酒釀造的重要原料,在啤酒麥芽制造過程中,盡管大麥中β-葡聚糖的含量相對于多聚糖較低,但仍給麥汁生產和啤酒釀造造成不利影響[3]。而β-(1,3-1,4)-葡聚糖酶和β-1,3-葡聚糖酶在此過程中對麥芽的溶解性起到至關重要的作用[4],它們能夠專一降解大麥β-葡聚糖中含量較多的β-1,3-糖苷鍵[5],同時β-(1,3-1,4)-葡聚糖酶還能降解β-葡聚糖混合糖苷鍵中與β-1,3-糖苷鍵接近的β-1,4-糖苷鍵,將大麥中的β-葡聚糖水解為纖維二糖和纖維三糖[6],解決了β-葡聚糖含量過高而引起麥汁黏度高,過濾速率慢,麥汁產量低,非生物穩定性差等問題,有利于啤酒質量和穩定性的提高[7]。
為提高低發芽率大麥所制麥芽的溶解性,近年來出現了微生物制麥技術,即在制麥過程中添加啟動子微生物菌株,利用微生物產生的外源性酶來協助大麥胚乳細胞壁的降解,進而改善麥芽品質[8]。目前,研究報道的制麥啟動子微生物主要有可降解β-葡聚糖、木聚糖等大分子的菌種[9]。產β-葡聚糖酶的微生物,主要包括細菌和真菌,已報道的有:枯草芽孢桿菌(Bacillus subtilis)[10-11]、地衣芽孢桿菌(Bacillus licheniformis)[12]、盾殼霉2134(Coniothyrium minitans)[13]、康氏木霉(Trichoderma koningii)[14]、黑曲霉(Aspergillus niger)[15]、局限曲霉(Aspergillus restrictus)[16]。2007年,Teng Da等[17]將地衣芽孢桿菌中的分泌β-(1,3-1,4)-葡聚糖酶基因轉接到畢赤酵母細胞中并得到成功表達,基因優化后的表達水平在原來的基礎上提高了10倍,其β-(1,3-1,4)-葡聚糖酶活達到333.7U/mL。目前關于毛霉屬(Mucor)產β-葡聚糖酶的菌株報道非常少。在長期的制麥生產研究中,本實驗室已成功地從原料大麥中分離得到了一株產β-葡聚糖酶活較高的毛霉屬菌株F-32,由于該菌株具有產孢子量少,生長適應性強的特點,非常適合于制麥工藝對啟動子菌株的要求。為此,本實驗以該菌株為研究對象,以其產酶能力作為評價指標,利用響應面法對其產酶條件開展進一步的優化,采用多元二次回歸方程來擬合因素與響應值之間的函數關系,旨在為將該菌株成功應用于制麥工業生產提供科學依據和參考。
1 材料與方法
1.1 材料與試劑
大麥粉,甘肅武威長城麥芽廠提供甘啤4號大麥,粉碎過篩。
標準大麥β-葡聚糖(純度≥95%) 美國Sigma公司。
1.2 菌種與培養基
毛霉F-32菌株(Mucor sp.),甘肅農業大學食品科學與工程學院微生物研究室分離保藏,分離自大麥表面。
斜面培養基:PDA培養基[18];液體產酶培養基:大麥粉3.0g、FeSO4g7H2O 0.001g、Na2HPO40.1g、CaCO30.5g、(NH4)2SO40.5g、MgSO4g7H2O 0.02g、NaNO30.4g、水100mL。以上培養基皆在121℃濕熱滅菌20min后,方可使用。
1.3 發酵種子制備
用無菌水將孢子沖洗到液體產酶培養基中,調整孢子濃度為107,30℃恒溫振蕩培養48h。
1.4 葡萄糖標準曲線繪制
分別吸取1.0g/100mL的標準葡萄糖溶液2.0、3.0、4.0、5.0、6.0mL置于100mL的容量瓶中,用蒸餾水定容至刻度,配制成0.2、0.3、0.4、0.5、0.6mL/mg的標準液。取不同質量濃度葡萄糖標準溶液和蒸餾水各1mL于試管中,加1mL蒸餾水,3mL DNS試劑,混勻后,放入沸水中準確反應5.0min,取出后立即置于冰水浴中降溫至室溫,以空白管調零,在540nm波長處比色,以所得的吸光度為縱坐標,對應的標準葡萄糖溶液濃度為橫坐標,繪制標準曲線:y=1.31x—0.0048(R2= 0.9982)。空白對照:1.0mL的蒸餾水代替1.0mL的葡萄糖標準溶液,其他步驟同上。
1.5 β-葡聚糖酶活力測定
利用pH5.5的醋酸緩沖溶液將待測酶液稀釋適當倍數,取經40℃預熱的酶稀釋液1.0mL和經40℃預熱的質量濃度為1.0g/100mL的β-葡聚糖溶液1.0mL,混勻,于40℃恒溫水浴準確反應10.0min,后加入蒸餾水1.0mL和DNS試劑3.0mL,搖勻,置于沸水中準確反應5min,取出并立即置于冰水浴中降至室溫,以空白管調零,在540nm波長處比色,記錄其吸光度。空白制作:吸取已稀釋酶液1.0mL先加入DNS試劑3mL,再加入蒸餾水1.0mL和1.0g/100mL β-葡聚糖溶液1.0mL,其他步驟同上。
酶活力定義:在40℃、pH5.5條件下,每分鐘分解大麥β-葡聚糖產生1μmol還原糖為1個酶活力單位,以U/mL表示。
酶活力/(U/mL)=(Ah0.7633+0.0037)hDfh1000/180t
式中:A為吸光度;Df為待測酶液的稀釋倍數;t為反應時間/min;180為葡萄糖的摩爾分子質量/(g/mol);1000為單位換算倍數。
1.6 單因素試驗設計
在初始產酶培養基的基礎上,對發酵溫度、發酵時間、接種量、初始pH值4個因素進行單因素試驗,以確定各因素影響產酶能力的水平區間。
1.7 響應面法試驗設計與處理
根據單因素試驗確定的影響產酶能力的水平區間,進行響應面設計;以產酶量為響應值,利用Design Expert 7.0對試驗結果進行回歸分析,建立回歸方程,獲得該菌株發酵產β-葡聚糖酶的最佳條件。
1.8 麥芽溶解性實驗及其溶解性指標的測定
1.8.1 制麥工藝
浸麥(29h):浸6h斷9h→浸4h斷6h→浸4h,18℃;發芽(96h):16℃,相對濕度95%;焙燥(22h):45℃、5h→50℃、6h→60℃、6h→70℃、2h→83℃、3h。
1.8.2 溶解性指標測定
β-葡聚糖、浸出率、過濾速率和黏度指標參考QB/T 1686ü2008《啤酒麥芽》。
β-葡聚糖酶酶活力的測定:稱取2g樣品,加入pH6.0的醋酸緩沖液充分研磨,離心10min,其他步驟同1.5節。
2 結果與分析
2.1 不同發酵溫度對產β-葡聚糖酶活力的影響
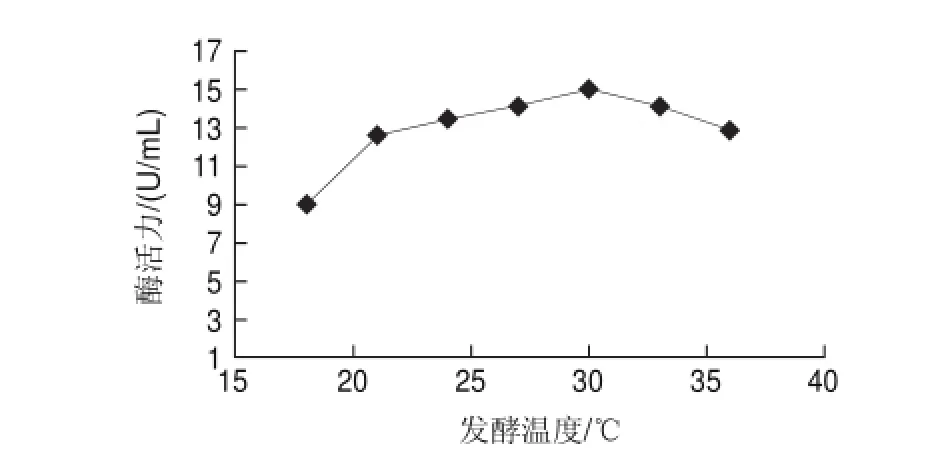
圖 1 不同發酵溫度對發酵產β-葡聚糖酶酶活力的影響Fig.1 Effect of fermentation temperature on β-glucanase activity
溫度的變化直接影響到微生物生長代謝過程。為探尋供試菌株產β-葡聚糖酶適宜溫度范圍,在250mL三角瓶裝液量80mL、接種種子懸液5.0%、初始pH6.5、200r/min振蕩培養96h的條件下,將溫度分別控制在18、21、24、27、30、33、36℃,考察其對產酶能力的影響,結果見圖1。發酵溫度在30℃之前,該菌株的產酶能力隨著溫度的升高而增強,30℃時達到最大值,酶活力為15.2069U/mL;溫度高于30℃時,產酶能力有所下降。這是由于高溫對毛霉菌絲體生長的產生了抑制作用[19],導致產酶量降低,使得β-葡聚糖酶活力迅速下降。故初步選擇30℃為最適發酵溫度。
2.2 不同發酵時間對產β-葡聚糖酶活力的影響
發酵時間對產酶能力的影響主要是通過影響微生物的生長曲線而產生作用。在250mL三角瓶裝液量80mL、接種種子懸液5.0%、初始pH6.5、恒溫30℃、200r/min振蕩培養的條件下,分別設置培養時間40、48、56、64、72、80、88、96h,考察其對產酶能力的影響,結果見圖2。
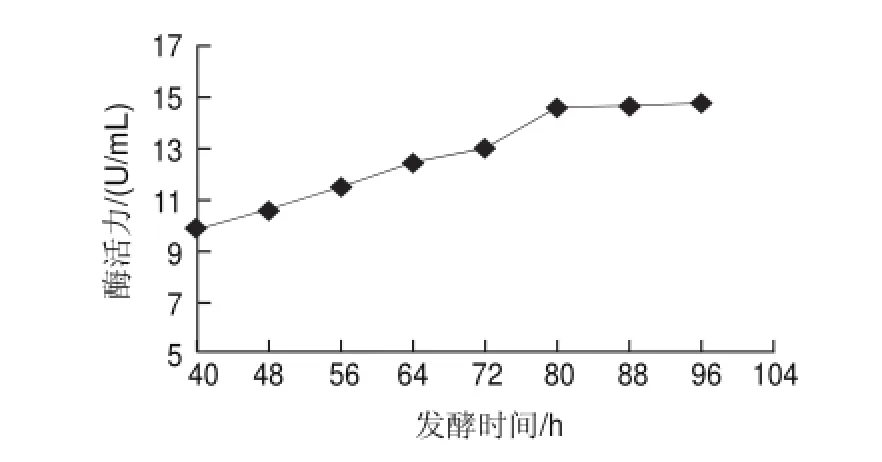
圖 2 不同發酵時間對發酵產β-葡聚糖酶酶活力的影響Fig.2 Effect of fermentation time on β-glucanase activity
由圖2可知,發酵時間從40h延長到72h時,該菌株的產酶能力隨著發酵時間的延長而增強,80h后增長趨于平緩,這是由于菌體生物量不斷增大,菌體對營養物質的競爭,出現營養缺乏,導致菌體本身的生長停滯,胞外酶在缺少底物誘導的情況下也停止分泌,故初步選擇80h為最適發酵時間。
2.3 不同初始pH值對產β-葡聚糖酶活力的影響

圖 3 不同初始pH值對發酵產β-葡聚糖酶酶活力的影響Fig.3 Effect of initial pH on β-glucanase activity
微生物的生長代謝和產酶活力都有一定的pH值適應范圍,合適的pH值對菌株的生長代謝具有促進作用,可提高菌株的產酶活力。在發酵溫度30℃、200r/min發酵80h、接種量5.0%、250mL三角瓶裝液量80mL的條件下,利用0.12mol/L鹽酸溶液或0.1mol/L氫氧化鈉溶液將液體培養基pH值調整至4.5、5.0、5.5、6.0、6.5、7.0、7.5,經pH計監測30s內保持穩定,觀察其對該菌株發酵產β-葡聚糖酶能力的影響,結果見圖3。該菌株產酶能力受到pH值的影響較為顯著,在pH6時菌株的產酶能力出現高峰,酶活力達到15.4043U/mL;低于或超過pH6時都會出現明顯的下降趨勢,說明該菌株生長的最適pH值或者所產酶的最適pH值為6,屬弱酸性,故初步確定pH6為最適初始pH值。
2.4 不同接種量對產β-葡聚糖酶活力的影響
采用合適的接種量能夠有效地縮短發酵時間,使產酶高峰提前[20]。在初始pH6.5、發酵溫度30℃、200r/min培養72h、250mL三角瓶裝液量80mL的條件下,考察接種量對發酵產β-葡聚糖酶能力的影響,結果見圖4。
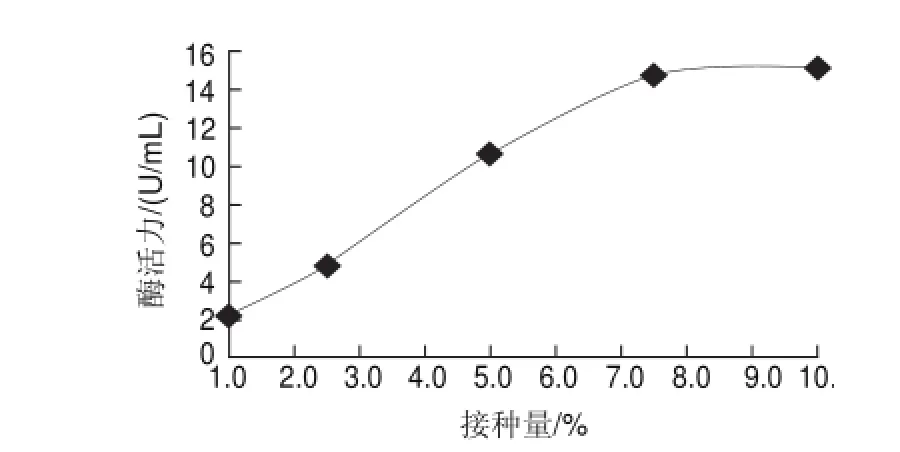
圖 4 不同接種量對發酵產β-葡聚糖酶酶活力的影響-glucanase activityFig.4 Effect of inoculum amount onβ
由圖4可知,當接種量為1.0%時,菌體的滯留適應期延長,菌株產酶能力在短時間內不能快速表達,而接種量達到2.5%以上時,產酶能力呈直線趨勢迅速增長,超過7.5%時,其增長趨勢逐步放緩,考慮到生產過程種子培養成本,選擇7.5%為最適接種量。
2.5 響應面設計方案與分析結果
根據單因素試驗結果,選取發酵溫度(A)、發酵時間(B)、接種量(C)、初始pH值(D)4個因素每個自變量的低、中、高水平分別編碼為—1、0、+1,共29個試驗,其中24個為析因試驗,5個為中心試驗,以估計誤差。以產酶活力作為響應值(Y),采用Design Expert 7.0對試驗結果進行回歸分析。因素及水平設計方案與結果見表1。
利用Design Expert 7.0軟件對表1數據進行多元二次回歸擬合,得到全模型回歸方程:
Y=—1110.26+24.40786A+9.48073B+13.14704C+ 111.9576D—0.02148AB+0.0488AC—0.39317AD—0.02994BC—0.14825BD—0.8804CD—0.3464A2—0.0479B2—0.4859C2—6.92657D2
對回歸方程進行的方差分析結果見表2。

表 1 Box-Behnken試驗設計與結果Table 1 Box-Behnken experimental design and results for response surface analysis

表 2 回歸模型方差分析Table 2 Analysis of variances for the fi tted regression model
表2分析結果表明,在供試溫度27~33℃范圍內,因素A對該菌株產β-葡聚糖酶能力的影響不顯著(P>0.05);因素B對該菌株產β-葡聚糖酶能力的影響顯著(P<0.05),由于隨著發酵時間的延長,菌體生長經由指數期到達穩定期,生物量積累增多,因而產酶量也會隨之增加。因素C和因素D對其影響極顯著,說明在其他條件不變的情況下,應嚴格控制接種量和初始pH值,以保證最大限度地產酶。交互項CD顯著,其他不顯著;二次項對其影響均極顯著。該回歸模型P值小于0.0001,表明二次方程模型達到極顯著水平,模型失擬項P值為0.0861(>0.05),模型失擬項不顯著,即該模型在整個研究回歸區域擬合的較好。
根據數據分析表明,其復相關系數R2=0.9716,表示這4個因素及其二次項能解釋Y值變化的97.16%。說明模型相關性較好;校正決定系數R2Adj=0.9432,說明94.32%的試驗數據的變異性可用此回歸模型解釋;該試驗的精密度達到17.718,大于純誤差值4.0,結果合理。綜上所述,可以使用該模型來分析響應面值的變化。
利用Design Expert7.0軟件,根據回歸方程繪制相應的響應曲面圖進行可視化分析,由圖5可知,各交互因素存在一個最佳的水平組合使產酶活力達到最高。圖5a、b、c顯示,發酵溫度與其他3個因素組合時,均在28.5~31.5℃范圍內產β-葡聚糖酶活力達到最大值,說明該溫度范圍適宜菌株F-32生長,較快積累生物量,使β-葡聚糖酶活力提高;如圖5c、d、e所示,菌株產β-葡聚糖酶活性最高時,初始pH值都處于5.75~6.25之間,說明偏酸性環境符合該菌株的生長和產酶條件。由響應面圖可知,因菌體生物量的積累而引起產酶變化的發酵時間和接種量也分別在76~84h和6.25%~8.75%范圍內使產酶活力達到最高值。


圖 5 各因素交互作用對發酵產酶能力影響的響應面圖Fig.5 Response surface plots for the effects of fermentation conditions on β-glucanase activity
由全模型回歸方程可以看出,響應面存在最大值。經軟件分析得出β-葡聚糖酶預測產量最大時的各因素取值分別是:發酵溫度29.87℃、發酵時間80.88h、接種量7.18%、初始pH5.91,預測值為15.8596U/mL。
為了驗證回歸模型預測值的準確性,以響應面分析得到的最佳產酶條件進行產酶發酵實驗,同時考慮到實際操作的可行性,將最佳條件修改為:發酵溫度30℃、發酵時間81h、接種量7.2%、初始pH6.0。經過3次重復實驗得到β-葡聚糖酶活力的平均值為15.8775U/mL。由此可見,該回歸模型能用于β-葡聚糖酶發酵條件的預測。
2.6 供試菌株對麥芽溶解性的影響
以供試毛霉F-32菌株的上述試驗篩選的最佳產β-葡聚糖酶條件為參考依據,利用3種不同海拔產地甘啤4號大麥進行微生物制麥實驗,考察菌株對麥芽溶解性的影響,結果見表3。

表 3 不同產地大麥微生物制麥指標Table 3 Effect of Mucor F-32 on malt quality of barleys from different growing areas
由表3可知,添加了啟動子培養菌株毛霉F-32的麥芽與空白實驗相比較,β-葡聚糖酶活力、浸出率和過濾速率3個指標均有所提高,β-葡聚糖含量和麥汁黏度也有明顯降低。可見,在溶解性較差大麥制麥過程中,該產β-葡聚糖酶毛霉菌株能夠利用自身的產酶特性協助麥芽胚乳細胞壁進一步降解,有效改善麥芽溶解性,顯著提高麥芽利用率,可作為制麥啟動子菌株使用。
3 結 論
3.1 通過單因素試驗設計,確定了影響產酶能力的4個因素:發酵溫度、發酵時間、接種量和初始pH值的水平區間,分別為發酵溫度27~33℃、發酵時間72~88h、接種量5.0%~10.0%、初始pH5.5~6.5。
3.2 利用Design Expert 7.0對響應面試驗設計結果進行分析,并建立產酶活力回歸模型,確定了各因素的最佳取值水平,即最佳產酶活力的條件分別為:發酵溫度30℃、發酵時間81h、接種量7.2%、初始pH6.0;該條件下菌株產β-葡聚糖酶活力為15.8775U/mL,其可靠性在響應值的95%預測區間內。由此可以說明,運用該回歸模型對該菌株進行產β-葡聚糖酶活力條件的預測是合理的。
3.3 將供試菌株作為微生物制麥的啟動子添加到制麥過程中,觀察其對麥芽溶解特性的影響,結果表明微生物麥芽的溶解性指標均有所改善,麥芽溶解特性有顯著提高。
[1] 任海霞, 祝德義, 郭利美, 等. β-葡聚糖酶產酶培養基的優化[J]. 現代食品科技, 2005, 21(1): 39-42.
[2] 熊濤, 徐立榮, 曾哲靈. β-葡聚糖酶的研究進展[J]. 四川食品與發酵, 2006(6): 1-4.
[3] NUUTILA A M, RITALA A, SALMENKALLIO-MARTTILA M, et al. Improvement of malting quality of barley by complementing the malt enzyme spectrum[J]. Phytochemistry Reviews, 2002, 1: 135-140.
[4] WANG Junmei, ZHANG Guoping, CHEN Jinxin, et al. The changes of β-glucan content and β-glucanase activity in barley before and after malting and their relationships to malt qualities[J]. Food Chemistry, 2004, 86: 223-228.
[5] LU Ping, FENG Mingguang, LI Weifen, et al. Construction and characterization of a bifunctional fusion enzyme of Bacillus sourced β-glucanase and xylanase expressed in Escherichia coli[J]. FEMS Microbiology Letters, 2006, 261(2): 224-230.
[6] WOLF M, GECZI A, SIMON O, et al. Genes encoding xylan and beta-glucan hydrolysing enzymes in Bacillus subtilis: characterization, mapping and construction of strains deficient in lichenase, cellulase and xylanase[J]. Microbiology, 1995, 141(Pt2): 281-290.
[7] NOOTS I, DERYCKE V, CORNELIS K, et al. Degradation of starchy endosperm cell walls in nongerminating sterilized barley by fungi[J]. Journal of Agricultural and Food Chemistry, 2001, 49(2): 975-981.
[8] 朱俊勤, 李崎, 孫軍勇, 等. 微生物制麥技術研究進展[J]. 啤酒科技, 2005(1): 11-14.
[9] PLANAS A. Bacterial 1,3-1,4-β-glucanases: structure, function and protein engineering[J]. Biochimica et Biophysica Acta, 2000, 1543(2): 361-382.
[10] 韓晶, 李寶坤, 賀家亮, 等. 高產嗜熱β-葡聚糖酶菌種的誘變選育研究[J]. 釀酒科技, 2009(8): 47-51.
[11] 韓晶, 李寶坤, 李開雄, 等. 耐熱β-葡聚糖酶產生菌AS35產酶條件的研究[J]. 中國食品添加劑, 2010(2): 166-170.
[12] TENG Da, FAN Ying, YANG Yalin, et al. Codon optimization of Bacillus licheniform is β-1,3-1,4-glucanase gene and its expression in Pichia pastoris[J]. Appl Microbiol Biotechnol, 2007, 74: 1074-1083.
[13] ZANTINGE J L, HUANG H C, CHENG K J. Induction, screening and identification of Coniothyrium minitans mutants with enhanced β-glucanase activity[J]. Enzyme and Microbial Technology, 2003, 32(2): 224-230.
[14] 王金玲, 何國慶, 呂長山. 響應面法優化康氏木霉產β-葡聚糖酶的液體發酵條件[J]. 食品工業科技, 2010, 31(9): 204-207.
[15] 賀小賢, 姜緒林. 黑曲霉β-葡聚糖酶產酶培養基的研究[J]. 食品工業科技, 2003, 24(12): 21-23.
[16] 孫玉英, 王瑞明, 劉慶軍, 等. β-葡聚糖酶高產菌株的分離篩選及其新菌種初步鑒定[J]. 釀酒科技, 2004(2): 25-27.
[17] TENG Da, WANG Jianhua, FAN Ying, et al. Cloning of β-1,3-1,4-glucanase gene from Bacillus licheniformis EGW039 (CGMCC 0635) and its expression in Escherichia coli BL21 (DE3)[J]. Appl Microbiol Biotechnol, 2006, 72: 705-712.
[18] 杜連祥, 王昌祿, 魯梅芳, 等. 工業微生物學實驗技術[M]. 天津: 天津科學技術出版社, 1992: 188-196.
[19] 賀運春. 真菌學[M]. 北京: 中國林業出版社, 2008: 137-142.
[20] 潘麗軍, 龐銳, 吳學鳳, 等. 葡萄糖和木糖共發酵生產L-乳酸的培養基和培養條件響應面優化[J]. 食品科學, 2011, 32(9): 140-145.
Optimization of Fermentation Conditions for β-Glucanase Production by Mucor F-32 and Its Effect on Malt Solubility
ZHAO Zhi-chao,YUN Jian-min*,AI Dui-yuan,ZHANG Wen-wei,LI Huai-sheng
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Response surface methodology was used to optimize fermentation conditions for β-glucanase production by Mucor F-32. Quadratic regression analysis of the experimental data obtained was carried out using the software Design Expert 7.0. We established the optimum fermentation conditions as follows: fermentation temperature 30 ℃, fermentation time 81 h, inoculum size 7.2%, and initial pH 6.0. Under these conditions, the β-glucanase activity of fermentation broth was 15.8175 U/mL in validation experiments. The application of Mucor F-32 for malting Ganpi No.4 barley indicated a considerable improvement in malt solubility.
β-glucanase;production conditions;response surface methodology;optimization;malt solubility
TS261.2
A
1002-6630(2013)01-0199-06
2011-10-11
甘肅省科技重大專項計劃項目(1002NKDH029);甘肅省自然科學研究基金計劃項目(1107RJZA128)
趙志超(1985ü),男,碩士研究生,研究方向為發酵工程。E-mail:441993726@qq.com
*通信作者:贠建民(1968ü),男,教授,博士,研究方向為生物工程。E-mail:yunjianmin@gsau.edu.cn

