葡萄籽原花青素對睡眠呼吸暫停模式低氧大鼠海馬區磷酸化p38MAPK 和IL-1β 表達的影響
趙雅寧,劉文倩,王紅陽,竇 娜,郭 霞,景麗偉
原花青素是天然植物中廣泛存在的一大類多酚類化合物的總稱,屬于植物多酚類物質,以葡萄籽中含量最為豐富。研究表明葡萄籽原花青素具有抗氧化、清除自由基、心血管保護、降血脂、抗腫瘤等功能[1~4]。目前有關葡萄籽原花青素對中樞神經系統作用研究較少。阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep ap1nea-hypopnea syndrome,OSAHS)因睡眠過程反復發生的低氧/再復氧,可造成心、腦、腎等重要器官的損傷[5,6]。臨床上OSAHS患者表現警覺、執行能力和運動協調方面的認知障礙,且與血管性癡呆的形成密切相關[6]。本研究采用在睡眠呼吸暫停模式慢性間歇性缺氧模型,探討葡萄籽原花青素對睡眠呼吸暫停模式低氧大鼠學習記憶和海馬區磷酸化p38 絲裂原活化蛋白激酶(p38MAPK)和白介素-1β(IL-1β)表達的影響,為中藥的進一步開發和利用提供依據。
1 材料與方法
1.1 實驗動物、試劑及儀器 雄性SD 大鼠80只(北京維通利華公司,合格證SCXK(京)2002-003),體質量310~350g;H-7650 透射電鏡(日本日立公司);測氧儀(建德市梅城電化分析儀器廠);低氧控制程序(天津醫科大學總醫院呼吸科);純氮(天津六方氣體高科技有限公司);低氧艙(天津醫科大學研制)。
1.2 動物分組和模型制備 80 只雄性SD 大鼠隨機分成對照組、模型組及高、低劑量葡萄籽原花青素干預組,各組動物20 只。模型組:模擬臨床臨床呼吸暫停事件,建立OSAHS 模式間歇低氧動物模型:每天8:00Am~4:00Pm 將實驗動物置于模型艙內,向艙內循環充入氮氣和空氣,每組每次循環2min,連續給予氮氣30s,維持艙內氧濃度最低至5%(50ml/L),隨后均復氧至氧濃度21%(210ml/L)。對照組持續充入壓縮空氣。用數字測氧儀監測艙內氧濃度變化,使艙內氧濃度維持在各自的氧濃度內,使其氧濃度波動范圍在±0.5%以內;每天實驗8h,實驗持續時間為2 和6w。干預組在動物進入低氧模型艙前2w 開始每天灌胃給藥1 次,持續給藥8w,劑量分別為:高GSP200mg/kg、低100mg/kg。分別在實驗2w 和6w 進行所設指標檢測。
1.3 腦組織形態結構觀察(電鏡)常規麻醉動物,開胸、暴露心臟,用混合固定液(2.5%戊二醛和2%多聚甲醛的磷酸緩沖液)心臟灌流,斷頭取腦,取大腦海馬組織,切成1mm×1mm×1mm 組織塊,立即以40ml/L 戊二醛固定,0.1mol/L 二甲砷酸緩沖液沖洗兩遍,再經40ml/L 四氧化鋨固定,緩沖液沖洗,逐級丙酮脫水,環氧樹脂浸透,包埋,超薄切片,醋酸鈾枸櫞酸鉛雙重染色,透射電鏡下觀察腦組織超微結構并攝片。
1.4 磷酸化P38MAPK 和IL-1β 蛋白質印跡檢測 大鼠致死后,迅速取雙側海馬區組織,稱量0.6g,4℃PBS 充分洗滌,加入3 倍體積的4℃全細胞裂解液,冰浴中勻漿,4℃離心5min,12000 r/min,取上清。考馬斯亮藍(南京建成生物有限公司)法測各樣本的蛋白含量,樣本貯存于-80℃備用。檢測步驟:蛋白樣品40μg 與等體積上樣緩沖液混合,煮沸10min,100g/L 十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE),轉膜,封閉液室溫下震蕩2~3h,加入抗體(美國Cell Signaling 公司,磷酸化P38MAPK和IL-1β 濃度均為1∶2000),4℃孵育過夜,TBST 洗膜,標記的二抗,37℃孵育1h,TBST 洗膜,ECL 顯色,用圖像分析儀測定光密度,作定量分析。
1.5 學習記憶功能檢測 按照Smith 等[7]的方法,采用Morris 水迷宮進行檢測。每只動物晨起訓練5 次后分別在上午、下午各測試6 次,分別記錄各組大鼠逃避潛伏期時間單位為秒(s);及撤去平臺后動物穿越原平臺位置的次數,取檢測記錄的總均值。
1.6 統計學處理 應用SPSS17.0 統計分析軟件對數據進行數據處理,檢驗方法為組間分析采用析因設計資料的方差分析,組內分析采用SNK-q 分析。數據以±s 表示,P<0.05 為有顯著性意義。
2 結果
2.1 各組神經細胞超微結構的改變 對照組神經細胞形狀規則,胞質內線粒體豐富,胞核形狀規則,核膜完整,染色質均勻,電子透明度高。模型組細胞外形不規則,多數線粒體嵴斷裂、減少、甚至出現大量空泡、消失或難以辨認,染色質聚集靠邊等;葡萄籽原花青素組神經細胞超微結構減輕,高劑量組尤為明顯(見圖1~圖5)。
2.2 各組海馬區磷酸化p38MAPK 和IL-1β 表達變化 免疫印跡法檢磷酸化p38MAPK 和IL-1β蛋白表達水平:以β-actin 校準后的蛋白條帶IOD 值反映其蛋白水平。與對照組比較,模型組腦組織海馬區磷酸化p38MAPK 和IL-1β 表達增高,且隨低氧時間時間的延長,磷酸化p38MAPK 和IL-1β 蛋白水平進一步增高;與間模型組比較,葡萄籽原花青素可有效降低磷酸化p38MAPK 和IL-1β 蛋白水平,且在高劑量葡萄籽原花青素組減低更為顯著(見表1)。
2.3 各組水迷宮檢測結果 與對照組相比,模型組動物的大鼠逃避潛伏期時間均延長、穿越原平臺位置的次數均減少;與模型組比較,葡萄籽原花青素組能顯著縮短大鼠逃避潛伏期時間、增加原平臺位置的次數(P<0.05)(見表2)。
表1 各組海馬區磷酸化p38MAPK 和IL-1β 蛋白的比較(±s)
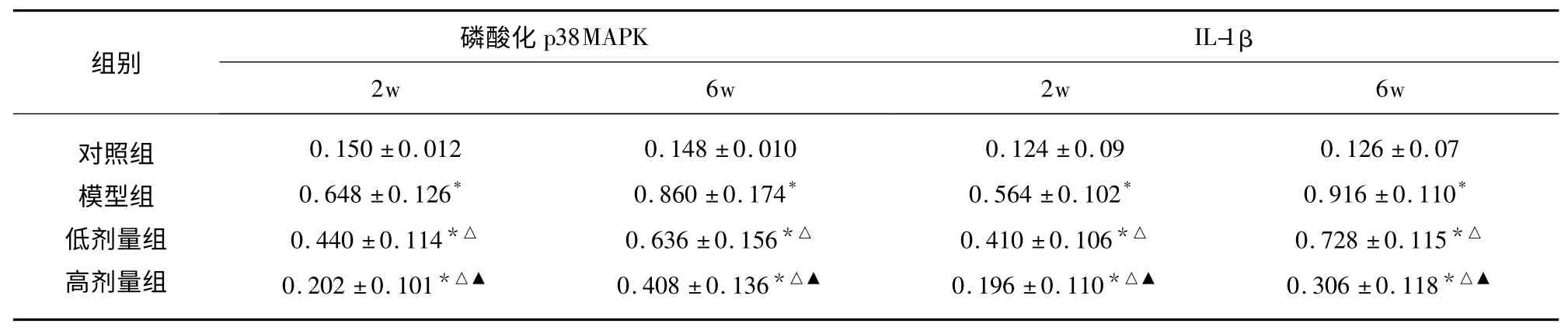
表1 各組海馬區磷酸化p38MAPK 和IL-1β 蛋白的比較(±s)
與對照組比較* P<0.05;與模型組比較△P<0.05;與低劑量組比較▲P<0.05
表2 各組動物水迷宮檢測結果的比較(±s)
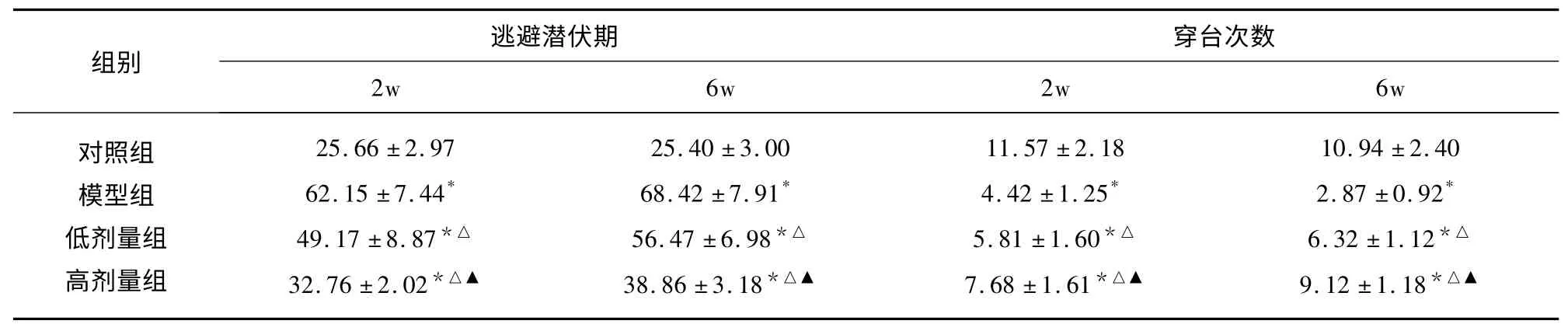
表2 各組動物水迷宮檢測結果的比較(±s)
與對照組比較* P<0.05;與模型組比較△P<0.05;與低劑量組比較▲P<0.05

圖1 對照組大鼠海馬區神經元形態變化(電鏡×20000)

圖2 模型組2w 大鼠海馬區神經元形態變化(電鏡×20000)

圖3 模型組6w 大鼠海馬區神經元形態變化(電鏡×20000)

圖4 低劑量組6w 大鼠海馬區神經元形態變化(電鏡×20000)

圖5 高劑量組6w 大鼠海馬區神經元形態變化(電鏡×20000)
3 討論
本研究發現葡萄籽原花青素可減輕OSAHS 模式間歇性低氧大鼠海馬區神經細胞形態損傷,改善動物學習記憶功能,說明葡萄籽原花青素對OSAHS導致的神經損傷有一定的保護作用。OSAHS 特征性的低氧方式是慢性間歇低氧,這種缺氧-復氧方式對神經的損傷現類似腦缺血/再灌注,產生大量的活性氧,引起腦內強烈氧化應激,導致神經元的損傷,學習記憶受損[8],因此給予具有較強抗氧化、清除自由基作用的葡萄籽原花青素對OSAHS 誘導神經損傷有較好保護作。譚毓治[9]曾報道葡萄籽原花青素能改善D-半乳糖所致衰老小鼠的學習記憶能力,與其能降低血液和腦組織中過氧化脂質有關。
本研究發現葡萄籽原花青素可抑制OSAHS 模式間歇性低氧大鼠腦內p38MAPK 的活性和炎癥因子IL-1β 的表達。p38MAPK 是有絲分裂原活化蛋白激酶(MAPKs)家族成員,其活化對學習記憶的影響主要表現負性作用。研究顯示p38MAP 活化后經多級激酶反應介導凋亡基因或蛋白表達,導致神經細胞的死亡,學習記憶損傷[10];此外,p38MAP 活化直接對海馬神經突觸可塑性產生損傷,導致長時程增強(LTP)的受損從而致空間學習能力受損[11]。炎癥因子IL-1β 可通過核轉錄因子kappa B(NF-κ B)激活巨噬細胞及其他細胞分泌粘附因子、IL-6、IL-8 等產生,促進腦缺血缺氧后腦組織炎癥損傷的加劇,神經功能受損。此外,IL-1β 可影響腦細胞對神經活性物質、神經營養因子的釋放和再攝取、調控輸入與輸出關系的反應環路、影響突觸的可塑性和LTP 等,在認知功能方面具有重要作用[12,13]。本研究中給予葡萄籽原花青素干預后,動物學習記憶明顯改善,同時二者表達水平呈劑量依賴式顯著下降,說明葡萄籽原花青素通過抑制p38MAPK 信號活化、減少IL-1β表達而改善OSAHS 模式低氧大鼠的認知行為。
總之,本實驗結果表明葡萄籽原花青素可以通過降低腦組織海馬區p38MAPK 信號活化、減少IL-1β 表達,而改OSAHS 模式低氧導致的動物認知功能損傷。葡萄籽原花青素具有多種藥理活性,其改善OSAHS 神經損傷的其它機制有待進一步探討。
[1]吳秀香,張 妍,刊柳青,等.葡萄籽原花青素對腎血管性高血壓犬鼠血管重塑的影響[J].中國病理生理,2012,28(6)1023-1027.
[2]Cui XP,Li BY,Gac HQ,et al.Effects of grape seed proanthoeyanidin extracts on peripheral nerves in streptozocin-induced diabetic rats[J].Nutr Sci Vitaminol(Tokyo),2008,54(4):321-328.
[3]Hsu CP,Lin YH,Chou CC,el al.Mechanisms of grape seed proeyanidin-induced apoptosis in colorectal carcinoma cells[J].Anticancer Res,2009,29(1):283-289.
[4]Feng Y,Liu YM,Leblanc MH,et al.Grape seed extract given three hours after injury suppresses lipid peroxidation and reduces hypoxicischemic brain injury in neonatal rats[J].Pediatr Res,2007,61(3):295-300.
[5]McNicholas WT,Bonsignore MR.Management Committee of EU COST ACTION B26.Sleep apnea as an independent risk factor for cardiovascular disease:current evidence,basic mechanic isms and research priorities[J].Eur Respir,2007,29(1):156-178.
[6]李 浩,吳 敏,姚明江,等.老年輕度認知功能障礙與氧自由基代謝、乙酰膽堿酯酶、血脂及炎性介質的關系[J].臨床神經病學雜志,2008,21(3):201-204.
[7]Smith DH,Okiyama K,Thomas MJ,et al.Evaluation of memory dysfunction following experimental brain injury using the Morris water maze[J].Neurotrauma,1991,8(4):259-269.
[8]王紅陽,韓曉慶,張盼盼,等.重度間歇低氧大鼠學習記憶功能與氧化應激的關系[J].中華結核和呼吸雜志,2012,35(1):34-36.
[9]譚毓治,萬曉霞,賴娟娟,等.葡萄籽原花青素對學習記憶的影響[J].中國藥理通學報,2004,4(7):804-807.
[10]趙雅寧,陳桂芝,陳長香,等.P38MAPK 信號通路對睡眠剝奪大鼠認知功能損害的機制研究[J].解剖學報,2011,42(1):32-37.
[11]袁 輝,楊 勝,周文霞,等.MAPK 級聯信號通路與長時程增強[J].中國藥理學通報,2006,22(7):769-774.
[12]Spaccapelo L,Bitto A,Galantucci M,et al.Melanocortin MC receptor agonists counteract late inflammatory and apoptotic responses and improve neuronal functionality after cerebral ischemia[J].Eur Phamacology,2011,670(2-3):479-486.
[13]Majde JA,Krueger JM.Links between the innate immunesystem and sleep[J].Allergy Clin Immunol,2005,116(6):1188-1198.

