監管和市場:我國藥品安全的現狀、挑戰及對策
胡穎廉
國家行政學院社會和文化教研部 北京 100089
·公共衛生·
監管和市場:我國藥品安全的現狀、挑戰及對策
胡穎廉?
國家行政學院社會和文化教研部 北京 100089
藥品安全是監管和技術命題,更具有深層次經濟社會背景。近年來我國藥品安全狀況總體穩定向好,但多重問題疊加且系統性風險突出。以監管政治學理論為框架,系統分析藥品安全問題中政府、產業、社會組織和消費者等利益相關方的行為及其關系。提煉出監管部門嵌入產業網絡不深,“小生產與大市場”的結構性矛盾,消費者群體安全焦慮與個體風險漠視并存三大問題。在此基礎上,建議從更新理念、合理化體制、擴展主體和優化手段四個方面,重構藥品安全監管體系頂層設計,從而真正實現從傳統政府監管向現代風險治理的轉變。
藥品安全;政府監管;市場機制;社會管理;風險治理
藥品是人類生存和發展的重要基礎,保障藥品安全是當今各國政府的基本職責。1998年國家藥品監督管理局成立后,我國開啟了現代化藥品安全監管的進程。15年來,監管體制、市場結構和社會環境都發生了變化,這些因素深刻影響到藥品安全形勢。近年來,我國相繼發生“齊二藥”、“刺五加”等藥品安全突發事件,帶來巨大損失;2012年“鉻超標藥用膠囊”事件更是超出了個體范疇,其危害已不再局限于特定批次的某類藥品,從而成為新中國成立以來爆發的第一次系統性、全局性藥品風險。因此,如何進一步全面提高藥品安全保障水平,成為理論和實踐中共同面臨的課題。
1 我國藥品安全現狀
藥品安全的內容分為質量安全(safety)和數量安全(security)兩項,前者指藥品的生產缺陷、錯誤用藥、副作用和其余不確定風險對人體健康不造成危害,也就是藥品質量安全有效和可控;后者則是本國醫藥產業提供的藥品數量及品種滿足消費者的基本需求,從而保障藥品可及性。[1]隨著經濟社會發展和人民生活水平提高,藥品質量安全受到全社會越來越多關注。
1.1 藥品安全狀況總體穩定趨好
國際上通常用三個指標來衡量一國藥品安全狀況:藥品抽檢合格率、百萬人口藥品不良反應(ADR)報告數和查處藥品案件涉案金額與醫藥工業總產值之比。1998年以來,我國藥品抽檢不合格率已從10%左右下降至5%以下,并保持穩定。2011年我國國家藥品評價性抽驗不合格率為3.18%,基本藥物不合格率僅為3%。[2]百萬人口藥品不良反應報告數達637份,監測報告率在數量上連續多年接近發達國家水平(圖1)。假劣藥品狀況也大有好轉,查處案件金額占醫藥工業總產值比例從10年前的2.6‰下降到1‰左右。[3]83.2%的醫藥專業人士對居住地的藥品質量安全情況表示滿意。[4]
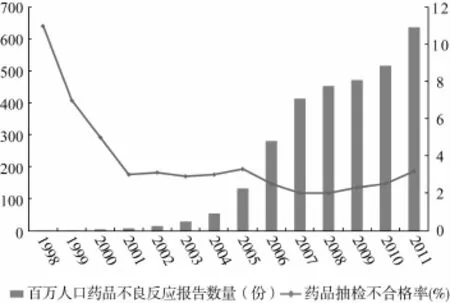
圖1 我國藥品安全狀況演進(1998—2011年)
1.2 轉型期多重問題疊加
世界近百年的經濟社會發展歷程表明,藥品安全問題呈現出一定歷史階段性,總體經歷了三個階段的變遷。20世紀初是以低水平制售假冒偽劣藥品為特征的“劣質藥品時代”,20世紀中期是以系統性風險為特征的“大工業藥品時代”,20世紀80年代之后則是以潛在未知因素為特征的“新型藥品時代”。改革開放30多年來,發達國家在不同時期漸次出現的問題在我國當前一段時期內集中出現。不僅有市場發育不成熟和生產水平低下帶來的假劣藥品問題;還存在風險社會特有問題,如新特藥的長期安全有效性;更有工業化生產蘊涵的系統性風險。在劇烈的經濟社會轉型中,當前我國處于藥品安全問題的“易發期”。[5]
1.3 藥品突發事件頻現且系統性風險突出
由于上述制度背景,加之產業發展水平、企業管理水平等因素制約,當前我國藥品安全基礎薄弱的狀況尚未根本轉變,藥品突發事件數量較多。具體包括,標準體系不健全,相當數量的藥品標準有待提高;藥品生產經營質量管理有待進一步規范;不合理用藥現象仍然突出。[6]此外,藥品市場存在非藥品冒充藥品、中成藥非法添加、非法藥品廣告泛濫、互聯網藥品交易秩序混亂等問題。2006年以來,我國先后發生了“奧美定”、“齊二藥”、“欣弗”、“甲氨喋呤”等重大藥害事件,導致數百人死亡或受到嚴重傷害。與此同時,以“鉻超標藥用膠囊”事件為代表的藥品系統性風險日益突出。與單個藥品突發事件或惡意制售假藥不同,藥品系統性風險具有全局性、普遍性、長期性等特征。系統性風險一旦發生,市場主體很難獨善其身,因此會帶來極其巨大的損失。
2 政府、產業和社會:藥品安全監管的政治學解讀
與國外學者從社會科學視角系統探討藥品安全問題不同[7],國內學術界在分析問題時還更多聚焦于設備、標準和檢驗檢測等技術層面,僅有少數學者從法律、政策和產業等視角進行過有益嘗試,歸納而言有兩類視角。一是從宏觀層面,有學者認為產業素質不高和產業結構不合理是我國藥品安全基礎薄弱的最大制約因素[8];也有研究指出規制政策制定過程中的全能主義國家慣性,使監管者無法專注于藥品質量安全[9]。二是從微觀層面,有研究從法條表述、技術支撐和隊伍素質等方面歷數了中國藥監改革的困境[10];還有研究指出能力不足是制約藥品監管有效性的關鍵[11]。
既有研究為我們提供了啟示,但也存在不足。宏觀層面的研究可以提供藥品安全問題的制度全貌,然而宏觀視角的缺點是簡化了不同利益相關方行為和關系等要素,從而影響結論的信度。對微觀領域的關注雖可以彌補其缺陷,卻容易因此而忽視其他重要因素。監管政治學研究(regulatory politics study)為我們提供了更為全面的分析框架。[12]該理論選取監管部門、產業、社會組織和消費者等利益相關方,將其置于一國政治經濟大背景下,系統分析其相互關系及行為對監管績效的影響①監管政治學的理論視角主要有三類。一是制度分析,將特定監管事件放到經濟社會背景中考察,通過歷史、比較等分析方法,找尋影響事件發展的宏觀制度變量。二是組織行為分析,將機構能力和自主性作為解釋監管績效的兩大變量,具體包括機構所嵌入社會網絡的疏密、決策是否具有一致性等指標。三是利益相關者分析,將政治家、技術官僚、企業家和消費者都假定為理性人,各方出于自我利益最大化的激勵在政策舞臺上相互博弈,共同推動監管政策的演進。,并被廣泛運用于監管型國家、食品藥品、安全生產、環境保護等社會性監管領域。[13-14]本文即采用這一理論展開分析。
藥品質量安全的組成要素包括監督管理、生產過程與合理使用三部分,其責任主體分別對應政府、企業和消費者。其中,政府用行政和技術手段對藥品進行監督管理,如標準、許可和抽檢等;企業在研發、生產和經營過程中,通過內部管理體系提高藥品質量;消費者在使用環節的觀念和行為同樣對藥品安全產生作用。監管政治學的基本假設是政府、產業和社會因素都會對監管績效產生本質影響。
2.1 政企關系:監管部門嵌入醫藥產業網絡不深
政府與企業關系是政治經濟學永恒的命題。在我國現行法律框架下,地方政府對藥品安全負總責,企業是第一責任人,監管部門各司其職。然而,政企關系在不同發展階段存在差異。在計劃經濟時代,政府為滿足民眾基本生活需求,將醫藥產業看做福利事業,用行政手段直接干預企業生產經營行為。[15]在市場經濟發展初期,政府通過行業管理手段扶持國有藥企發展,同時引導社會投資。而當市場經濟發展到一定階段,政府主要行使監督管理職能。歸納而言,政府角色經歷了從所有者到經營者再到監管者的轉變。
發達國家經驗表明,大工業條件下的藥品生產具有極強的專業性,例如產品風險監測,生產過程中的風險點分析以及新型藥物的長期安全有效性,這些都要求監管部門深入了解產業和產品。美國食品和藥物管理局(Food and Drug Administration,FDA)是全球公認的藥品監管標桿機構,FDA的成功經驗之一便是在新藥研發、注冊準入、上市后監管等階段都保持與企業良好溝通,并鼓勵企業通過創新提升質量水平。[16]作為典型的東亞“發展型國家”,日本產業政策部門的高官與大型制藥企業高管之間保持交互任職的“旋轉門”[17],這樣可以實現充分溝通而不是放任市場無序發展。可見,藥品監管不僅要解決藥品安全有效問題,而且要通過監管政策的落實,引導醫藥產業健康發展。20世紀末,我國藥監部門提出“以監督為中心,監、幫、促相結合”的工作方針[18],試圖在保障藥品質量安全的同時促進產業發展。然而受藥害事故和部分藥監官員腐敗案件影響,這一方針受到質疑。后來,監管者提出科學監管理念,要解決好“為誰監管、怎樣監管”這個根本問題。盡管這一提法在當時具有合理性,但我們不能就此割裂政府與企業間應有的密切聯系。事實上,更為重要的是區分藥監部門和藥監官員個人與醫藥產業的關系,一方面,如果官員與企業的關系過于密切則容易帶來尋租,造成藥監系統腐敗,需要予以監管規避;另一方面,監管部門則必須與產業保持密切的聯系,否則會由于對企業生產經營實際缺乏了解而造成監管不力,反應滯后。
當監管部門對產業缺乏了解時,容易通過注冊、認證等“一次性監管”的靜態方式嚴控企業資質,而不是采取多元化的動態監管。這就導致企業只追求獲得行政許可,而忽視了生產經營過程中的質量控制。“一次性監管”的弊端很多,譬如導致藥品臨床試驗中高準入門檻與數據普遍造假并存,又如近年發生藥害事故的都是通過了藥品生產質量管理規范認證(Good Manufacturing Practice,GMP)的大型正規企業。盡管監管部門通過駐廠監督員、飛行檢查等方式加以彌補,但“重審批,輕監管”的思維慣性依然存在,不利于提升監管績效。
2.2 經濟社會基礎:“小生產與大市場”的結構性矛盾
政府監管的根本目標是糾正市場失靈,因此監管是規范市場機制的補充而非替代,市場本身是監管活動存在的基礎。然而,我國藥品安全缺乏深層次經濟社會基礎支撐。發達國家經驗表明,消費結構與食品藥品安全狀況具有顯著相關性。當一國恩格爾系數處于50%以上時,消費結構為生存型,政府為保障民眾基本用藥需求牢牢掌控醫藥產業,藥品安全事件不易發生(階段A);當系數在40%~50%時,消費結構處于生存和發展兼顧型,此時監管體系改革通常滯后于產業的急劇擴張,藥品安全事件呈高發態勢(階段B);而當系數低于40%時,消費結構進入發展型階段,產業和監管均趨于完善,藥品安全狀況也趨于好轉(階段C)。[19]歸納而言,藥品安全現代化的階段性特征呈“倒U字形”曲線變化規律(圖2)。
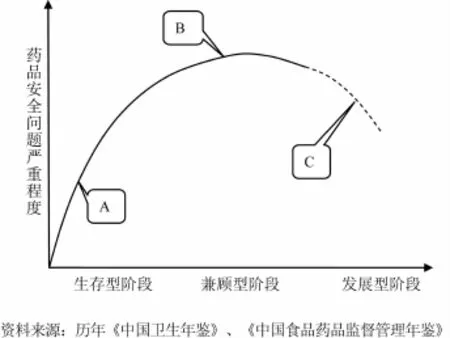
圖2 一國藥品安全形勢的“倒U字形”曲線
新中國醫藥產業是為了解決人民群眾缺醫少藥問題而建立的,藥品生產企業在整體上形成“多、小、散、低”的格局,至今尚未根本改變。[20]然而,隨著消費者對藥品質量、療效、品種等需求大幅提升,我國醫藥產業已經成為融入全球的大市場。于是,“小生產與大市場”不相匹配的結構性矛盾,成為藥品風險的制度根源。當前,我國許多地區的恩格爾系數在40%~50%之間,整體需求層次偏低,客觀上給低質量藥品提供了生存空間,藥品安全問題呈易發態勢。經濟學理論認為需求決定供給,正是由于低端市場的廣泛存在,誘發了企業機會主義行為。[21]加之藥品定價、招標采購機制不甚完善,個別藥品生產經營者采取低質低價競爭的策略吸引消費者。現實中存在“一個中國,三個世界”的藥品市場城鄉差異,即價格高昂的進口藥和“原研藥”占據了大城市三甲醫院60%左右市場份額,中小城市多是國內企業的品牌仿制藥,農村地區則以價格低廉的藥品為主。尤其是在流動人口密集的城郊結合部和“城中村”,假劣藥品給農民工等低收入群體帶來很大威脅。在2012年“鉻超標藥用膠囊”事件檢測出問題的各類藥品中,低價普藥占了大多數。[22]
同樣重要的是公民社會的作用,行業協會在其中扮演重要角色。作為嵌入到產業內部的社會中介組織,行業協會具有了解企業并接近政府的優勢,能夠發揮雙方信息傳遞的“橋梁”作用。事實上,在已經發生的食品藥品安全事件中,行業協會沒有充分發揮監督作用,是導致系統性風險爆發的原因之一。盡管我們并不否認行業協會可能代表企業訴求并積極為其爭取利益,但其積極作用是不容忽視的。換言之,政府監管只是影響績效的一個因素,不能把保障藥品安全的希望完全寄托在監管者身上。這就是為什么業內經常講“藥品安全是生產出來的,而不是監管出來的”。[23]
2.3 消費者心態:群體安全焦慮與個體風險漠視并存
藥品生命周期包括研制、生產、經營和使用四個環節,因此消費者在藥品使用中的心態和行為十分關鍵。然而,當前我國社會存在群體安全焦慮與個體風險漠視并存的問題。該現象的特征是“對于關系個人的風險意識較強,而對關系到群體或社會的風險重視不夠;對于突發的、傷害性大的風險警惕性較高,而對緩釋性的、無直接生命傷害的風險防范不足。”[24]藥品是體驗性商品,存在明顯的信息不對稱性,藥品安全在醫藥產業的高速擴張中越來越具有不可預測性。盡管人們對藥害事故深惡痛絕,卻不愿意從自身做起主動防范潛在風險。現實中,掌握合理用藥知識并定期清理家庭藥箱的人并不多,更少有人主動制止假藥販子在街頭收購過期藥品行為。除了醫療機構濫用藥物,民眾因缺乏自我藥療知識而超劑量、超范圍用藥,是導致基層藥品安全問題的重要原因。更令人驚訝的是,高達62%的消費者在遇到問題食品藥品時不知該如何投訴,并且主觀地認為投訴了也沒用,最終消極地選擇忍耐。[25]
正是全社會對藥品安全的矛盾心態,滋長了生產經營者的違法意愿。因為企業認為只要“問題藥品”不帶來直接的致命風險,就會得到消費者寬容,被監管部門查處的可能性也很小。由于企業違法違規的具體形式不盡相同,藥品安全問題也就陷入防不勝防的境地。即便被查處后,一些企業也存有僥幸心理,社會環境一旦固化,就會對新進入者的行為產生影響,從而形成惡性循環。
歸納而言,松散的政企關系使監管部門越來越脫嵌于醫藥產業,復雜的經濟社會基礎給低質量藥品帶來生存空間,而藥品生產經營者所處的社會環境導致其產生可以違法的主觀意愿。“敢于違法”、“值得違法”和“愿意違法”構成了轉型期我國藥品安全問題易發的邏輯鏈條。監管政治學視野下的我國藥品安全問題生成機制如表1所示。
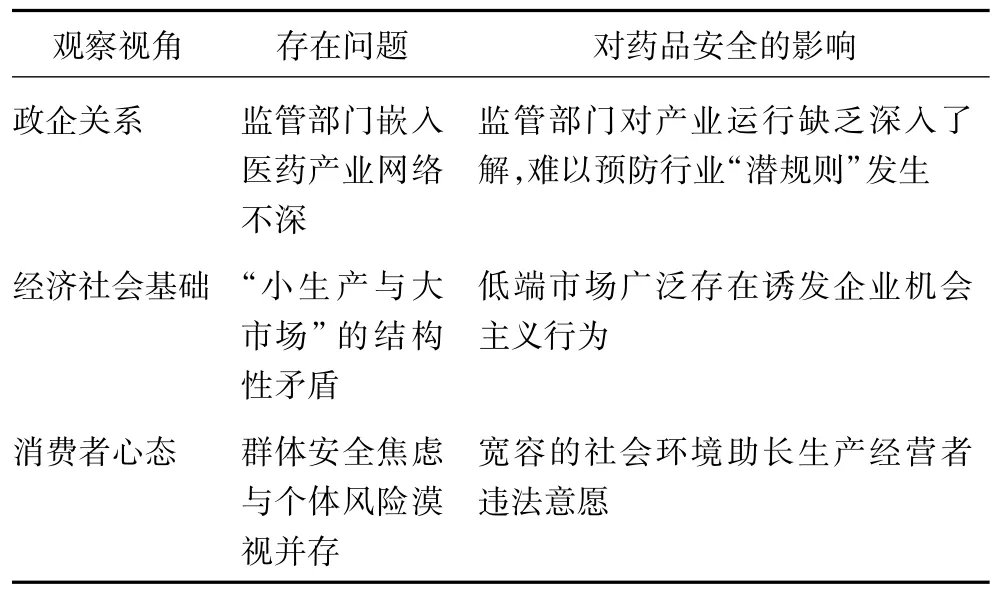
表1 監管政治學視野下的我國藥品安全問題生成機制
3 從監管到治理:重構藥品安全工作體系的模式
總之,要從根本上提高藥品安全保障水平,不能滿足于提高藥品標準、加強監管執法等技術層面的微調,而應從理念、體制、主體和手段等頂層設計要素入手,重構我國藥品安全監管體系,實現從傳統政府監管到現代風險治理的轉變。
3.1 理念重構:建立藥品安全風險分析框架
新一代國家應急管理體系的主要特征是從被動應急向主動防范轉變,理想的食品藥品管理應當是建立在風險分析基礎上的預防性體系。[26]風險分析框架由風險評估、風險管理和風險溝通3部分組成。風險評估是指生物、化學、物理等危害對人體健康產生的已知或潛在不良作用的可能性評價,這是一項專家獨立完成的純科學技術過程,其任務是得出各種危害對健康不良作用的性質和最大安全暴露量。風險管理是監管部門根據當地經濟社會因素和風險分析結果決定可接受的風險水平,包括制定和實施法規、標準并采取監管措施,屬于政府部門的工作。不論是專家的風險評估結果抑或政府的風險管理決策,都要讓不同利益相關者知曉,這一過程就是風險溝通,專家、政府、媒體、企業和消費者都參與其中。
以往,對藥品安全突發事件應急處置中投入大量精力,卻忽視了風險源頭治理。要提高我國藥品安全保障水平,就必須在監管工作中引入風險分析框架,實現由應急管理向風險治理轉變。
一是風險評估的重心下移。改變以往藥品風險評估工作集中在國家層面的做法,包括通過不良反應報告系統監測新發和區域性藥品風險,用更加嚴格的日常監督性抽驗掌握全行業藥品質量動態,同時加大新特藥未知風險的基礎性研究。下移風險評估重心的目的是科學預警,防范類似“鉻超標藥用膠囊”事件這樣的系統性風險爆發。
二是風險管理的關口前移。產業素質不高嚴重制約我國藥品安全基礎,因此不妨以實施《國家藥品安全“十二五”規劃》為契機,完善藥品產業政策,調整產業和產品結構,提升藥品生產經營企業素質和管理能力,從而落實藥品安全企業主體責任。關口前移是為了實現源頭治理,形成藥品安全“防火墻”。近年來,發展改革、工信和商務等產業部門越來越多地參與到監管政策制定中,形成政策合力。同時,國家食品藥品監督管理部門開始出現一些具有基層藥廠工作經歷的高層管理者。監管部門也正在考慮重新擔負起對從業人員進行培訓的職責。
三是風險溝通的主體外移。具體可通過各種傳媒渠道教育重點人群,尤其是引導慢性病患者和老年人等藥品消費量大的人群從正規渠道選購藥品,謹慎通過互聯網購藥。在流動人口和低收入群體中大力普及藥品安全知識,讓低質量藥品沒有生存空間。同時,加大藥品安全信息服務力度,各地可探索組建“藥品安全義工隊”,發動具有一定專業知識的志愿者走進城鄉社區和工礦廣泛宣傳日常藥品安全知識,營造全社會關心藥品安全的良好氛圍。
3.2 體制重構:合理化藥品監管省以下垂直管理
判斷一項事務是否需要進行垂直管理,主要取決于其外部性大小。成本外溢性小的事務可以用本地化策略應對,反之則需要在更高層次統籌,否則會出現政府失靈。藥品風險在現代社會越來越具有跨區域流動性,分散的本地監管機構很難單獨應對,因此發達國家的經驗是藥品監管權力上收、集中和強化。
然而,我國正在經歷藥監權力下放和分散的反向運動。2008年中央調整藥品監管機構省以下垂直管理,實行屬地化分級管理,該做法在實踐中產生一系列問題。對體制進行合理化改革的當務之急是,防止地方保護主義抬頭,實現藥品的跨區域風險治理。在新一輪國務院機構改革整合有關部門食品安全監管職權后,有必要重新審視省以下食品藥品監管體制。
一是確保省以下藥品技術監督機構的獨立性。地市級藥品技術監督機構可以作為省級藥品技術監督機構的派出機構,直屬于省級食品藥品監督管理部門。有條件的地區可以將藥檢機構和不良反應監測機構設到縣一級,人事、財務和資產相應上劃。這樣既不改變“地方政府負總責”的責任體系,又起到技術監督制約行政監督的作用,遏制地方保護。
二是設立跨區域藥監督察機構。為應對大工業生產中藥品風險的流動性特征,需要超脫于本地的機構進行綜合協調和全鏈條查處。可以在全國設立若干個直屬于國家食品藥品監督管理局的跨區域督察機構,進一步推進統一市場建立。
三是提升地方藥監局長業務素質。省以下地方各級政府在任命藥監局長之前,應征求省級藥監部門意見,盡可能保障其專業水平和勝任力。
3.3 主體重構:充分發動各利益相關方“共治共享”
過去,藥品監管工作一直被納入醫藥衛生事業的范疇,是政府市場監管職能的組成部分。黨的十八大報告進一步將改革和完善藥品監管體制機制作為社會建設的重要內容,并把藥品安全上升到“提高人民健康水平”的新高度。2013年國務院機構改革組建國家食品藥品監督管理總局,要求食品藥品監督管理部門轉變管理理念,創新管理方式,充分發揮市場機制、行業自律和社會監督作用,建立讓生產經營者真正成為食品藥品安全第一責任人的有效機制。[27]因此,有必要把“黨委領導、政府負責、社會協同、公眾參與和法治保障”的社會管理體制延伸到藥品安全工作中,形成“主責在企業,主體是民眾,主導靠政府”的藥品安全工作新格局。
首先,完善消費者投訴反饋機制,參照食品安全監管領域的做法提高藥品安全舉報獎勵額度。[28]這一做法的目的是暢通消費者訴求表達渠道,發揮其嵌入基層并擁有社會網絡的優勢獲取藥品安全信息。
其次,發揮行業協會了解企業、接近政府的優勢,擔負起監管部門與醫藥行業的“橋梁”作用,把監管外壓變成企業提高生產質量的內在行動。例如協會可以牽頭設立“藥品質量安全保證基金”,要求企業在取得會員資格前簽署生產質量行為規范承諾并交納保證金,對于違反承諾者扣除相應數額保證金甚至取消會員資格,從而用經濟激勵倒逼企業行為。[29]
3.4 手段重構:構建多元、動態和柔性的立體治理體系
傳統藥品監管主要依靠單一且剛性的行政手段,如審批、罰款、吊證等,這種靜態監管方式不利于應對藥品系統性風險。有必要綜合運用宣教、經濟、網絡等柔性管理手段,全方位應對當前的系統性藥品風險。
一是市場激勵手段。通過市場機制激勵藥品生產經營者主動守法,能夠有效降低監管成本。藥監部門剛剛實施的藥品安全“黑名單”制度便是典型,通過公布具有嚴重違法行為的企業名單,降低其產品的市場聲譽,進而影響其經濟效益,倒逼企業提高內部質量管理水平。
二是宣傳引導手段。有必要在全社會加大誠信宣傳力度,讓藥品生產經營者意識到自己同時也是藥品的消費者。
三是虛擬社會手段。互聯網有利于將傳統的科層管理變為扁平化治理,從而降低工作成本。目前國家食品藥品監管總局政務微博“中國食品藥品監管”(CFDA)已有“粉絲”190多萬,產生了較大社會影響。建議有條件的縣級以上藥監部門都開通政務微博,發揮普及藥品安全知識,收集投訴舉報線索,發布案件處理信息的作用。
[1]FDA.Managing the Risks from Medical Products Use:Creating a Risk Management Framework[EB/OL].(1999-05-01)[2013-06-01].http://www.fda.gov/Safety/Safetyof-SpecificProducts/ucm180325.htm
[2]新華社.2011年我國國家藥品評價性抽驗合格率已超過96%[EB/OL].(2011-12-28)[2013-01-24].http://www.gov.cn/jrzg/2011-12/28/content_2032349.htm
[3]人民網.藥品不良反應監測百萬人口報告率533份[EB/OL].(2011-11-21)[2013-04-04].http://health. people.com.cn/GB/16316812.html
[4]國家食品藥品監督管理局辦公室,南方醫藥經濟研究所.藥品安全形勢評估報告(2011年度)[R].2012.
[5]胡穎廉.食品藥品安全事件為何“扎堆”出現[N].中國醫藥報,2012-05-04.
[6]邵明立.食品藥品監管人的生命安全始終至高無上[N].人民日報,2009-03-02.
[7]胡穎廉,傅凱思.從政治科學、商業利益和公共政策視角研究國外藥品安全監管[J].中國藥事,2008(12):1043-1050.
[8]劉鵬.轉型中的監管型國家建設——基于對中國藥品管理體制變遷(1949—2008)的案例研究[M].北京:中國社會科學出版社,2011.
[9]宋華琳.政府規制改革的成因與動力——以晚近中國藥品安全規制為中心的觀察[J].管理世界,2008(9):40-51.
[10]邵蓉,董耿,孫利華.十年藥監路[J].中國處方藥,2008(3):24-30.
[11]呂景勝.論深化藥品監管體制改革[J].中國軟科學,2004(3):157-160.
[13]Giandomenico M.From the Positive to the Regulatory State:Causes and Consequences of Changes in the Mode of Governance[J].Journal of Public Policy,1997,17(2):139-167.
[14]Carpenter D.The Forging of Bureaucratic Autonomy:Reputation,Networks,and Policy Innovation in Executive A-gencies[M].Princeton,NJ:Princeton University Press,2001.
[15]Lampton D.Administration of the Pharmaceutical,Research,Public Health,and Population Bureaucracies[J]. China Quarterly,1978(74):385-400.
[16]Hamburg M.How Smart Regulation Supports Public Health and Private Enterprise[EB/OL].(2012-02-06)[2013-04-04].http://www.commonwealthclub.org/events/2012-02-06/margaret-hamburg-fda-chief-special-event-luncheon
[17]Chalmers,Johnson.MITIand the Japanese Miracle[M]. Stanford:Stanford University Press,1982.
[18]中國藥品監督管理年鑒(2001年)[M].北京:化學工業出版社,2001.
[19]陳曉華.完善農產品質量安全監管的思路和舉措[J].行政管理改革,2011(6):14-49.
[20]富子梅.專訪國家食品藥品監督管理局局長尹力:百姓用藥,要“有”更要“好”[N].人民日報,2013-01-18.
[21]劉亞平.中國式“監管國家”的問題與反思:以食品安全為例[J].政治學研究,2011(2):69-79.
[22]國家食品藥品監督管理局.鉻超標膠囊劑藥品基本查清抽檢結果已向社會公布[EB/OL].(2012-05-25)[2013-02-10].http://www.sfda.gov.cn/WS01/CL0051/72032.html
[23]國家食品藥品監督管理局.吳湞副局長出席中國(海口)國際醫藥高峰論壇[EB/OL].(2007-03-28)[2013-02-10].http://www.sda.gov.cn/WS01/CL0048/187.htm l
[24]王俊秀.中國社會心態:問題與建議[J].中國黨政干部論壇,2011(5):40-44.
[25]楊文彥,陳景收.食品安全刻不容緩逾六成網民表示遇問題食品選擇忍耐[EB/OL].(2012-02-26)[2013-02-10].http://politics.people.com.cn/GB/17219823.html
[26]FAO.Food Safety Risk Analysis:A Guide for National Food Safety Authorities[R].Rome,Italy:FAO Food and Nutrition Paper,2006.
[27]馬凱.關于國務院機構改革和職能轉變方案的說明[EB/OL].(2013-03-10)[2013-06-01].http://www. gov.cn/2013lh/content_2350848.htm
[28]國家食品藥品監管局、財政部聯合發布《食品藥品違法行為舉報獎勵辦法》[EB/OL].(2013-01-15)[2013-02-10].http://www.sfda.gov.cn/WS01/CL0051/77675.html
[29]薛瀾.胡穎廉.“三重失靈”:監管政治學視閾中的“鉻超標膠囊”[J].行政管理改革,2012(9):31-36.
Regulation and themarket of drug safety in China:current Status,challenges and policies
HU Ying-lian
Department of Social&Cultural Studies,Chinese Academy of Governance,Beijing 100089,China
Drug safety is not only a regulatory and technical issue,but is also embedded in a socio-economic background.In recent years,the drug safety in China has been stable on the whole,but at the same time has seen various problems and systematic risks.Taking regulatory political theory as a framework,systematic analysis of drug safety problems in terms of government,industry,societal institutions,and consumers will be conducted.There are three problems that exist currently in China,including inadequate regulatory involvement in industry networks,the institutional dilemma of"small producers and big markets",and the coexistence of consumer group safety concerns and individual risk disregarding.On this foundation,itwill be recommended that a four-pronged approach be taken of updating theories,standardizing systems,expanding influence,and improvingmethods,with the goal of restructuring the upper levels of the drug safety regulatory system.In thisway,a true transformation from traditional government regulation,to amoremodern risk government can be achieved.
Drug safety;Government regulation;Marketmechanism;Socialmanagement;Risk government
R951
A
10.3969/j.issn.1674-2982.2013.07.007
2013-02-22
2013-06-14
(編輯 劉 博)
國家自然科學基金(91224009);國務院應急辦委托項目
胡穎廉,男(1982年—),博士,副教授,清華大學中國應急管理研究基地兼職研究員,主要研究方向為政府監管、社會管理。E-mail:huyl@nsa.gov.cn

