重鉻酸銨清潔生產新工藝
劉昌見
[中國石油大學(北京)CNPC催化重點實驗室,北京 102249]
環境·健康·安全
重鉻酸銨清潔生產新工藝
劉昌見
[中國石油大學(北京)CNPC催化重點實驗室,北京 102249]
摘要:將鉻酸鈉碳氨轉化得到的NaNH4CrO4·2H2O復鹽結晶,經低溫熱分解得到鉻酸鈉和重鉻酸銨,以這2個產物為原料經重結晶可以制備重鉻酸銨產品。測定了Na2CrO4-(NH4)2Cr2O7-H2O體系的溶解度和相圖,并以此為依據對熱分解產物的重結晶分離制備重鉻酸銨過程進行分析。結果表明:鉻酸鈉和重鉻酸銨混合物經高溫(100℃)溶解-冷卻(50℃)結晶可以制備得到高純度的重鉻酸銨產品,收率為76.8%,母液可以蒸氨制備重鉻酸鈉,氨可在工藝中循環。該工藝具有清潔、環保的特點。
關鍵詞:重鉻酸銨;清潔工藝;溶解度;相圖分析
重鉻酸銨[(NH4)2Cr2O7]是鉻鹽產品中附加值較高的產品之一,主要用于催化劑、磁性材料、合成染料、鞣革和陶瓷釉料等。目前,國內外鉻鹽工業一般采用重鉻酸鈉氯化銨(Na2Cr2O7)復分解反應生成重鉻酸銨。每生產1t重鉻酸銨產品消耗氯化銨450kg,同時副產氯化鈉600 kg。即生產中的純堿轉化為比它價值更低的副產品氯化鈉,同時還要消耗大量的氯化銨,且氯化鈉中通常還殘留0.5%(質量分數)左右的重鉻酸鈉。這一方面造成鉻的損失,另外含Cr6+的氯化鈉的處理及利用也是一大難題[1]。
針對鉻鹽工業的重污染難題,中科院過程工程研究所開發了熔鹽液相氧化-碳氨轉化鉻鹽清潔生產新工藝。該工藝是在不添加其他輔料的條件下將鉻鐵礦與熔融燒堿進行液相氧化反應,得到中間產品為鉻酸鈉晶體,再經碳氨轉化過程生產其他鉻鹽產品,鈉、氨與二氧化碳完全實現工藝內循環,基本不產生污染[2]。前期研究工作中發現鉻酸鈉碳銨轉化反應過程析出的是鉻酸銨鈉復鹽結晶NaNH4CrO4·2H2O[3-4],進一步研究發現NaNH4CrO4·2H2O在低溫條件下熱分解產物為鉻酸鈉和重鉻酸銨,高溫條件下分解產物為三氧化二鉻、重鉻酸鈉和鉻酸鈉的混合物[5]。筆者據此研究了利用NaNH4CrO4·2H2O低溫熱分解、重結晶制備重鉻酸銨產品的清潔生產新過程。
1 實驗
1.1溶解度的測定
以鉻酸鈉(AR)和重鉻酸銨試劑(AR)為原料,采用等溫合成復體法測定體系各組分的溶解度[6]。精確稱量各組分,在250 mL的高壓聚乙烯瓶中配制成溶液與固相混合體系,置入超級水浴恒溫槽內(±0.5℃),從溶液中取樣分析,待其組成基本不變時,測定溶液中各組成離子濃度,采用化學分析和X射線衍射分析以確定平衡固相的組成。
1.2Na+、NH4+、Cr6+的分析
Na+采用原子吸收分光光度法測定[7];CrO42-的濃度采用硫酸亞鐵銨-硫酸標準溶液滴定法測定;NH4+采用甲醛法測定。
1.3重鉻酸銨的制備
以重鉻酸鈉試劑(AR)為原料,與氨水(AR)按1∶1(物質的量比)反應,冷卻結晶得到NaNH4CrO4· 2H2O,在控溫180℃(±1℃)的烘箱中熱分解至恒重。
2 結果與討論
2.1NaNH4CrO4·2H2O的熱分解
含銨鉻酸鹽受熱容易分解,鉻酸銨在低于180℃條件下首先分解為重鉻酸銨。與鉻酸銨的熱分解相似,在低于180℃的條件下,NaNH4CrO4·2H2O首先發生結晶水的脫除和銨的部分分解,生成鉻酸鈉和重鉻酸銨,二者物質的量比為2。
2.2Na2CrO4-(NH4)2Cr2O7-H2O體系溶解度與相圖
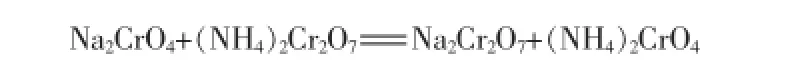
熱分解產物為鉻酸鈉與重鉻酸銨的混合物,將此混合物溶解在水溶液中,可能會發生復分解反應,反應式為:標準狀態下該反應的吉布斯自由能ΔG=(-431.18-209.3)-(-299.15-348.9)=7.57>0,上述復分解反應不能夠自發進行。表明Na2CrO4和(NH4)2Cr2O7是穩定的鹽對,可以通過溶解度差異進行重結晶分離得到重鉻酸銨產品。
表1是50℃時Na2CrO4-(NH4)2Cr2O7-H2O體系的溶解度,并根據溶解度數據繪制出該體系的相圖(圖1)。同時還測定了不同溫度下Na2CrO4-(NH4)2Cr2O7共飽和時體系溶液的組成(表2)。
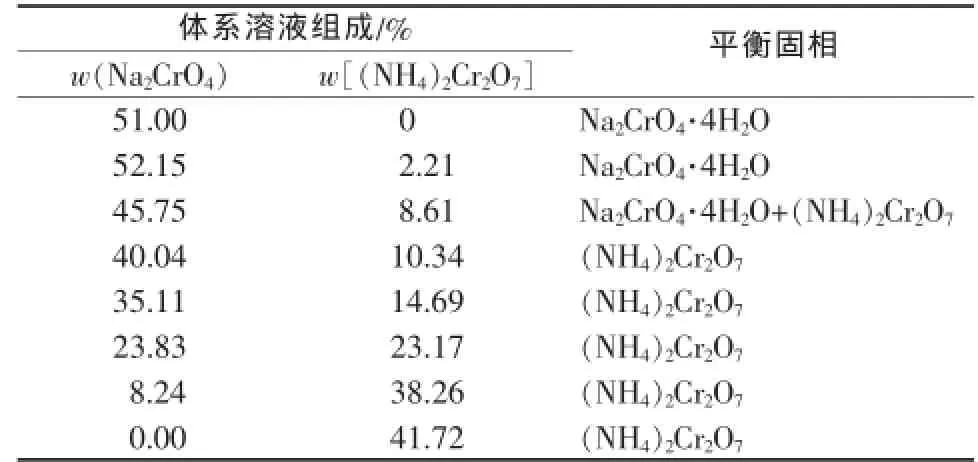
表150 ℃時Na2CrO4-(NH4)2Cr2O7-H2O體系溶解度
由表1和圖1可以看出,體系中鉻酸鈉的溶解度略有偏高,在部分區域內超過鉻酸鈉單獨存在的溶解度。這是由于在測定體系溶解度時,取樣或密封不嚴使體系中少量的氨揮發所致,體系達到平衡時,部分重鉻酸銨會轉化為重鉻酸鈉。由圖1可見,Na2CrO4結晶區較小,(NH4)2Cr2O7的結晶區較大。

圖1 Na2CrO4-(NH4)2Cr2O7-H2O體系相圖
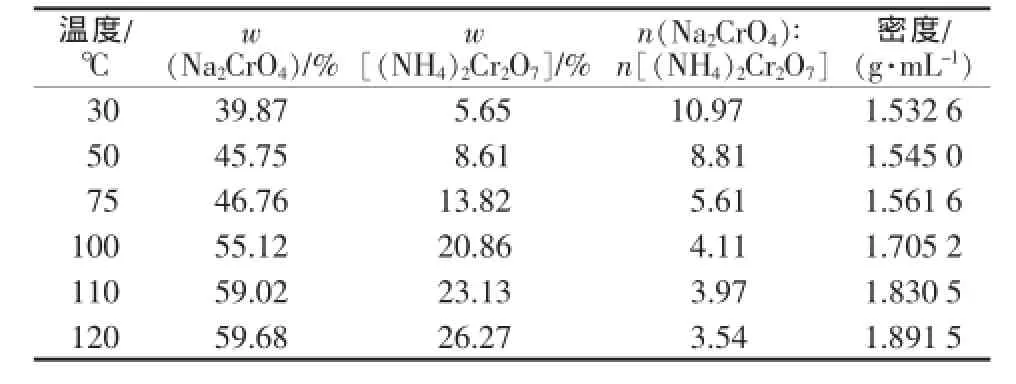
表2 Na2CrO4、(NH4)2Cr2O7共飽和時體系中溶液的組成
由2.1節可知,鉻酸銨鈉復鹽結晶熱分解得到的混合物中,鉻酸鈉與重鉻酸銨的物質的量比為2∶1。由表2可以看出,在30~120℃時溶液中鉻酸鈉與重鉻酸銨物質的量比都遠大于2,這表明熱分解產物溶解時,鉻酸鈉更多地溶解進入溶液中,而重鉻酸銨則留在固相中。而且隨著溫度降低,這種趨勢更加明顯,在30℃溶解達到飽和時,溶液中鉻酸鈉與重鉻酸銨的物質的量比達到10.97,因此在較低的溫度時將鉻酸鈉和重鉻酸銨分離較為便利。但是在較低溫度下制備的重鉻酸銨產品晶形較差,且粒度較小,純度不高,影響產品質量。直接在50℃溶解分離、2次洗滌、80℃干燥得到的重鉻酸銨產品經分析純度為95.6%,只能作為工業級產品。如果先在較高的溫度下使鉻酸鈉和重鉻酸銨全部溶解,再降溫重結晶析出重鉻酸銨,這樣可以得到質量好的重鉻酸銨產品。
圖2為重鉻酸銨低溫熱分解制備相圖,根據圖2對其制備過程進行具體分析。圖2中E1JG1F1、E2KG2F2分別為50℃和100℃時鉻酸鈉重鉻酸銨三元體系的溶解度曲線,CE2G2、BG2F2分別為100℃時重鉻酸銨、鉻酸鈉的結晶區,G2BC為100℃時重鉻酸銨和鉻酸鈉的結晶區,CE1G1、BG1F1分別為50℃時重鉻酸銨、鉻酸鈉的結晶區,G1BC為50℃時重鉻酸銨和鉻酸鈉的結晶區。
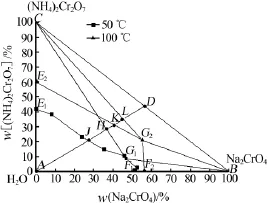
圖2 重鉻酸銨制備的相圖分析
鉻酸銨鈉復鹽晶體熱分解產物中鉻酸鈉和重鉻酸銨的質量分數分別為56.25%和43.75%,在相圖中為D點。先在100℃下向100 g該熱分解產物中加入水,鉻酸鈉和重鉻酸銨會溶解進入溶液相中,系統點沿DA線向A點移動,與重鉻酸銨的結晶區邊線CG2交于L點(44.8%、35%,前后分別為鉻酸鈉和重鉻酸銨的質量分數,下同),此時鉻酸鈉全部溶解,加入的水量為25.36 g,如繼續加水,體系繼續向A點移動,與E2G2線交于K點(40.5%、31%),此時重鉻酸銨和鉻酸鈉均全部溶解,需要加入的水量為40.22 g。如在50℃下加水溶解,體系點沿DA向A點移動,與CG1交于H點(36.5%、28.5%),此時鉻酸鈉全部溶解,要求加入的水量為53.94 g,大于100℃時鉻酸鈉和重鉻酸銨全部溶解所要求的水量。因此向100 g熱分解產物中加入53.94 g水,在100℃時鉻酸鈉和重鉻酸銨可全部溶解冷卻至50℃析出的重鉻酸銨結晶,體系沿HG1向G1(46.76%、8.61%)點移動,到達G1點重鉻酸銨剛好飽和,重鉻酸銨不再析出,此時析出的重鉻酸銨晶體質量:100×43.75%-[8.61/(100-46.76-8.61)]×53.94=33.36 g。100 g鉻酸銨鈉的低溫熱分解產物中重鉻酸銨為43.75 g。經結晶析出重鉻酸銨占熱分解產物中全部重鉻酸銨的質量分數:(33.36/43.75)×100%=76.8%。
先在100℃下溶解,再冷卻結晶、二次洗滌、80℃干燥得到的重鉻酸銨產品經分析純度為98.7%,達到照相級產品的要求。剩余含鉻酸鈉和重鉻酸銨的母液經蒸氨濃縮可以制備重鉻酸鈉產品,蒸發產生的氨和熱分解產生的氨可以返回鉻酸鈉的碳氨轉化工序中循環使用。
3 結論
鉻酸銨鈉復鹽晶體的低溫熱分解產物鉻酸鈉和重鉻酸銨混合物經高溫(100℃)溶解、冷卻結晶可以制備高附加值的重鉻酸銨產品,結晶率達76.8%,母液可以蒸氨濃縮制備重鉻酸鈉,整體工藝中氨實現循環,無其他副產物產生,工藝清潔、環保。
參考文獻:
[1]成思危,丁翼,楊春榮.鉻鹽生產工藝學[M].北京:化學工業出版社,1988:153.
[2]張懿,李佐虎,王志寬,等.綠色化學與鉻鹽工業的的新一代產業革命[J].化學進展,1998,10(2):172-178.
[3]劉昌見,張懿.鉻酸鈉碳氨轉化過程的相圖分析[J].物理化學學報,2004,20(11):1335-1338.
[4]劉昌見,張懿.鉻酸鈉碳氨轉化過程中鉻的析出形式[J].無機鹽工業,2003,35(6):20-21,48.
[5]劉昌見,張懿.鉻酸銨鈉復鹽結晶的熱分解[J].物理化學學報,2005,21(2):218-220.
[6]顧函珍,葉于浦.相平衡與相圖基礎[M].北京:北京大學出版社,1991:164.
[7]穆加鵬.原子吸收分析方法手冊[M].北京:原子能出版社,1989:65.
聯系方式:chjliu@cup.edu.cn
一種連續碳化反應裝置及應用其制備超細碳酸鈣的方法
本發明公開了一種連續碳化反應裝置及超細碳酸鈣的連續碳化制備方法,超細碳酸鈣的合成是在連續碳化反應裝置中進行,控制初始進入碳化器漿料的流量和窯氣進入各碳化器的流量,通過多級的碳化反應釜(器),從最后一級碳化反應器出口流出的漿料完成碳化反應,并獲得超細碳酸鈣漿料,控制漿料和窯氣的流量,氫氧化鈣漿料通過4~5級碳化反應器的碳化反應,合成的超細碳酸鈣粒徑分布均勻,質量穩定,同時整個碳化過程實現了連續碳化反應,產品的質量穩定,操作方便,可實現自動化操作。
CN,102849771
中圖分類號:TQ113.7
文獻標識碼:A
文章編號:1006-4990(2013)05-0041-03
收稿日期:2012-12-06
作者簡介:劉昌見(1969—),男,副教授,博士,主要從事清潔生產新工藝和萃取分離工程研究,已公開發表文章20余篇。
New clean process for ammonium dichromate production
Liu Changjian
[CNPC Key Lab.of Catalysis,China University of Petroleum(Beijing Campus),Beijing 102249,China]
Abstract:A new clean process for production of ammonium dichromate was developed by recrystallizing the low-temperature thermal decomposition products of sodium chromate(Na2CrO4)and ammonium dichromate from a double salt crystal,NaNH4CrO4·2H2O obtained from the carbonation process of Na2CrO4in ammonia solution.The solubility and phase diagram of Na2CrO4-(NH4)2Cr2O7-H2O system were determined.According to the solubility data and phase diagram,the recrystallizing separation process of thermal decomposition products to prepare ammonium dichromate was analyzed.Results showed that the high purity ammonium dichromate could be obtained by dissolving and cooling crystallizing the thermal decomposition products at 100℃and 50℃,respectively,and the yield of ammonium dichromate was 76.8%.Through ammonia still process,the mother solution could be reused,and the ammonia could be recycled in the process.Therefore,the process was cleaner and more environmentally friendly.
Key words:ammonium dichromate;clean process;solubility;phase diagram analysis

