葉酸、維生素B6和維生素B12對高同型半胱氨酸血癥大鼠心室重構的影響
王會芹,郭 宏,趙 慧
心室重構是引起心功能不全乃至心力衰竭的內在原因[1],以心肌肥厚、心肌細胞凋亡及某些細胞、非細胞成分(膠原纖維)的異常增加和心肌代謝及電生理的改變為特征。心室重構影響患者的長期預后,而給予血管緊張素轉換酶抑制劑(ACEI)等藥物尚不能充分抑制心室重構。近期研究表明,高同型半胱氨酸血癥(hyperhomocysteinemia,HHcy)可獨立于動脈粥樣硬化,直接損傷心肌細胞,引起心室重構[2-4]。基質金屬蛋白酶9(MMP-9)在多種心臟疾病的心室重構中發揮重要作用[5-7]。Chen等[8]臨床觀察發現老年人中HHcy患者與葉酸、維生素B6和維生素B12攝入量不足有關;Heinz等[9]、Glynn等[10]臨床研究表明補充充足的葉酸、維生素B6和維生素B12可有效降低HHcy患者血漿同型半胱氨酸(homocysteine,Hcy)水平。然而鮮見有文獻研究補充該組維生素是否可以抑制HHcy所致的心室重構。
本研究通過高蛋氨酸飲食喂養大鼠制造HHcy模型,同時給予葉酸、維生素B6和維生素B12降低血漿Hcy水平,觀察大鼠血漿Hcy水平降低的同時,心室的超聲學、病理組織學等是否改善,心肌細胞MMP-9的表達是否下降,以評價心室重構是否改善,為補充葉酸、維生素B6和維生素B12抑制心室重構提供實驗依據。
1 材料與方法
1.1實驗動物健康雄性Wistar大鼠60只,購自北京維通利華實驗動物技術有限公司〔許可證號SCXK(京)2002-003〕,由哈爾濱醫科大學第一臨床醫學院實驗動物中心飼養,飼養環境溫度為21~24 ℃,相對濕度(50±5)%,自然照明。體質量(BW)為(200±50)g,采用隨機數字表,將大鼠隨機分為正常組(A組)、HHcy模型組(B組)、藥物干預組(C組)3組,各20只。A、B、C組大鼠BW分別為 (198±52)g、(202±53)g、(200±49)g。
1.2試劑Hcy試劑盒(美國雅培公司);MMP-9放免分析試劑盒(武漢博士德生物工程有限公司);Masson 3色染色試劑盒(福州邁新生物技術開發有限公司);二氨基聯苯胺(DAB,北京中杉金橋生物技術有限公司)。
1.3方法
1.3.1動物模型制備A組大鼠喂食基礎飼料(全價顆粒飼料),B組大鼠喂食蛋氨酸飼料(基礎飼料加1.7%蛋氨酸),C組大鼠喂食蛋氨酸飼料加B族維生素(維生素B612 mg·kg-1·d-1、維生素B120.09 mg·kg-1·d-1、葉酸4 mg·kg-1·d-1)。各組大鼠自由進食飲水,連續喂食8周造模。喂食8周后,大鼠空腹6 h以上,用10%水合氯醛(3 ml/kg)腹腔注射麻醉,開腹,暴露下腔靜脈。用5 ml注射器采靜脈血2 ml,置入EDTA抗凝管中,半小時內3 000 r/min,離心10 min,取上層血漿-80 ℃保存,采用全自動化學發光法檢測Hcy水平,判斷大鼠造模是否成功。
1.3.2心臟彩超檢查大概喂食8周后,分別稱取BW及稱量包括室間隔在內的左心室質量(LVW)。將麻醉后的大鼠取仰臥位固定,胸前備皮,應用探頭頻率為14 MHz的彩色多普勒超聲診斷儀進行心臟彩超檢查。取胸骨旁左心長軸切面和左心室乳頭肌短軸切面,圖像分析左心室舒張末期內徑(left ventricular end-diastolic diameter,LVEDd)、左心室舒張末期后壁厚度(left ventricular end-diastolic posterior wall thickness,LVPWd),計算左心室射血分數(left ventricular ejection diameter,LVEF)、左心室短軸縮短率(fractional shortening,FS),FS按如下公式計算:FS(%)=(LVEDd-LVESd)/LVEDd×100%。
1.3.3病理組織學和免疫組織化學檢查用鋒利雙面刀片沿左心室正中橫切,取約0.5 cm×0.5 cm的左室游離壁中段組織,放入4%預冷的多聚甲醛中前固定,再以15%乙醇甲醛液后固定,經無水乙醇脫水、入蠟、包埋、機器切片5 μm、烘片后備用。冷凍切片蘇木素-伊紅(HE)染色檢查組織形態,顯微鏡下觀察心肌的變化、纖維組織增生情況。
心肌組織MMP-9免疫組化染色:取各組動物心肌石蠟切片,脫蠟、水化組織切片。以磷酸鹽緩沖液(PBS)替代一抗作為陰性對照;3%過氧化氫孵育5 min,阻斷內源性過氧化氫物酶;復合消化酶消化(胰酶消化),室溫10 min;分別滴加一抗抗體,4 ℃過夜,PBS沖洗5 min×3;滴加通用型IgG抗體(Fab段)-HRP多聚體,室溫或37 ℃孵育10 min,PBS沖洗5 min×3;DAB溶液顯色;蒸餾水沖洗、復染、脫水、封片。用計算機病理圖像分析系統的組化分析系統模塊進行圖像分析,計算MMP-9表達的陽性目標面密度(scale value,Sv)。
1.3.4心肌組織Masson 3色染色切片脫蠟處理至水;滴加1滴(100 μl)Masson復合染色液染色5 min。蒸餾水沖掉染液;滴加1滴(100 μl)磷鉬酸染色5 min,甩干;直接滴加1滴(100 μl)苯胺藍染色5 min蒸餾水稍沖;滴加1滴(100 μl)分化液分化30~60 s(2次);95%乙醇、無水乙醇脫水,透明,封固。Masson 3色染色中膠原纖維呈藍綠色,變性纖維泛白色,肌細胞呈紅色。用計算機病理圖像分析系統的組化分析系統模塊進行圖像分析,計算心肌膠原纖維的陽性目標Sv。
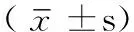
2 結果
2.1血漿Hcy水平比較大鼠喂食8周后,A組大鼠血漿Hcy水平為(9.2±0.9)μmol/L,B組為(39.2±2.1)μmol/L,C組為(11.2±1.3)μmol/L。3組大鼠血漿Hcy水平比較,差異有統計學意義(F=11.52,P=0.003);其中A組、C組大鼠血漿Hcy水平與B組比較,差異均有統計學意義(P<0.01)。
2.2大鼠LVW及LVW/BW于實驗前及實驗8周后,測定每組7只大鼠的LVW及BW。實驗前,3組大鼠BW、LVW、LVW/BW比較,差異均無統計學意義(P>0.05);實驗8周后,3組大鼠BW、LVW、LVW/BW比較,差異均有統計學意義(P<0.05);其中B組、C組大鼠LVW/BW與A組比較,C組大鼠LVW/BW與B組比較,差異均有統計學意義(P<0.01,見表1)。
2.3大鼠心功能測定實驗8周后,分別檢測3組大鼠的心功能。結果顯示,3組大鼠EF、LVEDd、LVPWd、FS比較,差異均有統計學意義(P<0.01);其中B、C組大鼠上述4項指標與A組比較,C組大鼠上述4項指標與B組比較,差異亦有統計學意義(P<0.01,見表2)。
2.4心肌病理組織學和免疫組織化學檢查結果
2.4.1心肌病理組織學改變光鏡下:A組肌細胞排列有序、肌纖維結構正常,為正常心肌組織;B組心肌組織發生纖維化,肌纖維排列紊亂;C組大部分心肌纖維結構正常,但部分心肌仍可見輕度纖維化(見圖1)。與A組比較,B組心肌病理組織學改變明顯減輕。

表1 實驗前及實驗8周后3組大鼠BW、LVW及LVW/BW的比較
注:BW=體質量,LVW=左心室質量;與A組比較,*P<0.01;與B組比較,△P<0.01

圖1 3組大鼠心肌HE染色光鏡下病理組織學改變(×200)
Table2Comparison of echocardiography data in the three groups 8 weeks after experiment
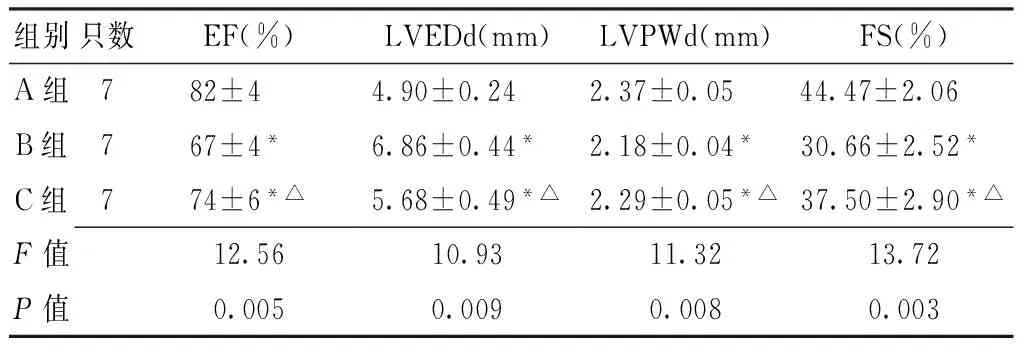
組別只數EF(%)LVEDd(mm)LVPWd(mm)FS(%)A組782±4 4.90±0.24 2.37±0.05 44.47±2.06 B組767±4* 6.86±0.44* 2.18±0.04* 30.66±2.52* C組774±6*△5.68±0.49*△2.29±0.05*△37.50±2.90*△F值12.5610.9311.3213.72P值0.0050.0090.0080.003
注:EF=射血分數,LVEDd=左室舒張末期內徑,LVPWd=左室舒張末期后壁厚度,FS=左室短軸縮短率;與A組比較,*P<0.01;與B組比較,△P<0.01
2.4.2免疫組化法測定心肌組織MMP-9的表達MMP-9陽性細胞在心肌細胞中呈深棕色。實驗8周后,A、B、C組大鼠心肌MMP-9的表達分別為(0.0508±0.0067)、(0.1373±0.0204)和(0.0970±0.0218),3組間比較差異有統計學意義(F=12.23,P=0.006);B、C組大鼠心肌MMP-9的表達與A組比較,C組大鼠心肌MMP-9的表達與B組比較,差異均有統計學意義(P<0.01,見圖2)。
2.5大鼠心肌組織Masson 3色染色結果Masson 3色染色中膠原纖維呈藍綠色,變性纖維泛白色,肌細胞呈紅色。于實驗8周后,經心肌膠原纖維Masson 3色染色半定量分析,A、B、C組大鼠心肌膠原纖維陽性目標Sv分別為(0.5107±0.0764)、(6.9070±0.9103)和(2.8026±0.7052),3組比較差異有統計學意義(F=12.23,P=0.006);其中B組、C組大鼠心肌膠原纖維陽性目標Sv與A組比較,C組與B組比較,差異均有統計學意義(P<0.01,見圖3)。
3 討論
確認動物模型的建立是動物實驗的首要條件之一。以往研究表明高蛋氨酸飲食負荷方法可以制造HHcy的模型[11-12]。本研究顯示,用1.7%蛋氨酸飲食喂養大鼠,發現8周后大鼠血漿Hcy水平較正常大鼠顯著增高,證實造模方法可靠。
Nasir等[13]通過對6 814例無癥狀HHcy患者的研究發現,Hcy水平升高與利用磁共振加權成像檢測到的左心室局部功能收縮功能減低相關。Guéant-Rodriguez等[14]通過對冠狀動脈造影未發現冠狀動脈明顯病變的709例患者觀察,發現Hcy水平升高與左心室功能障礙、EF降低有關。本研究結果顯示,HHcy大鼠LVW/BW較正常大鼠顯著升高,而進行葉酸、維生素B6和維生B12治療的大鼠LVW/BW則較HHcy大鼠顯著降低。同時,心臟彩超檢查顯示HHcy大鼠LVEDd增大,左心室后壁變薄,EF降低;而葉酸、維生素B6和維生B12治療的大鼠LVEDd則較HHcy大鼠顯著降低,EF、LVPWd、FS較HHcy大鼠顯著升高。可見,葉酸、維生素B6和維生B12能改善HHcy大鼠心室功能障礙,為心功能不全提供新的治療途徑。
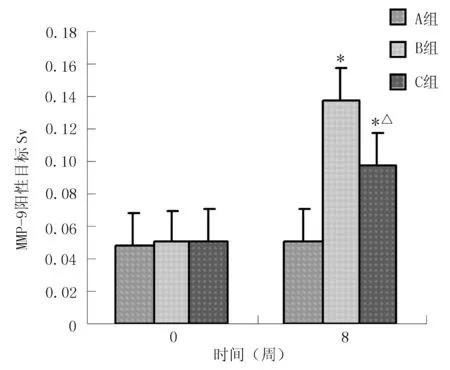
注:與A組比較,*P<0.01;與B組比較,△P<0.01
圖23組大鼠心肌組織MMP-9的表達結果
Figure2MMP-9 expressions in myocardial tissues of three different groups

注:與A組比較,*P<0.01;與B組比較,△P<0.01
圖3各組心肌Masson 3色染色膠原纖維定量
Figure3Collagen fiber quantification in myocardium staining with Masson 3-color
MMP-9是降解細胞外基質的鋅依賴蛋白酶,有研究發現MMP-9在心室重構中發揮重要作用[5-7]。本研究應用免疫組織化學檢測觀察心肌MMP-9的表達,結果顯示HHcy大鼠心肌MMP-9的表達較正常大鼠顯著增高,同時Masson 3色染色半定量顯示心肌膠原纖維化較正常大鼠增加;而葉酸、維生素B6和維生B12治療的大鼠心肌MMP-9的表達較HHcy大鼠顯著降低,心肌膠原纖維化較HHcy大鼠降低。說明高Hcy增加心肌細胞MMP-9的表達,引起心肌纖維化,從而導致心室重構。Ducharme等[15]發現MMP-9基因缺失可減小實驗性大鼠心肌梗死后至少15 d內的左心室腔擴張程度,同時也證實了MMP-9基因缺陷大鼠心肌梗死后左心室擴張的受限現象,伴隨有炎癥反應的減弱,膠原沉積的減少,梗死愈合的延遲。Moshal等[16]通過實驗發現MMP-9基因的缺失能降低心力衰竭時心肌組織的收縮功能不全。其具體機制尚不清楚,需要進一步研究。
葉酸作為體內甲基的間接供體,維生素B6作為胱硫醚-β-合成酶及胱硫醚的輔酶,維生素B12作為蛋氨酸合成酶的輔酶,均影響體內Hcy的代謝。葉酸、維生素B6、維生素B12作為Hcy代謝過程中的重要調節因子,影響著體內Hcy的水平。Waskiewicz等[17]通過對20~74歲的人群隨機抽樣調查發現,葉酸、維生素B6、維生素B12與血漿Hcy水平呈反向趨勢變化,葉酸、維生素B6、維生素B12攝入不足可以導致血漿Hcy升高,而補充適量葉酸、維生素B6、維生素B12可以降低血漿Hcy水平。本研究也發現葉酸、維生素B6和維生素B12可有效降低Hcy水平,同時還可以減少心臟LVEDd,改善心室EF,降低心肌MMP-9的表達,減輕心肌纖維化程度,改善心室重構。
目前,國內外已有研究表明高Hcy能夠影響心室重構和心臟功能,但其機制目前尚不清楚。體外研究證明Hcy可使心肌細胞凋亡壞死,其主要機制是活性氧自由基(Ros)的產生及核氮氧化物表達增加[18]。也有研究表明Hcy可以通過在H9C2心肌細胞內產生過氧亞硝基陰離子,并活化心肌細胞內兩種主要激酶〔細胞外調節蛋白激酶(ERK)和氨基端激酶(JNK)〕,促進細胞凋亡[19]。Dong等[20]研究顯示Hcy可通過NADPH氧化酶和(或)SAPK/JNK途徑誘導細胞氧化應激,促進細胞凋亡。此外,升高的Hcy引起細胞核p47phox表達,使核活性氧自由基的產生增多,促進細胞凋亡[21]。本實驗證明Hcy可以通過增加心肌MMP-9的表達,促進心肌纖維化,導致心室重構。但是Hcy是如何激活MMP-9并通過何種機制參與心肌纖維化并導致心室重構值得深入研究。
總之,HHcy時LVEDd增大,EF下降,LVW/BW、心肌MMP-9表達量、心肌膠原纖維化增加,心室重構;而葉酸、維生素B6和維生素B12可以有效降低血漿Hcy水平,同時可以改善HHcy引起的心肌纖維化,減少心室重構過程中起重要作用的MMP-9的表達,延緩心室重構。這一發現可能為HHcy的一級預防提供了新方法。但本研究并未進行葉酸、維生素B6維生素B12的分組分析,未能證明各種維生素各自的作用及作用機制,尚待進一步研究。
1Konstam MA,Kramer DG,Patel AR,et al.Left ventricular remodeling in heart failure[J].J Am Coll Cardiol Img,2011,4(1):98-108.
2Bai YP,Liu YH,Chen J,et al.Rosiglitazone attenuates NF-kappaB-dependent ICAM-1 and TNF-alpha production caused by homocysteine via inhibiting ERK1/2/p38MAPK activation[J].Biochem Biophys Res Commun,2007,360(1):20-26.
3Walker E,Black J,Parris C,et al.Effect of experimental hyperhomocysteinemia on cardiac structrue and function in the rat[J].Ann Clin Lab Sci,2004,34(2):175-180.
4Sipkens JA,Krijnen PA,Meischl C,et al.Homocysteine affects cardiomyocyte viability:concentration-dependent effects on reversible flip-flop,apoptosis and necrosi[J].Apoptosis,2007,12(8):1407-1418.
5Hansson J,Lind L,Hulthe J,et al.Relations of serum MMP-9 and TIMP-1 levels to left ventricular measures and cardiovascular risk factors:a population-based study[J].Eur J Cardiovasc Prev Rehabil,2009,16(3):297-303.
6Matsumoto Y,Park IK,Kohyama K.Matrix metalloproteinase(MMP)-9,but not MMP-2,is involved in the development and progression of C protein-Induced myocarditis and subsequent dilated cardiomyopathy[J].J Immunol,2009,183(7):4773-4781.
7Zile MR,DeSantis SM,Baicu CF,et al.Plasma biomarkers that reflect determinants of matrix composition identify the presence of left ventricular hypertrophy and diastolic heart failure[J].Circ Heart Fail,2011,4(3):246-256.
8Chen HC,Chen KJ,Wang CH,et al.Association of B vitamins status and homocysteine levels in elderly Taiwanese[J].Asia Pac J Clin Nutr,2005,14(3):250-255.
9Heinz J,Kropf S,Domr?se U,et al.B vitamins and the risk of total mortality and cardiovascular disease in end-stage renal disease:results of a randomized controlled trial[J].Circulation,2010,121(12):1432-1438.
10Glynn RJ,Manson JE,Christen WG,et al.Effect of folic acid and B vitamins on the occurrence of venous thromboembolism:a randomized trial in women at high cardiovascular risk[J].Circulation,2008,118:S1137-S1143.
11Dayal S,Lentz SR.Murine models of hyperhomocysteinemia and their vascular phenotypes[J].Arterioscler Thromb Vasc Biol,2008,28(9):1596-1605.
12Zhou Ji,Werstuck GH,Lhoták S,et al.Hyperhomocysteinemia induced by methionine supplementation does not independently cause atherosclerosis in C57BL/6J mice[J].FASEB J,2008,22(7):2569-2578.
13Nasir K,Tsai M,Rosen BD,et al.Elevated homocysteine is associated with reduced regional left ventricular function:the multi-ethnic study of atherosclerosis[J].Circulation,2007,115(2):180-187.
14Guéant-Rodriguez RM,Juillière Y,Nippert M,et al.Left ventricular systolic dysfunction is an independent predictor of homocysteine in angiographically documented patients with or without coronary artery lesions[J].J THromb Haemost,2007,5(6):1209-1216.
15Ducharme A,Frantz S,Aikawa M,et al.Targeted deletion of matrix metalloproteinase-9 attenuates left ventricular enlargement and collagen accumulation after experimental myocardial infarction[J].J Clin Invest,2000,106(1):55-62.
16Moshal KS,Rodriguez WE,Sen U,et al.Targeted deletion of MMP-9 attenuates myocardial contractile dysfunction in heart failure[J].Physiol Res,2008,57(3):379-384.
17Waskiewicz A,Sygnowska E,Broda G.Dietary intake of vitamins B6,B12and folate in relation to homocysteine serum concentration in the adult Polish population-WOBASZ project[J].Kardiol Pol,2010,68(3):275-282.
18Sipkens JA,Krijnen PA,Meischl C,et al.Homocysteine affects cardiomyocyte viability:concentration-dependent effects on reversible flip-flop,apoptosis and necrosis[J].Apoptosis,2007,12(8):1407-1418.
19Levrand S,Pacher P,Pesse P,et al.Homocysteine induces cell death in H9C2 cardiomyocytes through the generation of peroxynitrite[J].Biochem Biophys Res Commum,2007,359(3):445-450.
20Dong F,Zhang X,Li SY,et al.Possible involvement of NADPH oxidase and JNK in homocysteine induced oxidative stress and apoptosis in human umbilical vein endothelial cells[J].Cardiovascular Toxicol,2005,5(1):9-20.
21Sipkens JA,Krijnen PA,Hahn NE,et al.Homocysteine-induced cardiomyocyte apoptosis and plasma membrane flip-flop are independent of S-adenosylhomocysteine:a crucial role for nuclear p47(phox)[J].Mol Cell Biochem,2011,358(1/2):229-239.

