花椰菜廢棄莖葉中葉蛋白提取工藝的研究
汪建旭,馮煒弘,楊道蘭,王永林,尹 燕,張 艷
(蘭州市農業科技研究推廣中心,甘肅蘭州730010)
花椰菜(Brassica oleracea L.var.botrytis L)是十字花科蕓薹屬植物中以花球為產品的一種甘藍類蔬菜,具有很高的營養價值。但在鮮銷和初加工過程中莖葉剩余物占到了鮮重的70%以上[1]。根據測算,蘭州市2012年產生的花椰菜莖葉剩余物達到了86萬噸,這些莖葉剩余物含水率及有機質含量較高,堆放或填埋會產生大量滲濾液,造成嚴重的環境污染。
果蔬加工過程中廢棄物的利用已經成為許多新的、可替代的廉價蛋白質來源[2-7]及功能性成分[8-10]的研究主題。花椰菜廢棄莖葉中除含有大量水分外,還含有高質量的蛋白質和纖維素[1]。葉蛋白是以植物青嫩莖葉為原料,經榨汁、絮凝、濃縮、干燥等工藝提取出的一種富含可溶性蛋白質的濃縮物,簡稱為LPC。由于其產量高、營養豐富、提取和濃縮方法相對簡單,已經作為一種有效和可行的蛋白質來源[11]。目前國內外還沒有對花椰菜廢棄莖葉中葉蛋白提取工藝進行過研究,因此本實驗對花椰菜廢棄莖葉葉蛋白的不同絮凝條件及提取工藝進行了研究,以期為花椰菜廢棄物的綜合開發利用提供技術參數和理論指導。
1 材料與方法
1.1 材料及儀器
花椰菜廢棄莖葉 品種為瑪潤達,于2012年9月采自蘭州市榆中縣高原夏菜基地,為花球成熟期的新鮮、無腐爛莖葉,采樣后貯藏于4℃的冷庫中;殼聚糖(脫乙酰度≥90%) 國藥集團化學試劑有限責任公司;其他化學試劑 均為分析純。
101-3AB型恒溫干燥箱 天津泰斯特儀器有限公司;HH-SY21-Ni4型恒溫水浴鍋 上海百典儀器設備有限公司;A-88型組織搗碎機 江蘇金壇市盛威實驗儀器廠;R30型電子攪拌器 北京華東儀器公司;TGL-16G型離心機 江蘇金壇市科興儀器廠;PHS-3F型酸度計 上海雷磁儀器廠;Kjeltec 1030型全自動凱式定氮儀,Soxtec Avanti 2050型全自動脂肪儀 德國福斯(FOSS)公司。
1.2 實驗方法
1.2.1 原料化學成分的測定 取5g新鮮花椰菜莖葉,剪碎至2~5mm,按照國標規定的檢測方法,進行化學成分測定[5-7]。
干物質測定:采用烘干法,在105℃下烘干至恒重后測定質量;粗蛋白測定:按照GB/T 6432-1994進行測定;粗灰分含量測定:按照GB/T 5009.4-2010進行測定;粗纖維含量測定:按照GB/T 5009.10(88)-2010進行測定;粗脂肪:按照GB/T 14772-2008法進行測定。
1.2.2 葉蛋白提取方法的篩選 挑選剛采收的新鮮無腐爛花椰菜廢棄莖葉1000g,清洗后用組織搗碎機加水搗成漿狀,向原漿中加入一定量蒸餾水并用四層紗布反復擠壓過濾。葉渣再加入適量蒸餾水繼續擠壓過濾,調節料水比至1∶5(g/mL),合并濾液并分別測定打漿后新鮮原液和調節料水比之后原液的pH。濾液分別按以下方法進行處理:
a.直接加熱法:控制水浴溫度為75℃,保溫10min;
b.酸沉淀法:對原液充分攪拌并用0.1mol/L HCl溶液調pH至4.0;
c.堿沉淀法:對原液充分攪拌并用0.1mol/L NaOH溶液調pH至10.0;
d.酸熱沉淀法:對原液充分攪拌并用0.1mol/L HCl溶液調pH至4.0,繼續加熱至水浴溫度為75℃,保溫10min;
e.堿熱沉淀法:對原液充分攪拌并用0.1mol/L NaOH溶液調pH至10.0,繼續加熱至水浴溫度為75℃,保溫10min;
f.酸絮凝劑法:對原液充分攪拌并用0.1mol/L HCl溶液調pH至4.0,加入絮凝劑殼聚糖(殼聚糖-鹽酸溶液:將一定量的殼聚糖先溶于30~40mL,0.1mol/L鹽酸中),至有絮狀沉淀出現,靜置40min。
將處理后溶液進行離心(4000r/min,10min),沉淀物在65℃條件下烘干至恒重,所得樣品即為葉蛋白,并按照GB/T 6432-1994測定其中的粗蛋白含量。
1.2.3 葉蛋白提取條件的優化 根據1.2.2所得到的實驗結果,酸絮凝劑法為提取花椰菜葉蛋白的最佳方法,通過單因素及正交實驗進一步優化葉蛋白提取工藝參數。
1.2.3.1 單因素實驗設計 以葉蛋白得率和提取率為指標,考察提取過程中料水比、殼聚糖添加量、pH對指標的影響。
按照1.2.2的酸絮凝劑工藝流程,配制料水比(g/mL)分別為1∶3、1∶4、1∶5、1∶6的原液,殼聚糖添加量為0.4g/L(占原液體積),調pH至4.0,提取葉蛋白,考察料水比對葉蛋白得率和提取率的影響;按照0.2、0.3、0.4、0.5g/L(占原液體積)的殼聚糖添加量,設定料水比為1∶5(g/mL),pH調至4,提取葉蛋白,考察殼聚糖添加量對葉蛋白得率和提取率的影響;設料水比為1∶5(g/mL),殼聚糖添加量為0.4g/L(占原液體積),分別調pH至3.0、3.5、4.0、4.5提取葉蛋白,考察pH對葉蛋白得率和提取率的影響。
1.2.3.2 正交實驗 以葉蛋白得率和提取率為指標,在單因素實驗的基礎上,以料水比(A)、pH(B)、殼聚糖添加量(C)為實驗因素,選用不同水平,進一步優化參數范圍,進行L9(34)正交實驗,并進行方差分析。各因素水平表見表1。
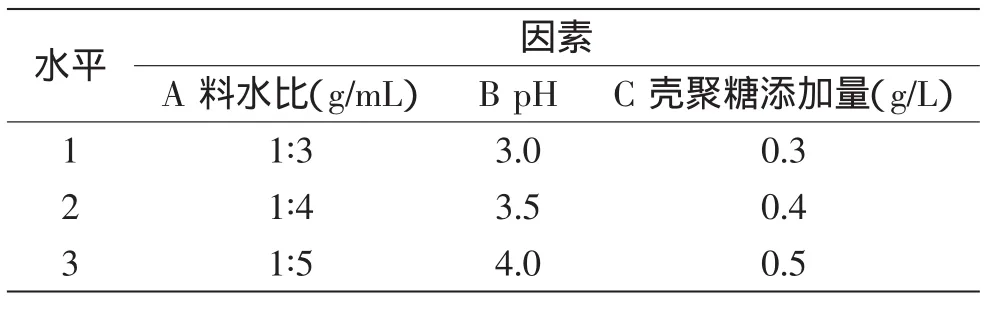
表1 正交實驗設計Table 1 Orthogonal design
1.3 指標的計算

葉蛋白提取率(%)=葉蛋白得率×葉蛋白中粗蛋白質量分數/花椰菜莖葉干物質中粗蛋白質量分數×100
1.4 數據處理
實驗數據分析及處理采用Excel和SPSS(17.0)軟件。
2 結果與分析
2.1 花椰菜廢棄莖葉中主要營養成分

表2 花椰菜廢棄莖葉中主要營養成分Table 2 Main nutrients of discarded broccoli stems and leaves
由表2可以看出,雖然新鮮花椰菜廢棄莖葉中水分含量較高,但其粗蛋白及粗纖維含量在干物質中比例較高,分別為21.70%和30.10%。此外,打漿后新鮮原液pH隨料水比不同,在6.55~6.85之間,略偏酸性。研究表明苜蓿是葉蛋白含量較高的一種植物,其粗蛋白占到了干物質含量的18%~28%[12]。因此花椰菜廢棄莖葉是適合作為提取葉蛋白的一種原料。
2.2 葉蛋白不同提取方法的篩選
從表3可見,采用酸絮凝劑法提取的花椰菜廢棄莖葉葉蛋白得率最高,顯著高于其余提取方法,其后依次是酸熱沉淀法、直接加熱法、酸沉淀法、堿沉淀法、堿熱沉淀法。對葉蛋白提取率的影響依次為:酸絮凝劑法>酸熱沉淀法>酸沉淀法>堿沉淀法>直接加熱法>堿熱沉淀法。堿熱沉淀法提取的葉蛋白得率及提取率均顯著低于其余各組,主要原因可能是堿沉淀后加熱,蛋白質沉淀環境改變,反而有部分沉淀包括非蛋白提取物溶解進入上清液中。
近年來,葉蛋白提取方法主要有加熱法、酸堿沉淀法、堿熱法和酸熱法、鹽析法、有機溶劑法、發酵法和電濃縮法等[13]。本實驗結果表明,采用酸絮凝劑法提取的花椰菜廢棄莖葉葉蛋白得率及提取率最高,其原因可能是pH發揮了雙重作用,使得殼聚糖的絮凝作用發揮到極致。蛋白質分子的電荷和溶解度隨環境pH的變化而變化。pH較低時,蛋白質帶正電荷;pH較高時,蛋白質帶負電荷;在某一特定pH時,蛋白質為電中性[14]。因此適宜的pH有利于蛋白質的絮凝。而本實驗所用的殼聚糖為酸溶性殼聚糖,合適的pH有利于殼聚糖的充分溶解,從而使其殼聚糖的絮凝作用發揮到最大。
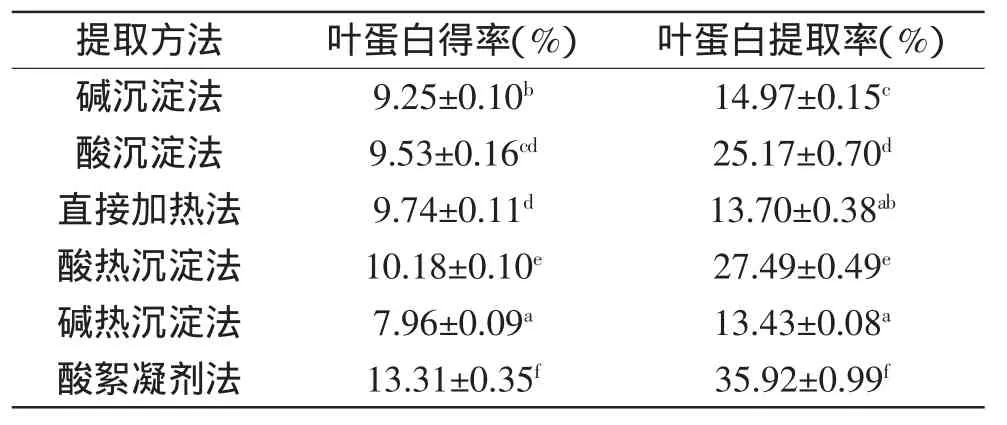
表3 不同提取方法對葉蛋白得率及提取率的影響Table 3 Effect of different extraction methods on yield and extraction rate of leaf protein concentrates
2.3 花椰菜廢棄莖葉葉蛋白提取工藝優化
2.3.1 單因素實驗結果
2.3.1.1 料水比對花椰菜廢棄莖葉葉蛋白提取的影響 由圖1可知,隨著料水比值由1∶3降低至1∶4時,葉蛋白得率及提取率均顯著提高,料水比值繼續降低時,葉蛋白得率及提取率變化不大。當料水值比低于1∶4時,由于溶液太少,提取不充分,導致一部分蛋白質不能完全溶解,提取效果較低;當料水比值大于1∶4時,蛋白質已完全溶解,之后料水比值對葉蛋白得率及葉蛋白提取率影響不大,這與呂宗友等[15]的研究結果一致,而與敬思群等[16]的研究結果不一致。這可能與選擇的料水比的變化范圍有關,當料水比的變化范圍較小時,加水量越大,葉蛋白提取越完全,而適中的料水比能以最少的提取液獲得最大的葉蛋白[15];當料水比變化范圍較大時,由于加水量過大,分離過程中蛋白質濃度過稀,從而導致蛋白質得率輕微下降[16]。
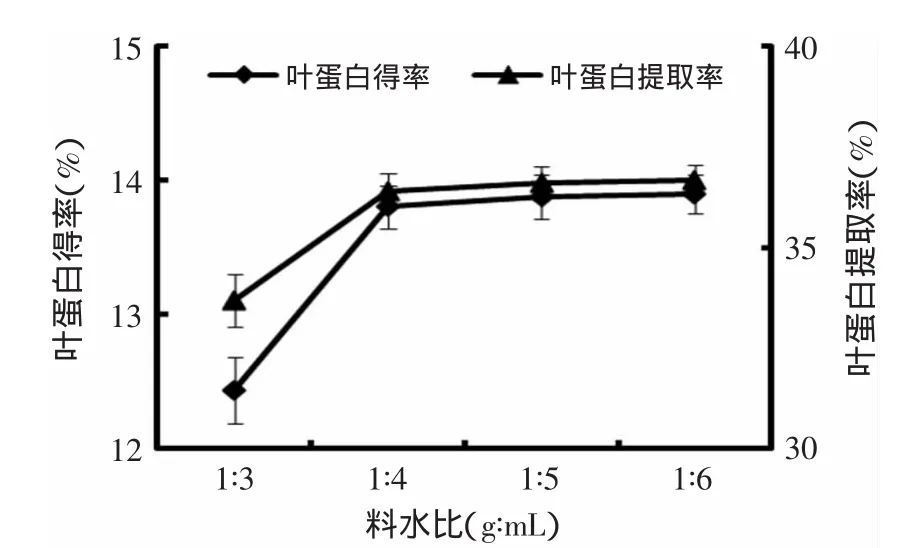
圖1 料水比對葉蛋白得率及提取率的影響Fig.1 Effect of material to water rate on the yield and extraction rate of LPC
2.3.1.2 pH對花椰菜廢棄莖葉葉蛋白提取的影響圖2表明,pH對花椰菜廢棄莖葉葉蛋白得率及提取率影響較顯著。葉蛋白得率及提取率隨pH的增加而提高,當pH達到4.0時,花椰菜廢棄莖葉葉蛋白得率及提取率達到了最大值,分別為14.78%和39.00%,而當pH進一步升高時,葉蛋白得率及提取率反而均下降。其原因為蛋白質是一種兩性電解質,其表面電荷隨溶液的pH改變而發生變化。當溶液pH>pI(等電點)時蛋白質帶負電荷;當溶液pH<pI時蛋白質帶正電荷,當溶液pH接近pI時蛋白質靜電荷為零,消除了蛋白質分子表面電荷之間的排斥力,使蛋白質分子易聚合沉淀[14]。實驗中當pH為4.0時,葉蛋白得率及提取率均達最大值,此時葉蛋白的溶解度最小;當pH由4.0繼續增大時,葉蛋白更多溶解于上清液中,其得率及提取率均呈現顯著降低的趨勢,這與肖海峻等[17]研究一致。
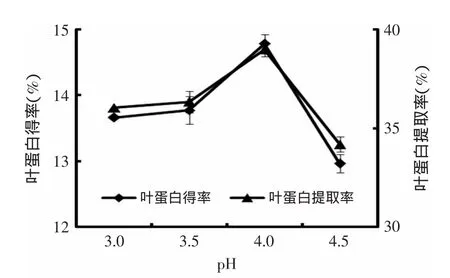
圖2 pH對葉蛋白得率及提取率的影響Fig.2 Effect of pH value on the yield and extraction rate of LPC
2.3.1.3 殼聚糖添加量對花椰菜廢棄莖葉葉蛋白提取的影響 圖3表明,殼聚糖添加量對花椰菜廢棄莖葉葉蛋白得率及提取率影響比較明顯。廢棄莖葉葉蛋白得率及提取率隨殼聚糖添加量的增大而提高,在殼聚糖添加量為0.4g/L時,葉蛋白得率及提取率均達到了最大值,分別為15.04%和39.66%。而當殼聚糖添加量進一步提高時,蛋白質得率及提取率反而下降。大量實驗研究表明,各種絮凝劑都有在相應條件下的最佳投加量,低于或超過這個用量都會使絮凝效果下降。用量不足時,殼聚糖分子鏈上的陽離子活性基團絕對數量有限,正電荷較少,不能與蛋白質膠體和懸浮顆粒所帶負電荷完全電中和,殼聚糖分子鏈的吸附橋連作用有限,膠體不能完全脫穩凝聚,絮凝效率不高;過量時會將蛋白質膠體、懸浮微粒緊緊包圍起來,導致“再穩”現象[18]。目前常用的蛋白絮凝劑有硫酸鋁鉀和聚乙二醇等,殼聚糖作為自然界唯一一種帶正電荷的高分子聚合物,無毒無味,可生物降解,不會造成二次污染,是一種優良的絮凝劑[19-20]。
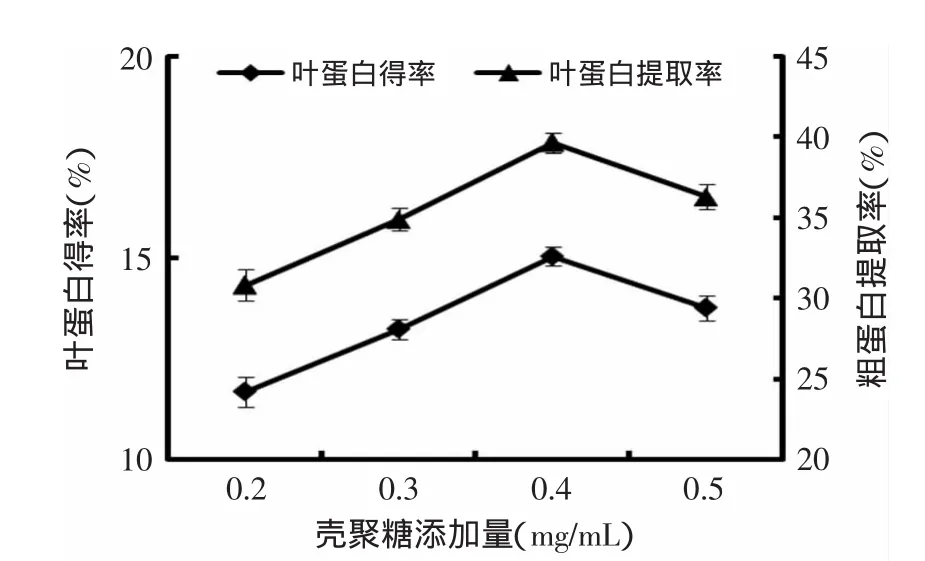
圖3 殼聚糖添加量對葉蛋白得率及提取率的影響Fig.3 Effect of chitosan concentration on the yield and extraction rate of LPC
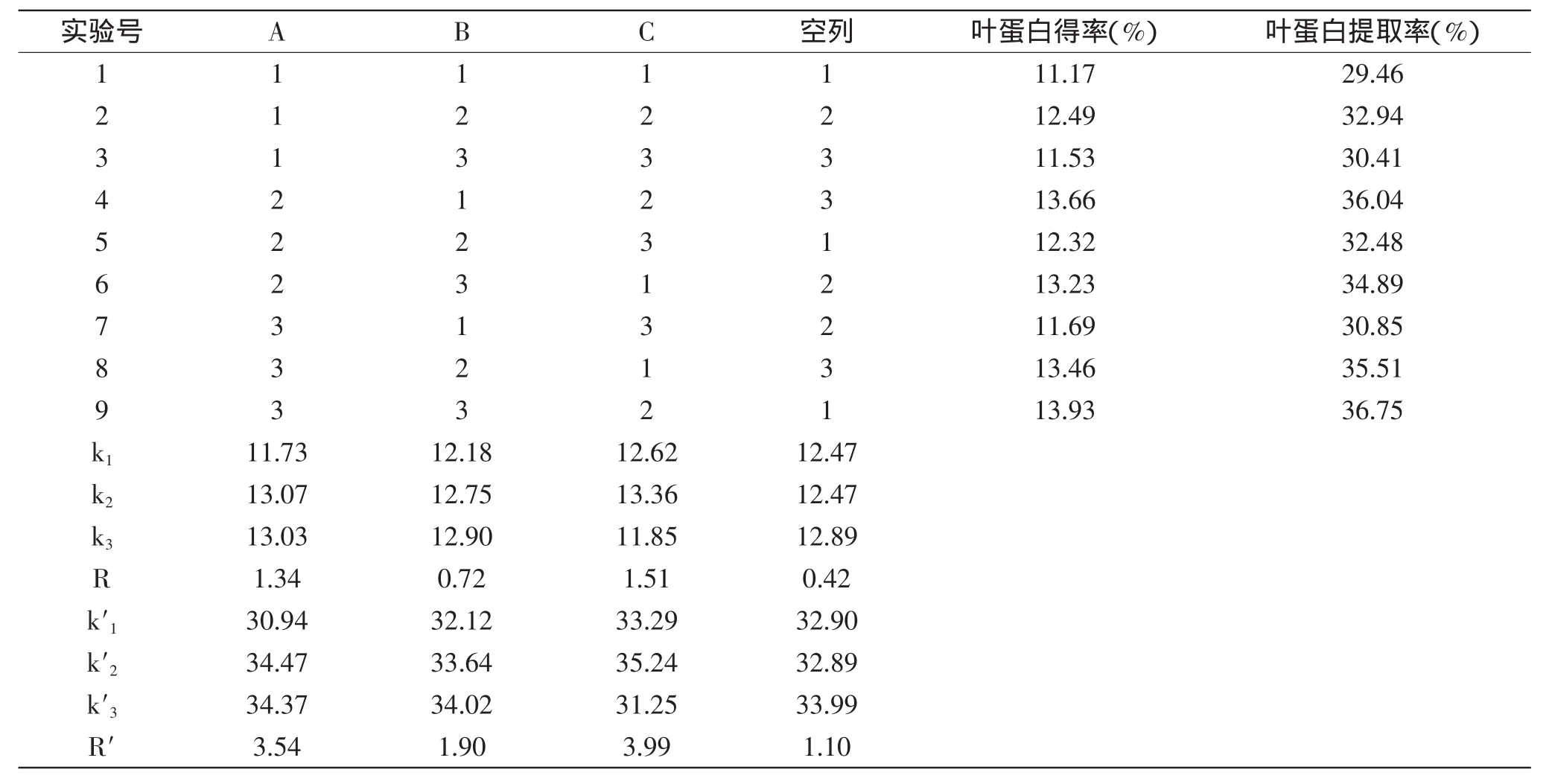
表4 花椰菜廢棄莖葉葉蛋白提取工藝的正交實驗結果Table 4 Orthogonal experimental results of extraction technology of LPC from discarded broccoli stems and leaves
2.3.2 正交實驗結果 結合單因素實驗結果,采用正交實驗對葉蛋白提取工藝進一步優化,結果如下:表4表明,按照極差R的大小,影響花椰菜莖葉葉蛋白得率和提取率的主次因素的順序均為C(殼聚糖添加量)>A(料水比)>B(pH)。葉蛋白得率和提取率的最佳組合均為A2B3C2,即料水比1∶4,pH4.0,殼聚糖添加量0.4g/L。
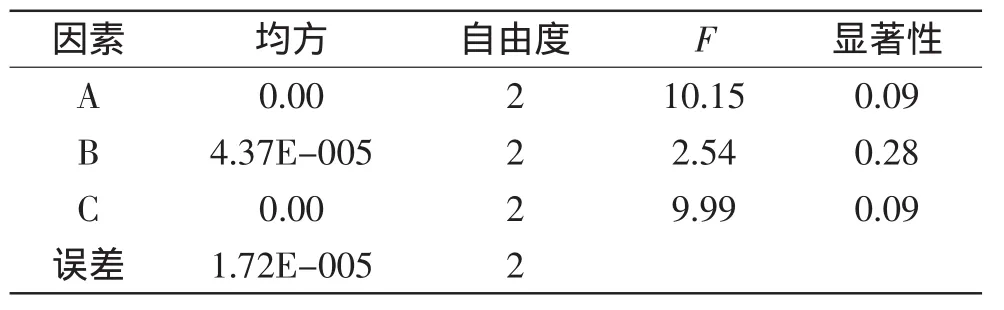
表5 葉蛋白得率正交實驗方差分析Table 5 Variance analysis for the leaf protein yield of orthogonal test
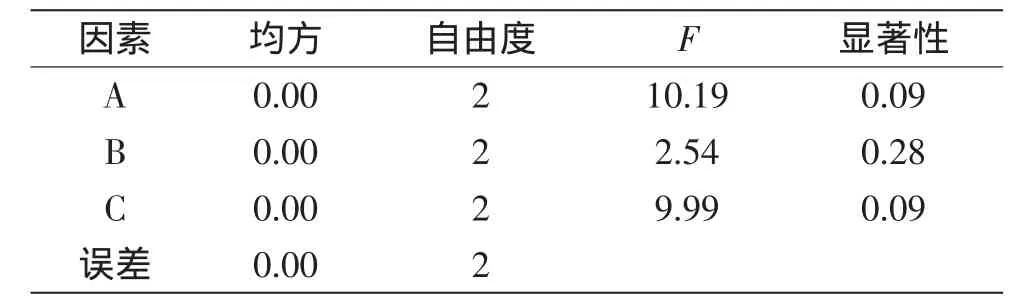
表6 葉蛋白提取率正交實驗方差分析Table 6 Variance analysis for the leaf protein extraction rate of orthogonal test
A2B3C2這一最佳組合在正交實驗中沒有出現,通過驗證實驗后得到葉蛋白得率為14.79%、葉蛋白提取率為39.01%,大于表中A3B3C2的結果,這進一步驗證了正交實驗的準確性和可靠性。
由方差分析表5、表6可知,料水比與殼聚糖添加量對葉蛋白得率及提取率影響較大,pH對葉蛋白得率及提取率的影響最小。所以實際生產若考慮經濟性,則在提取花椰菜廢棄莖葉葉蛋白時可適當減少對pH的控制。
3 結論
本文確定了酸絮凝劑法為花椰菜廢棄莖葉葉蛋白提取最佳方法,且通過單因素及正交實驗得到花椰菜廢棄莖葉葉蛋白最佳提取工藝為:料水比1∶4(g/mL),pH4.0,殼聚糖添加量0.4g/L。此時樣品葉蛋白得率為14.79%、提取率為39.01%。
[1]何元翔,汪建旭,馮煒弘,等.萎蔫處理對花椰菜莖葉可青貯性影響[J].西北農業學報,2013,22(3):161-167.
[2]Quanhang L,Caili F.Application of response surface methodology for extraction of germinant pumpkin seeds protein[J].Food Chemistry,2005,92(4):701-706.
[3]Wani A A,Sogi D S,Grover L,et al.Effect of temperature,alkali concentration,mixing time and meal/solvent ratio on the extraction of water-melon seed proteins-a response surface approach[J].Biosystems Engineering,2006,94(1):67-73.
[4]Gorinstein S,Pawelzlk E,Licon E D,et al.Characterisation of pseudocereal and cereal proteins by protein and amino acid analyses[J].Journal of the Science of Food and Agriculture,2002,82(8):886-891.
[5]Rangel A,Domont G B,Pedrosa C,et al.Functional properties of purified vicilins from cowpea(Vigna unguic-ulata) and Pea(Pisum sativum) and cowpea protein isolate[J].Journalof Agricultural and Food Chemistry,2003,51(19):5792-5797.
[6]Sogi D S,Garg S K,Bawa A S.Functional properties of seed meals and protein concentrates from tomato processing waste[J].Journal of Food Science,2002,67(8):2997-3001.
[7]Tomotake H,Shimaoka I,Kayashita J,et al.Physicochemical and functional properties of buckwheat protein product[J].Journal of Agricultural and Food Chemistry,2002,50(7):2125-2129.
[8]Al-Farsi M A,Lee C Y.Optimization of phenolics and dietary fibre extraction from date seeds[J].Food Chemistry,2008,108(3):977-985.
[9]Mollea C,Chiampo F,Conti R.Extraction and characterization of pectins from cocoa husks:a preliminary study[J].Food Chemistry,2008,107(3):1353-1356.
[10]Roldan E,Sanchez-Moreno C,Ancos B,et al.Characterisation of onion(Allium cepa L.) by-products as food ingredients with antioxidant and antibrowning properties[J].Food Chemistry,2008,108(3):907-916.
[11]Alvise D N,Lesueur-Lambert C,Fertin B,et al.Hydrolysis and large scale ultrafiltration study of alfalfa protein concentrate enzymatic hydrolysate[J].Enzyme and Microbial Technology,2000,27(5):286-294.
[12]翟峰,張勇.苜蓿葉蛋白的開發與利用[J].中國飼料,2007,30(8):34-36.
[13]郭志華,曹穩根,廖紅艷.葉蛋白的研究進展[J].宿州學院學報,2007,22(6):113-115.
[14]閻巧娟,李道娥,劉向陽,等.苜蓿葉蛋白提取工藝條件對蛋白質含量的影響[J].中國農業大學學報,1997,2(6):92-95.
[15]呂宗友,趙國琦,蘇衍菁,等.白三葉葉蛋白提取及純化工藝[J].草業科學,2011,28(11):2052-2056.
[16]敬思群,王桓.四翅濱藜葉蛋白提取工藝優化及氨基酸分析[J].鄭州輕工業學報,2010,25(2):22-26.
[17]肖海峻,孟利前,楊新建,等.苜蓿葉蛋白提取工藝參數優化實驗[J].食品科技,2011,36(4):159-162.
[18]鄭懷禮.生物絮凝劑與絮凝技術[M].北京:化學工業出版社,2004:6-11.
[19]王志華,王書俊,黃毓禮.殼聚糖絮凝有機廢水機理的研究工業水處理[J].工業水處理,2002,22(2):14-17.
[20]劉秉濤,張眾,王海榮.殼聚糖對含蛋白廢水的絮凝與回收[J].華北水利水電學院學報,2005,26(4):69-71.

