不同飼養密度對斑馬魚生長發育的影響
巨英超,謝 英,劉 超,吳建華,劉樹鋒
(1.河北醫科大學第四醫院實驗動物中心2.河北省實驗動物重點研究室,河北醫科大學實驗動物學部,石家莊 050017)
斑馬魚作為一種新型的模式生物,正逐漸拓展和深入應用到生命科學各個領域的研究中。盡管斑馬魚作為國際上應用最廣的實驗魚類,但其作為實驗用動物尚未實現標準化。隨著我國實驗斑馬魚應用范圍的拓展和深入,斑馬魚的標準化研究顯得越來越重要[1-4]。目前國內已經有了斑馬魚資源信息網絡數據庫,可以為斑馬魚基因組及生物信息學分析提供參考依據[5],有關斑馬魚的人工繁殖、生態、生理等方面也已有報道[6-7],國內學者已經就斑馬魚的實驗動物標準化工作開展了研究[8],但是就飼養密度對斑馬魚生長發育與存活的影響方面則未見報道。本文將就此進行探討,以期為實驗室斑馬魚相關研究工作及斑馬魚的實驗動物標準化提供一些基礎資料和數據支持。
1 材料與方法
1.1 材料
AB品系斑馬魚引自北京大學生命科學研究院,飼養于河北省實驗動物中心斑馬魚實驗室自制的斑馬魚養殖系統,自動控制光照,晝夜時間交替為14 h∶10 h。養殖系統中獨立飼養單元的容積為3 L,水溫(28.3 ±0.17)℃,pH 值(7.5±0.02),電導率(1.07 ±0.06)ms/cm,NH4+-N <0.04 mg/L[9]。
1.2 方法
試驗分為 5 個組,密度分別為 1、2、4、6、8Tail/L。孵化后的幼魚14 d之前飼養于1000 mL燒杯中,28℃水浴。4~10 d飼喂草履蟲(Paramoecium),11 d開始加入豐年蝦(Artemia)進行混合飼喂,并逐日增加豐年蝦的比例。14 d后按組別轉移到容量為3 L的獨立飼養單元內,只投喂豐年蝦;每天8∶00、18∶00投食,飼喂量為每條魚 0.4 mL 用純凈水1∶3稀釋的豐年蝦[10]。20 d起每 10 d測量一次體長和體重,90 d時處死魚只后分別測量體重、體長、心臟重量、肝臟重量并計算生長指數和臟器指數,比較各組的生長發育情況。
1.3 參數計算與數據統計
參數計算公式:
日增重(DWG)DWG=(W2-W1)/(t2-t1);
增重率(WGR)WGR=(W2-W1)/W1×100%;
增長率(LGR)LGR=(L2-L1)/L1×100%;
所有公式中,W1、W2為時間 t1、t2時的體重(mg),L1、L2為時間 t1、t2時的體長(mm)。根據lietal(2000)的計算方法,成年魚臟器指數=臟器重量(mg)/成年魚體重(mg)×100%。
所有數據使用 SPSS17.0進行統計分析,方差分析。
表1 斑馬魚不同飼養密度的生長參數(±s)Tab.1 The growth parameters of the zebrafish in different rearing density
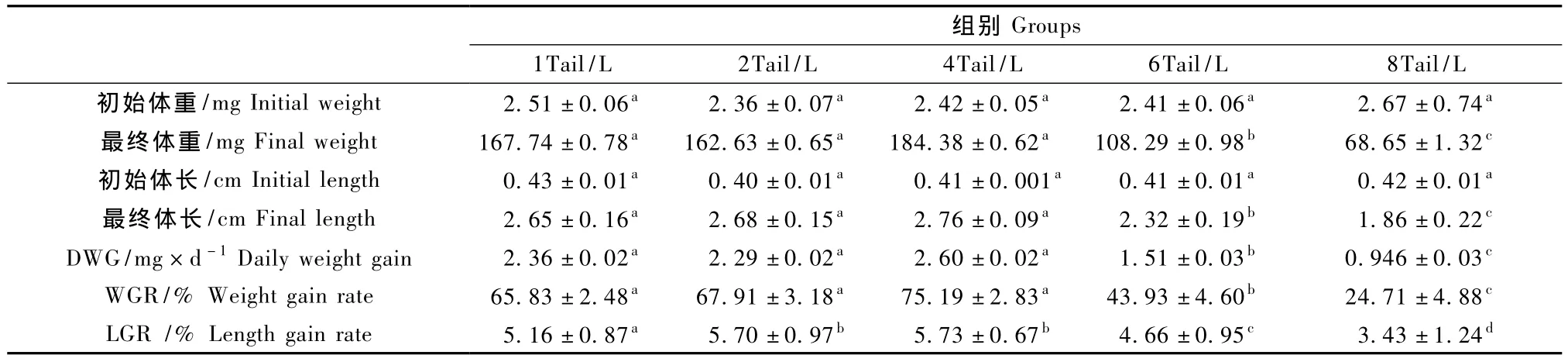
表1 斑馬魚不同飼養密度的生長參數(±s)Tab.1 The growth parameters of the zebrafish in different rearing density
初始體重/mg Initial weight 2.51±0.06a 2.36±0.07a 2.42±0.05a 2.41±0.06a 2.67±0.74a最終體重/mg Final weight 167.74±0.78a 162.63±0.65a 184.38±0.62a 108.29±0.98b 68.65±1.32c初始體長/cm Initial length 0.43±0.01a 0.40±0.01a 0.41±0.001a 0.41±0.01a 0.42±0.01a最終體長/cm Final length 2.65±0.16a 2.68±0.15a 2.76±0.09a 2.32±0.19b 1.86±0.22c DWG/mg×d-1Daily weight gain 2.36±0.02a 2.29±0.02a 2.60±0.02a 1.51±0.03b 0.946±0.03c WGR/%Weight gain rate 65.83±2.48a 67.91±3.18a 75.19±2.83a 43.93±4.60b 24.71±4.88c LGR/%Length gain rate 5.16±0.87a 5.70±0.97b 5.73±0.67b 4.66±0.95c 3.43±1.24d

表2 斑馬魚不同飼養密度的存活率Tab.2 The survival of the zebrafish in different rearing density
表3 斑馬魚不同飼養密度下90日齡的臟器指數(±s)Tab.3 The viscera index of zebrafish at 90 days of age in different breeding density

表3 斑馬魚不同飼養密度下90日齡的臟器指數(±s)Tab.3 The viscera index of zebrafish at 90 days of age in different breeding density
注:以上三表同一行中參數右上角處字母(a-d)相同代表差異性不顯著(P>0.05),不同則差異性極顯著(P<0.01)。Note:The values with same letters mean no significant difference in a line above three charts(P >0.05),and with different letters mean extremely difference(P <0.01).
臟器指數/%Viscera index 心臟 Heart 5.70±0.14a 5.74±0.21a 5.89±0.15a 4.87±0.19b 4.62±0.26b肝臟Liver 1.67±0.06a 1.58±0.08a 1.70±0.06a 0.96±0.09b 0.85±0.17b
2 結果
2.1 飼養密度與生長發育的關系
通過表1可以看出,飼養密度在1至4Tail/L之間,其最終體重、體長、DWG、GBW 略有變化,當養殖密度為4Tail/L時達到最大值 ,但各組間差異不顯著。當進一步增加飼養密度時,各指標反而下降,8Tail/L組的生長速度、最終體重顯著低于其它組。從圖1(彩插2)的結果中可發現,在6Tail/L和8Tail/L組,魚只的體重增長趨勢在后期都明顯表現放緩的跡象。日常飼養工作中觀察該組的魚只,發現體型也明顯較其他組瘦弱。
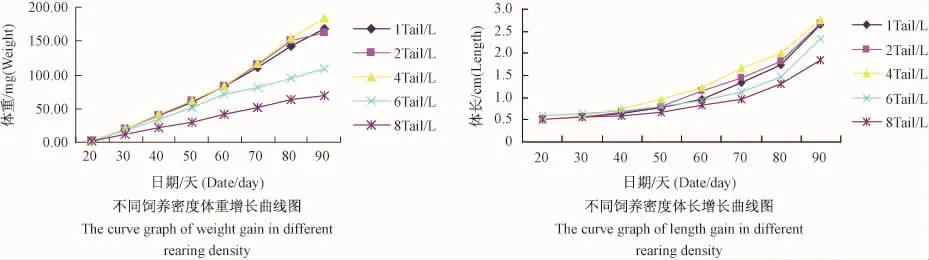
圖1 不同飼養密度下斑馬魚體重與體長增長曲線圖Tig.1 The curve graph of length and weight gain of the zebrafish in different rearing density
2.2 密度對存活率的影響
1Tail/L、4Tail/L 兩組未見死亡,2Tail/L、6Tail/L兩組只在個別平行組中出現了1、2尾死亡,而8Tail/L組中幾乎每個平行組都有2~5尾斑馬魚死亡,91.81%的存活率也明顯的低于其他組。
2.3 密度與成年魚臟器指數的關系
統計結果顯示高密度組的各臟器指數都顯著降低(表3)。解剖顯微鏡下觀察,1、2、4Tail/L組中斑馬魚的心臟和肝臟都比6Tail/L、8Tail/L組的要明顯,而且高密度組有很多斑馬魚很難找到肝臟,主要因為肝臟顏色太淺無法判斷準確。
3 討論
一般認為,魚類的最終體重和日增重都隨著養殖密度的增大而顯著降低[11-13],但有報道認為,在適宜的飼養密度范圍內,較高的飼養密度有利于其生長。如Baker等對紅點鮭的實驗結果表明,當飼養密度低于40~50 kg/m3時,紅點鮭的生長率隨飼養密度增大而呈增長趨勢,但隨著飼養密度的進一步增大,超過40~50 kg/m3時,魚類個體的活動空間受到限制,繼而間接導致魚類個體的生長受到限制,生長率明顯下降。
在本試驗中,4Tail/L以下密度組的斑馬魚生長發育無明顯差異,4Tail/L密度組的相對生長效果較其它組具有優勢,成活率也高。密度過高則不利于斑馬魚的生長發育,在高密度組普遍存在2~5尾較其他魚體型明顯小很多的魚,這在一些報道中也有提到[14-16],究其原因可能是在高密度飼養條件采食競爭激烈,少量魚只的采食量不能滿足其生長發育的需要。而且過高的飼養密度也會引起飼養水體代謝產物的濃度加大,不利于魚只的生存。考慮到飼養空間利用率等因素,建議將飼養密度確定為4Tail/L。
此前,The Zebrafish Book中曾指出斑馬魚的飼養密度不應超過25Tail/45L即0.6Tail/L的密度,否則魚只的生長發育將受到嚴重影響[10]。王天奇等也曾指出,成魚飼養密度不應超過1Tail/L,幼魚不應超過2Tail/L[8]。不同的研究結果可能是研究者采用不同的飼養繁育體系水處理效果的差異而致。本研究的結果反映了繁育設備中水環境對實驗用魚生長發育的重要性,提示高效的飼養繁育體系及合理的密度有利于斑馬魚正常的生長發育。
4 結論
本試驗對不同飼養密度下斑馬魚的生長性能指標進行了比較,發現4Tail/L時斑馬魚有著較好的生長發育優勢,同時發現飼養密度過高不利于斑馬魚的生長發育。斑馬魚作為一種新興的實驗動物,其標準化工作是必然的趨勢,穩定的環境、嚴格的管理須配合合理的飼養密度才能實現其標準化。對于規模較小的實驗室,在條件有限的情況下,合理的飼養密度對取得真實可靠的實驗數據極為重要。
(本文圖1,見彩插2)
[1]吳思,趙德明,孫德明,等.實驗用斑馬魚主要疾病及其實驗動物標準化研究過程面臨的主要問題[J].實驗動物科學,2009,26(4):51-56.
[2]孫德明,穆苑,高昌,等.模型動物斑馬魚及其特定病原凈化[J].中國比較醫學雜志,2009,19(12):52 -60.
[3]賈順姬,孟安明.中國斑馬魚研究發展歷程及現狀[J].遺傳,2012,34(9):1082 -1088.
[4]程烽,陳竺.斑馬魚:一種造血系統的遺傳學研究模型動物[J].國外醫學輸血及血液學分冊,2004,27(3):200 -202.
[5]陳寶增,李鳳超,康現江.實驗室斑馬魚的繁育與養殖技術[J].河北漁業,2008,(4):51 - 53.
[6]陳曉倩,殷浩文.斑馬魚飼養循環裝置中的水生環境微生物群落代謝[J].中國比較醫學雜志,2007(17):110-114.
[7]陳桑,李朝紅,李志華,等.斑馬魚實驗室繁育系統的建立[J].中山大學學報(醫學科學版),2006,(27):81 -82.
[8]王天奇,孫榮澤,孫德明.實驗用魚類的水環境及其標準化[J].中國比較醫學雜志,2009,19(12):44 -51.
[9]謝英,梁衛華,張曼,等.一種方便實用的實驗室斑馬魚飼養系統[C].第十屆中國實驗動物科學年會論文集,揚州,2012:253-257.
[10]Westerfield M.The Zebrafish Book:A Guide for the aboratory Use of Zebrafish(Danio rerio)[M],4th edition.University of Oregon Press,2000.
[11]Daniel Scholfield,B.S.Information Resources on Zebrafish[M].2010(46).
[12]Kent ML,Spitsbergen JM,Matthews JM,etal.Diseases of Zebrafishin Research Facilites[M]. ZIRC Health Services Zebrafish Disease ManualCulfBreeze.Florida US:US Environmental Protection Agency.2007.
[13]Helfman G,Collette B,Facey D.The Diversity of Fishes[M].MA,Black well Pub lishing Company,1997:528.
[14]顧新國.斑馬魚的飼養與繁殖[J].河北漁業,2007,(12):30-31.
[15]Christian Lawrence.The huabandary of zebrafish(Danio rerio):A review.Aquaculture[M],2007,269:1 -20.
[16]陳春娜,黃穎穎,陳先均.養殖密度對長薄鰍稚魚生長的影響[J].當代水產,2011,(6):65 -68.

