直視下行大鼠氣管插管的方法比較
葉明霞,孔利佳
(華中科技大學同濟醫學院實驗動物學部,武漢 430030)
大鼠是國際通用的標準化的實驗動物,在多種醫學、生物學試驗研究中廣泛應用,在行大鼠開胸手術需呼吸機輔助呼吸、呼吸功能檢測或氣管內給藥等動物實驗中,順利的大鼠氣管插管是實驗成敗的前提。目前常用的插管方法有:頸部切口插管法[1]、頸部切口鋼絲引導插管法[2、3]、盲插法、內窺鏡輔助插管法[4、5]、經口明視插管法[6]和經頸部透照氣管插管法等,但前兩種是有創的插管方法,會對氣管及咽喉部周圍組織造成損傷,從而影響插管的重復進行,進而影響整個實驗的結果。盲插的成功率低,反復插易損傷氣道,容易造成喉痙攣、喉水腫、氣管穿孔、出血和分泌物過多阻塞氣管導致窒息等并發癥,影響實驗結果;所以無創的插管方法為大家所推崇,但由于大鼠呼吸頻率較快、口腔狹小、聲門位置較高,插管時聲門暴露困難,多年來諸多學者對大鼠氣管內插管的方法和插管器械做了大量的研究和改進。專用的大小鼠氣管插管內窺鏡小導管裝置,價格昂貴,不適于教學實驗;也有人借助臨床耳鼻喉科的額鏡進行輔助插管。我們在反復實踐中,對直視插管方法進行了多方面的摸索,自創了小器械,取得了較為滿意的效果,并采用經額鏡輔助和經頸透照兩種直視氣管插管方法,為大鼠進行插管操作,對兩種方法的安全性和有效性進行了比較,現報道如下:
1 材料和方法
1.1 動物
SD大鼠40只,雌雄各半,體重180~300 g,由華中科技大學實驗動物中心提供【SCXK(鄂)2010-0009】。實驗操作在華中科技大學實驗動物中心屏障動物實驗設施內進行【SYXK(鄂)2010-0057】。根據體重分層隨機分配的原則,將大鼠分為經額鏡輔助組和經頸透照組兩個組。
1.2 其他材料
額鏡、照明燈、干凈紗布、大功率冷光源、自制開口器、氣管導管、小棉簽、玻片一個。
1.2.1 自制開口器
成年大鼠聲門張開時直徑約為1.5~2.5 mm,從切牙到舌根的距離約為3 cm,切牙到氣管聲門的距離約為5 cm,從第一氣管環到氣管分叉處的距離為3 cm左右,氣管環呈扁橢圓形,水平徑約3.5 mm,垂直徑約2 mm。根據其解剖結構,使用一次性2 mL塑料注射器針筒,尾端部加工成為楔形(如圖1,彩插4),楔形前端角度約為25°,前端處理光滑,以防刮傷大鼠口腔內黏膜組織,導管頂端和底端長度可根據大鼠體重略加修改。
1.2.2 氣管導管
采用16~20 G靜脈留置針,針頭鈍化處理,針頭長度略短于套管,彎曲約15度;或者使用12號灌胃針[7](16 G)(如圖 2,彩插 4)。根據不同體重大鼠選擇不同型號留置針。150 g左右體重大鼠采用20G留置針、200~300 g大鼠采用18 G留置針、300~350 g大鼠采用16 G留置針。
1.3 麻醉
動物稱重后,阿托品1 mg/(kg·bw)皮下注射,10 min后10%的水合氯醛,3 mL/kg體重的劑量腹腔注射麻醉,針刺大鼠腳掌無反射,證明麻醉完全。
1.4 經額鏡輔助組
術者戴上額鏡,調整光源。將大鼠仰臥于手術板上,頭朝向術者,用棉線將大鼠上門齒固定于手術板一端的釘子上,傾斜手術板約45°,使大鼠頭側墊高,左手將鼠舌用紗布包裹,向左嘴角外上方拉出口腔,使口腔張開,調整額鏡將照射光源引入口腔,右手持插管,彎曲端朝上,向上輕壓大鼠舌根部,即能看到大鼠的聲門隨著呼吸開啟與閉合,趁聲門打開瞬間迅速將氣管導管插入氣道,退出管芯,將玻片放置于管口,如插管是在氣道中,則有圓形霧斑產生(即水蒸氣凝結),若無則判定插入不成功,應立即拔管,稍后重插。
1.5 經頸透照組
大鼠固定方法同上,將光源靠近大鼠下頜部,術者左手將鼠舌用紗布包裹,向左嘴角外上方拉出口腔,右手持自制開口器,長端在上插入大鼠口腔(如圖3,彩插4),尾端抵住大鼠上門齒,然后捏住開口器,口腔外側端下壓,口腔內側長端上挑,使其輕壓舌根部,暴露聲門,光源透過大鼠頸部薄薄的皮膚和肌層,能清楚的看到大鼠的聲門隨著呼吸如魚嘴般開啟與閉合(如圖4,彩插4),此時術者左手放開鼠舌,捏住開口器,保持喉部暴露狀態,右手持插管,彎曲端朝上(如圖5,彩插4),從開口器中進入,趁聲門打開瞬間迅速將氣管插管插入氣道,退出針芯,將留置套管留在氣道內。將玻片放置于管口,如插管是在氣道中,則有圓形霧斑產生(即水蒸氣凝結),若無則判定插入不成功,應立即拔管,稍后重插。圖6(彩插4)示插入氣管成功后,插管前端到達的部位(箭頭所示)。
1.6 觀察指標
兩組均用秒表計時,分別統計兩組插管操作時間(從大鼠麻醉固定好,準備插管開始到確定插管成功所需時間,以秒為單位)、插管次數、插管一次成功率、一周后存活率。
1.7 統計學處理
2 結果
2.1 兩組氣管插管時間、插管次數及插管一次成功率的比較
經頸透照組的插管操作時間、插管次數、一次插管成功率均優于經額鏡輔助組(P<0.05),見表1。
表1 兩組氣管插管時間、插管次數的比較(x±s,n=20)Tab.1 Comparison of the time and frequency of intubation between groups

表1 兩組氣管插管時間、插管次數的比較(x±s,n=20)Tab.1 Comparison of the time and frequency of intubation between groups
注:與經額鏡輔助組比較,★P<0.05。Note:Compared with the conventional groups,★ P <0.05.
別插管時間 插管次數 一次插Thefrequency of intubation管成功率(%)組Group The time of intubation The success rate of the first intubation經額鏡輔助組The conventional group 36.41±3.71 1.78±1.03 60(12/20)經頸透照組The homemade instruments group 10.83±1.69★ 1.04±0.21★ 95(19/20)★
表2 兩組大鼠氣管拔管1 w后存活率比較(±s,n=20)Tab.2 Comparison of the survival rate after extubation 1 week between two groups

表2 兩組大鼠氣管拔管1 w后存活率比較(±s,n=20)Tab.2 Comparison of the survival rate after extubation 1 week between two groups
注:與經額鏡輔助組比較,★P>0.05。Note:Compared with the conventional groups,★ P >0.05.
經額鏡輔助組The conventional group 17 85經頸透照組The homemade instruments group 20 100★
2.2 兩組大鼠氣管拔管1周后存活率比較
經頸透照組大鼠均存活,存活率100%,術后能自主飲食,活動自如。經額鏡輔助組大鼠存活率80%,其中一只在術中死亡,另2只在術后1d內死亡,拔管1周后的存活率比較差異無統計學意義(P>0.05),見表 2。
3 討論
3.1 順利進行直視下插管須注意以下要點:
(1)適度的麻醉:合適的麻醉深度是成功完成氣管插管的前提,麻醉過淺,過度牽拉舌體會造成大鼠抵抗,插管過程中會造成強烈應激反應,大鼠嘔吐反射明顯,并且出現肢體扭動、呼吸節律紊亂、聲門關閉、氣管高度緊張和分泌物增加等,不易將導管插入氣道,強行插管易造成口咽部水腫、聲帶損傷、喉痙攣、會厭或上氣道出血等并發癥。麻醉過深則易造成實驗動物發生呼吸抑制,如不能盡快完成氣管插管極易致實驗動物死亡。大鼠麻醉后用一小棉簽輕觸其喉頭,以沒有嘔吐反射為宜。
(2)適當的體位:將大鼠的上切牙固定在手術板邊緣,手術板抬高傾斜45°,保持大鼠頭和頸背部在同一水平位,有利于顯露聲門和進行插管操作。
(3)大鼠呼吸道檢查:麻醉劑容易使大鼠喉部產生分泌物,阿托品可有效減少氣道分泌物產生。插管前先檢查喉頭、聲門周圍粘膜有無出血和水腫,有無分泌物,若有出血和水腫的大鼠放棄插管,并給予該動物相應的治療;若只是有分泌物,先用自制小消毒棉簽對口腔及喉部進行輕柔擦拭干凈后,再行插管。術畢拔管后,仍需要再進行一次呼吸道清潔。
(4)合適的氣管導管:采用筆者所介紹的靜脈留置針或小鼠灌胃針,長度和直徑合適,可避免插入過深進入一側支氣管,或管徑過粗損傷氣道。另外插管彎曲角度不可過大,插管方向要正確,避免將氣道及喉部扎破而造成大鼠死亡。
(5)正確的插管方法:大鼠仰臥固定,氣道在食道上方,開口器上挑,氣道口一般清晰可見,聲門呈魚嘴狀開合,將插管弧度朝上,把握好大鼠呼吸節奏、趁吸氣時聲門張開,快速插入導管,即可成功,可有效避免插入食管。
(6)插管成功的檢測標準:將一張玻片放置在導管口處,觀察玻片上是否有水蒸氣凝結,插入成功有霧斑,不成功則沒有,此方法簡單方便,準確,節約時間。
3.2 采用本開口器直視插管法值得推廣
本試驗中對比使用了兩種在大鼠試驗中常用的無創直視氣管插管的方法,發現這兩種方法都能完成大鼠氣管插管,額鏡輔助插管的優點為材料易得,操作直觀,缺點為插管視野狹小、口腔內亮度不足,影響聲門的暴露和識別。采用筆者自制的開口器,經頸透照插管操作更簡單,不需佩戴和調整額鏡,而且視野更清楚,氣道口清晰可見,只要把握好大鼠呼吸節奏,插管成功率很高,且縮短了操作時間,顯著降低氣管插管后的死亡率,是進行大鼠氣管插管的好方法,而且此開口器材料易得,價格低廉,使用簡單,值得大力推廣,特別適用于廣大動物實驗教學中。
氣管插管是多種動物實驗的基本操作之一。多年來大鼠氣管插管的方法不斷改進,總體遵循著減少創傷和應激,改善聲門暴露條件,提高插管速度和成功率,減少插管時缺氧發生的原則。隨著科技不斷進步,對大鼠氣管插管方法的改進集中在插管工具的革新上,各種插管工具有效降低了大鼠氣管插管的難度,使動物實驗質量有了明顯提高。與此同時,工具再好,操作者只有通過不斷實踐,積累經驗,才能真正提高大鼠氣管插管的質量。
(本文圖 1,2,3,4,5,6 見彩插 4。)

圖1 自制開口器Fig.1 Homemade instrument

圖2 氣管導管Fig.2 Orotracheal intubation

圖3 開口器插入方法Fig.3 Method of the mouth-gag insert

圖4 通過開口器看到聲門Fig.4 Seen glottis through the mouth-gag

圖5 插管進入方法Fig.5 Method of the intubation insert
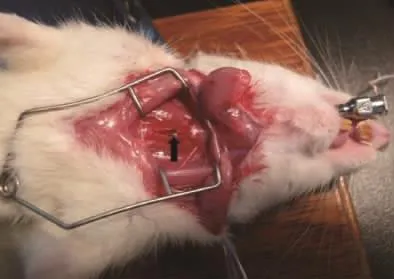
圖6 插管到達的部位Fig.6 Parts of the intubation reach
[1]邱永明,田鑫.大鼠簡易的氣管插管方法[J].上海第二醫科大學學報,2001,21(6):576.
[2]陶運明,莫緒明,戚繼榮,等.一種新的大鼠氣管插管方法[J].中華實驗外科雜志,2004,2l(4):504.
[3]Weksler B,Ng B,Lenert J.A simplified method for endotracheal intubation in the rat[J].Journal of Applied Physiology,1994,76(4):1823.
[4]Clary E M,O'HalloranE K, dela Fuente S G,etal.Videoendoscopic endotracheal intubation Of the rat[J].Lab Anim.2004,38(2):158.
[5]Fuentes J M,Hanly E J,Bachman S L,et al.Videoendoscopic endotracheal intubation in the rat:a comprehensive rodent model of laparoscopic surgery[J].The Journal of Surgical Research.2004,22(2):240.
[6]Cambron H,Latulippe J F,Nguyen T,et al.Orotracheal intubation of rats by transillumination[J].Labortary Animal Science,1995,45(3):303.
[7]王響英,吳淑燕,李蘇安,等.大鼠直視氣管插管方法[J].上海實驗動物科學,2004,24(2):107.

