連續睡眠剝奪對大鼠認知能力、神經遞質及海馬結構的影響
馬雙雙,齊 陽,王 瑩,徐紀平,蔡東聯,黃 文,李兆申
充足的睡眠是維持人體健康和保持學習工作效率的前提,隨著社會的發展和社會競爭壓力的增加,人們的睡眠時間和質量普遍下降。近年來針對遠航官兵心理和生理的研究[1-2]表明,遠航不僅將對我軍發展提出深刻挑戰,同時對軍事醫學研究提出了新的課題。為探討長距離航行和連續作戰對官兵身心的危害,本研究擬利用連續72 h睡眠剝奪大鼠模型,觀察并探討連續睡眠剝奪對大鼠學習記憶能力、腦干中單胺類遞質的含量、海馬區學習記憶相關遞質N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)和γ-氨基丁酸(γ-aminobutyric acid,GABA)受體 mRNA表達及海馬神經元超微結構變化等方面的影響。
1 材料與方法
1.1 動物及分組 SPF級雄性大鼠20只,購自上海西普爾-必凱實驗動物研究所,體質量150~160 g。將大鼠適應性喂養7 d后放入Y迷宮刺激器,淘汰對電擊不敏感者及異常遲鈍者,剩余12只大鼠按數字表法隨機分為正常睡眠對照組(對照組)和睡眠剝奪組,每組6只。
1.2 試劑與儀器 去甲腎上腺素(norepinephrine,NE)、腎上腺素(adrenalin,AD)、多巴胺(dopamine,DA)三聯試劑盒和5-羥色胺(5-hydroxytryptamine,5-HT)試劑盒均為德國LDN公司產品;Trizol購自Invitrogen公司,RT-PCR M-MLV試劑盒為Promega公司產品,SYBR Green試劑盒(ABI);引物由Invitrogen合成;Real Time PCR反應體系由Transhold公司提供;連續V型食槽式動物睡眠剝奪箱由海軍醫學研究所研制并提供;H-7650分析透射電鏡為日本日立公司產品;Y型迷宮刺激器由安徽淮北正華生物儀器設備有限公司生產。
1.3 迷宮訓練 Y迷宮三臂等長,分別命名為I區、II區、III區,臂間夾角為 120°,迷宮底部鋪銅棒電網。當I、II、III任一區域指示燈亮時,亮燈的區域為安全區,供大鼠逃避;其余區域銅棒通電,為刺激區。每周對各組大鼠進行3天迷宮訓練,每只每天訓練10次。
1.4 連續睡眠剝奪 對照組大鼠放置于有大圓形平臺(直徑20 cm)的模擬睡眠剝奪箱里,大鼠可以在平臺上正常睡眠;睡眠剝奪組大鼠放置于有小圓形平臺(直徑6 cm)的睡眠剝奪箱,每個睡眠剝奪箱內有8個小平臺,為了讓大鼠有空間移動,睡眠剝奪箱內放6只大鼠。睡眠剝奪組大鼠進行連續72 h睡眠剝奪。所有大鼠均可以自由進食和飲水,每日
1.10 統計學處理 所有數據以均數±標準差(±s)表示,采用SPSS 18.0統計軟件,組間比較進行方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 迷宮反應正確率 2組大鼠在睡眠剝奪前的迷宮反應率分別為89%和90%,差異無統計學意更換箱中水環境,保持箱內清潔。
1.5 記憶行為學檢測 在72 h睡眠剝奪后,對2組大鼠進行記憶能力檢測。將各組大鼠分別放到Y迷宮中,開啟安全區和刺激區,大鼠能在5 s內迅速反應到達安全區并停留20 s為1次正確反應,規定時間內沒能到達安全區或者沒能在安全區停留20 s則為錯誤反應,由2名研究員同時目測判斷。每只大鼠進行10次,記錄正確反應次數。
1.6 標本采集 迷宮測試后,用10%水合氯醛將大鼠麻醉,處死后快速在冰袋上分離腦干和海馬,先放入液氮罐中后移至-80℃冰箱中保存待測。
1.7 腦干神經遞質檢測 將冷凍腦干組織研磨、勻漿后,按試劑盒說明測定NE、AD和DA的含量;按5-HT試劑盒的說明檢測5-HT含量。
1.8 NR1/NR2A mRNA 和 GABAARα1 mRNA 的PCR檢測 通過實時熒光定量PCR技術測定NMDA受體亞單位NR1/NR2A mRNA以及GABA受體GABAARα1 mRNA的表達水平。操作步驟如下:選取2組大鼠海馬區腦組織,于液氮中迅速研磨,用Trizol抽提海馬總RNA,并按M-MLV試劑盒說明逆轉錄合成cDNA,PCR引物分別為:NR1 mRNA(103 bp);上游引物5'-AGTGGGCATCTACAATGGT3',下游引物5'-TCTGGTGGACATCTGGTATC-3';NR2A mRNA(132 bp)上游引物5'-GTCGGAAGTTCGTCAAGAT-3',下 游引 物 5'-CCAGGTAGAGGTCATAGGTG-3';GABAARα1 mRNA(136 bp)上游引物 5'-AAGCCCGTGATGAAGAAAAG-3',下 游 引 物 5'-TCGTGAAGACAGTGGTGTTG-3';內參 ratβ-actin(155 bp)上游引物5'-CCTCTATGCCAACACAGT-3',下游引物5'-AGCCACCAATCCACACAG-3'。PCR擴增按 SYBR Green試劑盒說明進行,反應體系為20μl。擴增條件:95℃ 5 min→95℃ 5 s→60℃ 30 s→溶解曲線分析,共40個循環。
1.9 海馬區組織電鏡觀察 根據大鼠腦立體定位圖定位右側海馬區取材,2.5%戊二醛固定,梯度乙醇脫水,樹脂包埋,超薄切片,染片,透射電鏡觀察神經元超微結構。義;72 h睡眠剝奪后,對照組正確率為91%,睡眠剝奪組為54%,差異有統計學意義(P<0.05)。
2.2 大鼠腦干單胺類遞質比較 2組大鼠腦干中NE、AD、DA和5-HT含量見表1。由表1可以看出,對照組NE、AD、DA明顯高于睡眠剝奪組(P<0.05);對照組5-HT顯著低于睡眠剝奪組(P<0.05)。
表1 2組大鼠腦干中單胺類遞質含量的比較(±s,各組 n=6)

表1 2組大鼠腦干中單胺類遞質含量的比較(±s,各組 n=6)
注:與對照組比較a P<0.05;AD、NE、DA、5-HT分別為腎上腺素、去甲腎上腺素、多巴胺、5-羥色胺
組別 AD(ng/g) NE(ng/g) DA(ng/g) 5-HT(mg/L)對照組 1.351±0.228 33.944±8.140 4.801±0.635 6.685±1.191睡眠剝奪組 0.896±0.178a 22.424±4.487a 3.778±0.419a 9.727±1.853a
2.3 腦干組織幾種物質mRNA的PCR結果 睡眠剝奪組NR1mRNA和NR2AmRNA相對表達量顯著低于對照組(P<0.05),睡眠剝奪組的GABAARα1mRNA相對表達量顯著高于對照組(P<0.05)。見表2。
表2 2組大鼠海馬組織中GABAARα1、NR1、NR2A m RNA表達情況(±s,各組 n=6)

表2 2組大鼠海馬組織中GABAARα1、NR1、NR2A m RNA表達情況(±s,各組 n=6)
注:與對照組比較a P<0.05;GABA為γ-氨基丁酸
1mRNA NR1mRNA NR2AmRNA對照組 (0.581±0.086)×10-3(9.885±1.833)×10 -3(2.616±0.453)×10組別 GABAARα-3睡眠剝奪組 (0.794±0.144)×10-3a(4.999±1.077)×10 -3a(1.256±0.261)×10-3a
2.4 海馬區神經元超微結構變化 對照組大鼠海馬區神經元結構基本正常,細胞器完整,線粒體清晰,粗面內質網均勻分布,未見空泡樣變;睡眠剝奪組大鼠海馬區神經細胞線粒體高度腫脹、可見明顯的脫顆粒、嵴斷裂和溶解現象。見圖1。
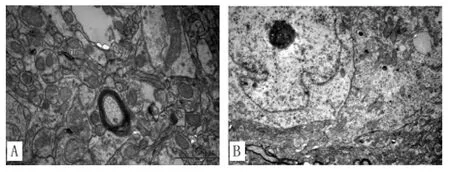
圖1 2組大鼠海馬神經元電鏡觀察結果(×10 000)
3 討論
大量的研究表明,谷氨酸對學習記憶起正調節作用,GABA對學習記憶起負調節作用[3]。在睡眠剝奪過程中,興奮性神經遞質谷氨酸大量釋放,產生了神經毒性作用,造成神經元急性水腫,神經元變性壞死,導致NMDA受體mRNA的下調[4]。GABA是由谷氨酸經谷氨酸脫羧酶脫羧而成。大量的谷氨酸堆積時,谷氨酸脫羧酶活性增強,將谷氨酸轉化為GABA以減輕神經毒性作用,GABA的合成增多激活了GABA受體,GABA受體mRNA表達增加[4]。本實驗中,大鼠海馬里降低的NMDA受體和升高的GABA受體可能是大鼠學習記憶能力下降的一個重要因素。
此外,長時間睡眠剝奪后,腦內單胺類遞質發生改變。睡眠剝奪后,突觸前膜5-HT受體敏感性下降,對5-HT的再攝取減少,同時5-HT合成增加,機體內5-HT水平增高,出現疲勞感和睡意。鄭樂穎等[5]研究發現,在睡眠剝奪前期,機體能通過增加單胺氧化酶活性加快5-HT轉化為5-羥吲哚乙酸,以減少5-HT在腦內的積累,達到維持清醒的目的。但是,隨著睡眠剝奪時間的延長,單胺氧化酶的活性降低,轉化作用減弱,5-HT在腦干、下丘腦等蓄積,機體產生更加嚴重的疲勞感[6]。在本實驗中,經過72 h睡眠剝奪的大鼠腦干中5-HT含量顯著升高,可能是由于單胺氧化酶的活性低,導致5-HT的集聚。
DA是哺乳動物大腦中主要的兒茶酚胺類神經遞質,占腦內所有兒茶酚胺類遞質含量的80%。DA對神經系統有興奮作用,隨著睡眠剝奪的進行,中樞疲勞的出現,中樞中DA含量逐漸減少。研究表明,被剝奪快眼睡眠的動物前額皮質中DA含量下降而NE水平升高[7-8]。本實驗中,睡眠剝奪后的大鼠腦干中DA下降,可能是其認知功能下降的重要因素。
NE能改善神經元細胞的可塑性,促進學習記憶,與中樞學習記憶功能關系密切。Basheer等[9]研究證明,NE系統活動有利于信息的鞏固和再現,NE活性降低能引起與年齡有關的記憶障礙。Mallick等[10]研究發現,短時間的睡眠剝奪(<2 d)會造成大鼠海馬NE濃度明顯升高,而在長時間的睡眠剝奪后,大鼠海馬NE含量下降。其可能原因是短時間的睡眠剝奪造成應激狀態導致NE合成和釋放增加,而再攝取受到抑制,NE的釋放速率大于再攝取速率,造成NE在海馬內蓄積。長時間睡眠剝奪后,大量蓄積的NE致使神經元損傷,致使機體大量降解蓄積的NE,同時長時間的睡眠剝奪致使大量能量的消耗,NE合成速率明顯降低,導致腦內NE含量下降,學習能力降低。本實驗中,睡眠剝奪后大鼠的NE含量下降,可能與神經元損失后機體的自我保護機制有關。
[1] 何俐勇,許輝,樊龍中,等.長航對艦艇官兵血液流變學和凝血功能的影響[J].中華航海醫學與高氣壓醫學雜志,2012,19(4):237-238.
[2] 林萃靈,樊龍中,陳正,等.艦艇官兵長時間遠洋護航血清生化指標變化研究[J].華南國防醫學雜志,2011,25(5):421-423.
[3] Kluda A,Martinac B,Adams DJ.Polymodal regulation of NMDA receptor channels[J].Channels(Austin),2007,1(5):334-343.
[4] 張蓉,李峰,李維,等.中藥對疲勞大鼠腦內學習記憶相關遞質谷氨酸及γ-氨基丁酸受體mRNA表達的影響[J].中國中醫藥信息雜志,2011,18(8):39-41.
[5] 鄭樂穎,季紅光,王海明,等.睡眠剝奪對大鼠腦5-羥色胺代謝及行為的影響[J].中國行為醫學科學,1998,7(4):256-257.
[6] Thakkar M,Mallick BN.Effect of rapid eyemovement sleep deprivation on rat brain monoamine oxidascs[J].Neurosci,1993,55(3):677-681.
[7] Niijima F,Saito H,Murai S,et al.Effects of atomoxetine on levels ofmonoamines and related substances in discrete brain regions in mice intermittently deprived of rapid eyemovement sleep[J].Biol Pharm Bull,2010,33(4):617-621.
[8] Cirelli C.How sleep deprivation affects gene expression in the brain:a review of recent findings[J].J Appl Physiol,2002,92(1):394-400.
[9] Basheer R,Magner M,McCarley RW,et al.REM sleep deprivation increases the levels of tyrosine hydroxylase and norepinephrine transportermRNA in the locus coeruleus[J].Brain Res Mol Brain Res,1998,57(2):235-240.
[10]Mallick BN,Singh S,Singh A.Mechanism of noradrenaline-induced stimulation of Na-K ATPase activity in the rat brain:implications on REM sleep deprivationinduced increase in brain excitability[J].Mol Cell Biochem,2010,336(1-2):3-16.

