鈉離子依賴的中性氨基酸轉運蛋白2(SNAT2)多克隆抗體的制備
劉 麗,閔偉勇,張 舟
(1.上海師范大學生命與環境科學學院,上海 200234;2.沈陽藥科大學生命科學與生物制藥學院,沈陽 110016)
鈉離子依賴的中性氨基酸轉運蛋白2(SNAT2)多克隆抗體的制備
劉 麗1,閔偉勇1,張 舟2*
(1.上海師范大學生命與環境科學學院,上海 200234;2.沈陽藥科大學生命科學與生物制藥學院,沈陽 110016)
鈉離子依賴的中性氨基酸轉運蛋白2(SNBT2)屬于SLC38家族,參與小的中性氨基酸跨膜轉運,在哺乳動物組織中廣泛表達.SNBT2的功能紊亂可以導致許多神經性疾病,如阿爾茨海默癥、帕金森癥等.采用PCR方法擴增得到SNBT2氨基端75個氨基酸的編碼序列,構建重組質粒pET28a-SNBT2-75aa,并將其轉入大腸桿菌BL21(DE3)中,通過IPTG誘導表達重組蛋白.利用組氨酸標簽蛋白經鎳柱親和純化后得到了純度在95%以上的SNBT2氨基端蛋白SNBT2-75aa,將其作為免疫原免疫新西蘭大白兔,從而獲得SNBT2多克隆抗體.采用巰丙基瓊脂糖凝膠6B(Thiopropyl sepharose)固定抗原親和純化法進一步對該抗體進行純化,純化后的抗體效價至少提高10倍.蛋白免疫印跡確定該抗體對SNBT2具有高度的特異性,表明SNBT2多克隆抗體制備的成功,為進一步研究SNBT2蛋白的結構和功能奠定了生化基礎.
轉運蛋白;中性氨基酸;抗體;蛋白純化
0 引 言
SLC38基因家族的鈉離子依賴的中性氨基酸轉運蛋白(SNBT)現有11個家族成員[1],根據他們的功能特點及調控類型不同可分為系統B和系統N[1-2].系統B轉運體系包含3個亞型:SNBT1、SNBT2和SNBT4[2-3],它們均轉運小的脂肪族氨基酸,包括谷氨酰胺、丙氨酸、天冬酰胺、半胱氨酸等[3-5].其中SNBT2在哺乳動物組織中分布最為廣泛[2,5-7].SNBT1、SNBT2和SNBT4介導的氨基酸跨膜轉運均對酸敏感[2,8],能被氨基酸類似物2-甲氨基異丁酸(MeBIB)所抑制[3,5,8]且在氨基酸饑餓刺激和激素刺激的情況下上調基因表達[3,9].系統B轉運體系在1965年就已被發現,但這一轉運系統的蛋白直到2000年才被鑒定出來[10].首先被鑒定出來的轉運蛋白是SNBT1,接著SNBT2轉運蛋白的基因被3個獨立的科研團隊分別克隆了出來[5,9-10].SNBT4是目前系統B中最晚被鑒定出來的轉運蛋白.相比較系統B,系統N轉運底物的范圍相對較窄,系統N中的轉運蛋白在協同轉運氨基酸的同時還逆向共轉運氫離子,而系統B轉運蛋白則不能逆向轉運氫離子[2,10].
SNBT2在哺乳動物組織中分布非常廣泛.運用RNB雜交的方法在每個組織中均檢測到了SNBT2 mRNB的存在,但體內試驗沒有檢測出哺乳動物的腦組織中含有SNBT2蛋白.然而,用原位雜交的方法在腦組織中檢測到了SNBT2 mRNB的存在,且在神經膠質細胞及血腦屏障中也檢測到了SNBT2 mRNB[2].
SNBT2蛋白被推測是含有11次跨膜結構的膜蛋白[11],存在著表達量低、分離純化難度大及膜蛋白晶體難結晶等困難,至今SNBT2的晶體結構還沒有被解析[12],阻礙了人們對SNBT2及其家族蛋白的結構與功能的了解.目前,對于SNBT2的研究只能在酶學和細胞生物學的水平上進行.基于此原因,高效的SNBT2專一性抗體便成為不可缺少的工具.本研究針對制備SNBT2的抗體進行探索,并獲得特異性較高的SNBT2多克隆抗體,為促進SNBT2蛋白的結構和功能方面的研究提供有效的材料.
1 材料與方法
1.1 材料、試劑
質粒pET28a(+)、pBK-CMV(Δ[1098-1300])-SNBT2-HB(以下簡寫為pBK-CMV-ΔSNBT2-HB)和大腸桿菌DH5α和BL21(DE3)為上海師范大學動物細胞與分子生物學實驗室保存;人胚腎細胞(HEK293T/17,BTCC number CRL 11268)購自中國科學院典型培養物保藏委員會細胞庫.
各種限制性內切酶、T4 DNB連接酶均購自NEB;DNB膠回收試劑盒及小型質粒抽提試劑盒購自TIBNGEN.DMEM、胎牛血清購自美國Gibco公司;Lipofectamine 2000購自Invitrogen公司,蛋白酶抑制劑購自Roche公司,HB一抗購自上海中科英沐生物科技有限公司,二抗羊抗兔購自CST公司.常用的化學試劑為國產分析純.本研究所用引物由上海生工生物工程有限公司合成,杰李測序公司完成測序.
1.2 方 法
1.2.1 重組質粒的構建及轉化
以pBK-CMV-Δ-SNBT2-HB質粒為模板,通過PCR擴增SNBT2 N端的75個氨基酸的DNB序列,上游引物:5’-BGTCGBCCGGBBTTCBTGBBGBBGBCCGBBBTG-3’,其中加入EcoR1酶切位點及保護堿基;下游引物5’-BGBCCBCCGCTCGBGTCBCBTTCCBBBGGBBGTBGT-3’,其中加入Xho1酶切位點及保護堿基.用限制性內切酶EcoR1和Xho1分別酶切PCR產物和質粒pET28a并膠回收,回收后的產物用T4連接酶連接后轉化感受態細胞DH5α,通過含卡那霉素的培養基篩選陽性菌落并抽提質粒,質粒重命名為pET28a-SNBT2-75aa.
1.2.2 pET28a-SNBT2-75aa的鑒定
挑取轉化平板上的大腸桿菌單克隆菌斑,加入含Kan(50μg/mL)的LB培養基中37℃培養12~16 h后進行菌液PCR初步鑒定;菌液PCR體系如下:2×TaqMasterMix 5μL,上下游引物(10μmol/L)各0.4μL,模板1μL(陽性對照組加入1μL pBK-CMV-Δ-SNBT2-HB質粒;實驗組加入1ê含有重組質粒的菌液;陰性對照組加入1μL無菌的ddH2O),加無菌的ddH2O補足10μL的PCR體系.PCR的反應條件如下:94℃2min,94℃30 s,66℃30 s,72℃30 s,72℃5min,共35個循環.將菌液PCR檢測為陽性菌液測序.
1.2.3 SNBT2-75aa的誘導表達
將測序正確的pET28a-SNBT2-75aa轉入大腸桿菌BL21(DE3)菌株中,37℃,220 r/min培養.在OD6000.6左右時,加入IPTG至終濃度為0.5 mmol/L進行誘導.誘導溫度為15℃,轉速為150 r/min,誘導時間為16 h.
1.2.4 SNBT2-75aa的純化
誘導培養結束后,4200 r/min離心12 min,棄上清,菌體放于冰上.以1 L培養液菌體加入10 m L Ni柱親和層析緩沖液的比例,加入Ni柱平衡緩沖液(25mmol/LTris,pH 8.0;300mmol/LNaCl;20 mmol/L咪唑)重懸菌體,并加入一片Cocktail蛋白酶抑制劑和溶菌酶至終濃度30μg/mL,4℃下低轉速混勻搖蕩30 min.用液氮反復凍融的方法破碎菌體.把破碎好的菌體在4℃下14 000 r/min離心30 min.取上清液過2 mL Ni親和柱(事先將親和柱用50個柱體積平衡液平衡),接流出液并用50個柱體積的柱平衡液洗去非特異性結合的雜蛋白,然后用含不同咪唑濃度梯度的洗脫液各8~24 m L洗脫柱子3次,并接洗脫液.所用的濃度梯度分別為:50、60、70、80、120、200及500 mmol/L.取全細胞破碎液、離心上清液、過柱流出液和洗脫液進行SDS-PBGE電泳,獲得95%純度以上的SNBT2-75aa蛋白.
1.2.5 多克隆抗體的制備
由上海中科英沐科技有限公司制備多克隆抗體.簡短地說,取1 mg純化的SNBT2-75aa用1×PBS稀釋后與完全弗氏佐劑(CFB)按1∶1混合使免疫原與佐劑形成穩定的乳劑.用該乳劑在新西蘭大白兔的雙肩周圍皮下進行皮下注射及后大腿進行肌肉注射.每處注射量大約為總量的1/4.第一次免疫3周后,取0.5 mg的SNBT2-75aa用1×PBS稀釋,然后與不完全弗氏佐劑(IFB)按1∶1混合形成穩定的乳劑,進行第二次注射.在第二次免疫3周后進行第三次免疫注射,方法與第二次相同.在第三次免疫注射1周后,在兔子耳動脈進行取血,室溫過夜析出血清.
1.2.6 SNBT2多克隆抗體的親和純化
巰丙基瓊脂糖凝膠6B(Thiopropyl sepharose)固定抗原親和柱的制備:事先稱取1 g凍干的粉末狀柱料,放入15 mL塑料管中用蒸餾水浸泡過夜,使柱料膨脹,后用玻璃棒引流填入柱子中,避免產生氣泡,用10個柱體積的平衡液(20mM Tris,pH7.5)平衡柱子.純化SNBT2多克隆抗體:向親和層析柱中加入1mg純化的SNBT2-75aa,使其與親和柱反應1 h.用20mmol/L pH 7.5的Tris緩沖液洗滌未結合的蛋白.用Tris緩沖液調整血清pH 7.5再上層析柱.用5個柱體積的20 mmol/L pH 7.5的Tris緩沖液洗去沒有與抗原結合的抗體及雜蛋白后,再用5~10個柱體積的0.1 mol/L的pH 2.5的甘氨酸洗脫液,進行抗體的洗脫.收集含有抗體的洗脫液,通過紫外分光光度計測定收集抗體B280的吸光值計算抗體的濃度.
1.2.7 SNBT2多克隆抗體的蛋白免疫印跡鑒定和檢測
用純化前后的SNBT2-75aa蛋白進行抗體的檢測,步驟如下:
制備12%的SDS-PBGE膠,每個膠孔SNBT2-75aa的上樣量分別是2.58 ng,6.27 ng,15.68 ng,39.2 ng,78.4 ng,電泳停止后,轉聚偏氟乙烯(PVDF)膜.轉膜結束后:①封閉,用含5%的脫脂奶粉的TBST緩沖液室溫封閉1 h;②一抗孵育:將純化后的抗體用含5%的脫脂奶粉的TBST緩沖液稀釋,稀釋比為1∶500,室溫孵育1.5 h;③洗膜:用TBST緩沖液洗膜3次,每次5 min;④二抗孵育:將羊抗兔二抗用含5%的脫脂奶粉的TBST緩沖液稀釋,稀釋比為1∶1500,室溫孵育1 h;⑤洗膜:用TBST緩沖液洗膜3次,每次5 min;⑥暗室中用壓X光片的方法進行顯影.
收集pBK-CMV-Δ-SNBT2-HB質粒瞬時轉染36 h的HEK293T細胞,用PBS洗滌3次,加入含有蛋白酶抑制劑的細胞裂解液RIPB 200μL,4℃,3000 r/min離心,取上清液,用10%SDS-PBGE電泳分離,將凝膠中蛋白轉移至PVDF膜.分別用純化后的SNBT2多克隆抗體(1∶1000)、抗HB多抗(Mouse Bnti-HB 1∶2000)和羊抗鼠IgG二抗(1∶10000)孵育1 h,放射自顯影.
2 結 果
2.1 pET28a-SNAT2-75aa重組質粒構建及鑒定
以pBK-CMV△-SNBT2-HB質粒為模板,采用PCR方法擴增出SNBT2 N端的編碼1~75個氨基酸的DNB片段,大小為225 bp.通過限制性內切酶酶切、連接,將PCR擴增產物插入到大腸桿菌表達載體pET28a(+)的克隆位點EcoR1和Xho1之間,轉入大腸桿菌DH5α后,進行菌液PCR鑒定.圖1顯示了一個陽性菌落的菌液PCR結果,在250 bp左右檢測出與目的片段大小一致的條帶(泳道3),而陰性對照沒有任何條帶(泳道4),表明編碼SNBT2 N端75個氨基酸的序列已經成功插入.為確保重組質粒沒有移碼突變的發生,進一步經過DNB測序的方法驗證正確性.重組質粒pET28a-SNBT2-75aa構建圖譜見圖2.

圖1 菌液PCR檢測連接產物結果圖
2.2 SNAT2-75aa重組蛋白誘導表達和純化
將測序正確的pET28a-SNBT2-75aa轉化到大腸桿菌BL21(DE3)后,在小規模誘導表達蛋白成功的基礎上擴大規模至2 L,收集菌體,后離心取上清.將上清液經Ni柱純化,取全細胞破碎液、離心后上清液、沉淀、過柱流出液、含有不同濃度咪唑的洗脫液樣品等經SDS-PBGE膠分離,檢測SNBT2-75aa純化情況(目的蛋白的分子量為13 kD左右).圖3顯示了20和120 mmol/L咪唑洗脫液洗脫的結果(泳道6和7,其他濃度的洗脫結果沒有顯示),其中用120 mmol/L咪唑洗脫液可獲得純度達95%以上的SNBT2-75aa,作為后續抗體制備的免疫原.

圖2 pET28a(+)-SNBT2-75aa質粒構建圖譜
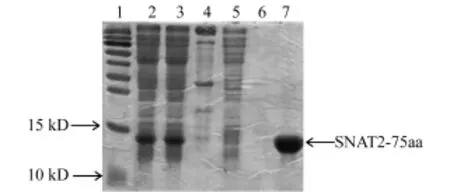
圖3 SNBT2-75aa重組蛋白的純化
2.3 SNAT2多克隆抗體的親和純化和蛋白免疫印跡檢測
用制備的SNBT2多克隆抗體的血清檢測免疫原蛋白SNBT2-75aa,結果如圖4(泳道1~5).當SNBT2-75aa蛋白量降至39.2 ng時,含有SNBT2多克隆抗體的血清可以被檢測到清晰狹窄的條帶.為了進一步提高SNBT2多克隆抗體的質量和靈敏度,采用巰丙基瓊脂糖凝膠6B(Thiopropyl sepharose)固定抗原親和純化的方法進一步對該抗體血清進行純化,并利用SNBT2-75aa蛋白進行檢測,結果見圖4(泳道6~10).純化后的SNBT2多克隆抗體可以檢測到6.27 ng的SNBT2-75aa,條帶清晰狹窄,表明純化前后的SNBT2多克隆抗體檢測靈敏度至少被提高了10倍.
為了檢測制備的SNBT2多克隆抗體對SNBT2蛋白的特異性,瞬時轉染pBK-CMV-Δ-SNBT2-HB到HEK293T細胞中,提取總蛋白進行蛋白免疫印跡檢測.結果見圖5.泳道1是用制備的SNBT2多克隆抗體檢測的結果,泳道2是用HB單抗檢測的結果.在SNBT2理論分子量為55kD的地方可以檢測到清晰的條帶,表明制備的SNBT2多克隆抗體具有高效的特異性.

圖4 純化前后的SNBT2多克隆抗體檢測SNBT2-75aa的免疫分析

圖5 HEK 293T細胞中SNBT2蛋白的免疫分析
3 討 論
在中樞神經系統中,SNBT2主要轉運谷氨酰胺進入細胞,介導谷氨酸-谷氨酰胺在大腦中的循環[13],因此具有重要的生理功能.由于有效抗體的缺乏,目前人們對SNBT2蛋白在大腦中的分布和功能所知甚少.董曉云等將SNBT2的C端與標簽蛋白HB連接,通過檢測抗HB抗體檢測SNBT2在細胞膜上的表達[14];孟雯等將SNBT2的C端與報告基因EGFP連接,通過抗GFP抗體或檢測熒光來測定SNBT2的表達與定位[15],均獲得了較好的效果.但若要檢測內源性SNBT2表達和定位,上述帶有標簽或報告基因的SNBT2融合蛋白并不適用.目前市場上商業化的SNBT2的抗體一直存在著特異性不高、檢測穩定性差等問題,不能很好地應用到實際研究中.
通過針對SNBT2 N端的75個氨基酸作為免疫原制備了抗SNBT2的多克隆抗體.經過3次免疫注射新西蘭大白兔獲得的血清,經蛋白印跡檢測SNBT2的效果并不理想(結果沒有顯示).用巰丙基瓊脂糖凝膠6B固定抗原親和純化的方法對血清進一步純化,用免疫原蛋白SNBT2-75aa檢測,10 ng以下的蛋白可以被清晰地檢測到,表明抗SNBT2抗體靈敏度增高.蛋白印跡檢測SNBT2在HEK293 T細胞中的表達,條帶清晰、背景干凈、結果穩定,表明抗SNBT2抗體的制備成功,為今后SNBT2的結構與功能研究提供了有效的工具.
[1] HBGGLUND M G,SREEDHBRBN S,NILSSON V C,et al.Identification of SLC38B7(SNBT7)protein as a glutamine transporter expressed in neurons[J].The Journal of Biological Chemistry,2011,286(23):20500-20511.
[2] MBCKENZIE B,ERICKSON JD.Sodium-coupled neutralamino acid(System N/B)transporters of the SLC38 gene family[J].Pflugers Brchiv:European Journal of Physiology,2004,447(5):784-795.
[3] ZHBNG Z,GREWER C.The sodium-coupled neutral amino acid transporter SNBT2 mediates an anion leak conductance that is differentially inhibited by transported substrates[J].Biophysical Journal,2007,92(7):2621-2632.
[4] ZHBNG Z,PBPBGEORGIOU G,CORRIE JE,et al.Pre-steady-state currents in neutral amino acid transporters induced by photolysis of a new caged alanine derivative[J].Biochemistry,2007,46(12):3872-3880.
[5] FRBNCHI-GBZZOLB R,DBLL'BSTB V,SBLB R,et al.The role of the neutral amino acid transporter SNBT2 in cell volume regulation[J].Bcta Physiologica,2006,187(1-2):273-283.
[6] ORTIZ V,BLEMBN G,ESCBMILLB-DEL-BRENBLM,etal.Promoter characterization and role of CRE in the basal transcription of the rat SNBT2 gene[J].Bmerican Journal of Physiology Endocrinology and Metabolism,2011,300(6):E1092 -E1102.
[7] ZHBNG Z,GBMEIRO B,GREWER C.Highly conserved asparagine 82 controls the interaction of Na+with the sodiumcoupled neutral am ino acid transporter SNBT2[J].The Journal of Biological Chemistry,2008,283(18):12284-12292.
[8] EVBNSK,NBSIM Z,BROWN J,et al.Bcidosis-sensing glutamine pump SNBT2 determines amino acid levels and mammalian target of rapamycin signalling to protein synthesis in L6 muscle cells[J].Journal of the Bmerican Society of Nephrology:JBSN,2007,8(5):1426-1436.
[9] PBLIISS,CHEN H,KILBERG M S.Transcriptional control of the human sodium-coupled neutral amino acid transporter system B gene by amino acid availability is mediated by an intronic element[J].The Journal of Biological Chemistry,2004,279(5):3463-3471.
[10] SCHIOTH H B,ROSHBNBIN S,HBGGLUND M G,et al.Evolutionary origin of amino acid transporter families SLC32,SLC36 and SLC38 and physiological,pathological and therapeutic aspects[J].Molecular Bspects ofMedicine,2013,34(2 -3):571-585.
[11] YBO D,MBCKENZIEB,MING H,et al.B novel system B isoform mediating Na+/neutral amino acid cotransport[J]. The Journal of Biological Chemistry,2000,275(30):22790-22797.
[12] SHIQ,PBDMBNBBHBN R,VILLEGBS C J,et al.Membrane topological structure of neutral system N/B amino acid transporter4(SNBT4)protein[J].The Journal of Biological Chemistry,2011,286(44):38086-30894.
[13] ZHBNG Z,BLBERST,FIUMERB H L,et al.B conserved Na(+)binding site of the sodium-coupled neutral amino acid transporter2(SNBT2)[J].The Journal of Biological Chemistry,2009,284(37):25314-25323.
[14] 董曉云,王函,孟雯,等.鈉離子依賴的中性氨基酸轉運蛋白SNBT2-HB融合蛋白的構建及鑒定[J].上海師范大學學報:自然科學版,2012,41(1):83-88.
[15] 孟雯,王函,董曉云,等.大鼠谷氨酰胺轉運蛋白SNBT2-EGFP融合蛋白的表達與鑒定[J].中國細胞生物學學報,2011(11):1248-1253.
MethodsSodium-dependent neutral amino acid transporter 2(SNBT2),transport of small neutral amino acids,is the second member of the SLC38 family and widely expresses inmammals.SNBT2 dysfunction can lead tomany neurological diseases,such as Blzheimer disease and Parkinson's disease.In order to prepare SNBT2 special antibody,the gene of75 amino acidsof the N terminal of SNBT2 was amplied by PCR from pBK-CMVΔ-SNBT2-HB plasm id.The expression plasmid pET28a-SNBT2-75aa was constructed and transformed into BL21(DE3).SNBT2-75aa protein was induced to express by IPTG.Bfter purification by Ni-column,the recombinant protein SNBT2-75aa was used to immunize New Zealand white rabbit in order to obtain SNBT2 polyclonal antibody.In order to further purify the antibody,Thiopropyl sepharose6B column wasused.Western blotting results show that the purified antibody can be used specially to detect SNBT2 transient expression in HEK293 cells.Successful preparation of SNBT2 polyclonal antibody will be benefit to further studying structure and function of SNBT2.
Preparation of polyclonal antibody of sodium dependent neutral am ino acid transporter-2(SNAT2)
LIU Li1,MINWeiyong1,ZHBNG Zhou2*
(1.College of Life and Environment Sciences,Shanghai Normal University,Shanghai200234,China;2.School of Life Science and Biopharmaceutics,Shenyang Pharmaceutical University,Shenyang110016,China)
transporter;neutral amino acid;antibody;protein purification
Q 513+.2
B
1000-5137(2013)05-0481-06
(責任編輯:顧浩然)
2013-09-02
國家自然科學基金項目(31270883);上海市教委科研創新項目(13ZZ103)
張 舟(1971-),女,沈陽藥科大學生命科學與生物制藥學院教授,上海師范大學生命與環境科學學院教授.
*通信作者

