泛素-蛋白酶體系統在T細胞免疫和哮喘中的作用①
宋慧慧 時國朝 (上海交通大學醫學院附屬瑞金醫院呼吸科,上海 200025)
1 泛素-蛋白酶體系統的結構及其功能
蛋白的翻譯后修飾與基因的轉錄和翻譯一起共同調節蛋白的表達水平和活性,常見的蛋白翻譯后修飾包括磷酸化、乙酰化、甲基化等。泛素化是蛋白翻譯后修飾的一種,可對細胞功能進行廣泛而復雜的調控。泛素化是指在泛素活化酶(Ubiquitin activating enzyme,E1)、泛 素 結 合 酶 (Ubiquitin conjugating enzyme,E2)、泛素連接酶 (Ubiquitin protein ligase,E3)的連續作用下,泛素被連接到目標蛋白上,標記蛋白進入蛋白酶體降解或改變蛋白的活性。泛素化是可逆的,去泛素化酶(Deubiquitinating enzyme,DUB)對泛素化進行負向調節。泛素、E1、E2、E3和蛋白酶體、DUB構成了泛素-蛋白酶體系統(Ubiquitin-proteasome system,UPS)[1]。UPS對底物作用的特異性主要由泛素修飾類型、E3和DUB決定。
首先,泛素是一個由76個氨基酸殘基組成的高度保守的多肽,含有不同位點的七個賴氨酸殘基(Lysine,K)—K6、K11、K27、K29、K33、K48、K63。在酶的催化下,泛素的C端最終與靶蛋白的K的ε-N端形成異肽鍵,少數情況下,底物的絲氨酸、蘇氨酸和半胱氨酸殘基也是泛素結合位點。蛋白的泛素化連接可以是單個泛素或聚泛素鏈(即泛素持續加入與原有泛素的K形成異肽鍵),前者稱為單泛素化,后者稱為聚泛素化。值得注意的是,原有泛素的七個K都可成為新加入泛素的連接位點,因此造成空間構象各異的聚泛素鏈,各自介導不同的功能[2]。K48聚泛素化是最常見的泛素修飾類型,通常情況下,K48聚泛素化介導靶蛋白的蛋白酶體降解。K63聚泛素化一般介導非降解功能,但是受體酪氨酸激酶的K63聚泛素化標記其進入溶酶體降解途徑。K11聚泛素化介導細胞周期蛋白的降解,單泛素化主要調控組蛋白和染色質結構改變[3]。
三種催化酶中,E3在特異識別底物中最重要,相關研究也最多。E3包括含有HECT(Homologous to the E6-associated protein C-terminus,HECT)家族、RING(Really interesting new gene,RING)家族和 U-box家族。RING家族成員最多,可以是單體、二聚體或多亞基復合物,如含有 F-box蛋白的 SCF(SKP1-Cullin1-F-Box)。E3內部含有特異識別某一類底物的結構域,如 Cbl(Casitas B-lineage lymphoma)的酪氨酸激酶結合(TKB)結構域,NEDD4的WW結構域識別上皮細胞鈉通道的PY基序,HSC70羧基末端反應蛋白(Carboxy terminus of Hsc70 interacting protein,CHIP)的TRP結構域識別HSP70、HSC70、HSP90等。E3參與調節多種細胞功能,如抑制細胞凋亡、調控細胞周期、下調酪氨酸激酶信號、參與蛋白質量控制、調節抑癌蛋白等[4]。E3還可催化自身和其他E3的泛素化,由此形成自我調節和自穩的網絡[5]。
DUB可劃分為五類:泛素特異性蛋白酶(Ubiquitin specific protease,USP)、泛素羧基端水解酶(Ubiquitin C-terminal hydrolase,UCH)、卵巢瘤蛋白酶(Ovarian tumor protease,OTU)、約瑟芬結構域蛋白酶(Machado-Josephin domain protease,MJD)、JAB1/MPN/MOV34金屬蛋白酶(JAB1/MPN/MOV34 metalloprotease,JAMM),前四類均是半胱氨酸蛋白酶。USP是DUB中最大的一類,現有研究也主要是關于USP的。DUB可去除泛素化蛋白和泛素化E3的泛素修飾,與E3共同調節細胞內的泛素化平衡。研究表明DUB在NF-κB及TGF-β信號通路、膜受體內吞循環、轉錄調控和DNA修復中起到十分重要的作用[6]。
既往研究證明UPS參與惡性腫瘤、炎癥性疾病、神經退行性變如帕金森病、心血管疾病的發病。下面,我們將著重介紹UPS在T細胞免疫和哮喘發病中的研究進展。
2 泛素-蛋白酶體系統與T細胞的關系(見表1)
2.1 CD4+T細胞活化 E3 Cbl、腫瘤壞死因子受體相關因子 6(TNF receptor-associated factor 6,TRAF6)均可負向調節 T細胞活化。Chang等[7]發現E3 Peli1介導哺乳動物核因子-κB(Nuclear factorκB,NF-κB)家族成員 c-Rel的 K48泛素化和降解,負向調控T細胞活化并抑制自身免疫的發生。Cai等[8]發現E3三重基序蛋白27(Tripartite motif containing protein 27,TRIM27)通過泛素化Ⅱ類磷脂酰肌醇 3激酶(Phosphatidylinositol 3 kinase,PI3K)PI3KC2β,抑制它的激酶活性,負向調控CD4+T細胞活化。Nurieva等[9]研究表明E3 GRAIL(Gene related to anergy in lymphocytes)介導T細胞活化后期內吞CD3的泛素化降解并抑制活化T細胞核因子(Nuclear factor of activated T cells,NFAT)家族成員NFATc1的表達,從而限制T細胞過度活化。
2.2 Th1細胞 Cui等[10]發現黃連素可誘導非肥胖型糖尿病小鼠的1型輔助性T細胞(helper T lymphocyte 1,Th1)轉錄因子STAT4的泛素化降解,進而影響Th1的分化。Kriegel等[11]發現在E3 GRAIL缺陷小鼠體內,Th1細胞因子IFN-γ分泌增加,胞外調節蛋白激酶1/2(Extracellular regulated protein kinase 1/2,ERK1/2)的蛋白水平和磷酸化水平上升,ERK可能是GRAIL的調節靶點。
2.3 Th2 細胞 Swaidani等[12]發現 E3 Act1 可通過共有的SEFIR(Similar expression to FGF genes and IL-17R)結構域與IL-25受體相互作用,參與IL-25誘導的Th2免疫反應和氣道過敏反應。IL-33可誘導Th2細胞反應并介導肺部炎癥。Funakoshi-Tago等[13]發現E3 TRAF6是IL-33受體ST2L與下游信號分子間的銜接蛋白,失去泛素連接酶活性的TRAF6導致 IL-33誘導 p38、JNK和 IκB磷酸化受阻。Zhao等[14]發現 E3 FBXL19介導 IL-33受體ST2L的泛素化降解,緩解IL-33誘導的肺部炎癥。
2.4 Th17細胞 Espinosa等[15]發現 E3 Ro52可介導干擾素調節因子(Interferon regulatory factor,IRF)家族成員的泛素化,負向調節Th17細胞因子的生成。Nurieva等[9]研究表明E3 GRAIL抑制調節性T細胞(regulatory T cell,Treg)中 IL-17、IL-21、ROR γ編碼基因的表達,維持Treg的免疫抑制功能。
2.5 Foxp3 和 Treg細胞 Venuprasad 等[16]也發現E3 Itch使轉化生長因子-β誘導早期基因1(Transforming growth factor-β-inducible early gene 1,TIEG1)泛素化,促進TIEG1與Foxp3基因啟動子的相互作用,增強Foxp3基因轉錄。Chang等[17]發現特異性剔除Treg中的E2 Ubc13后,Treg的免疫抑制功能下降且促使Treg向Th1和Th17轉化,可能是由于Ubc13促進 IκB激酶(InhibitoryκB kinase,IKK)的泛素化降解并激活NF-κB,激活IL-10基因和細胞因子信號抑制物1(Supressor of cytokine signaling 1,SOCS1)基因的轉錄。
2.6 CD8+T 細胞 Hansen等[18]發現在 CD3γ 鏈的雙亮氨酸基序變異的小鼠體內,E3 c-Cbl大量激活,引起鳥苷酸交換因子Vav1的泛素化降解,導致溶細胞顆粒物質胞吐受限,CD8+T細胞的細胞殺傷作用減弱。Hosoi等[19]發現與編碼腫瘤相關抗原(tumor-associated antigens,TAAs)的 mRNA 相比,編碼泛素化TAAs的mRNA可增強TAAs的胞內降解和抗原提呈,加強TAA特異性CD8+T細胞的擴增。
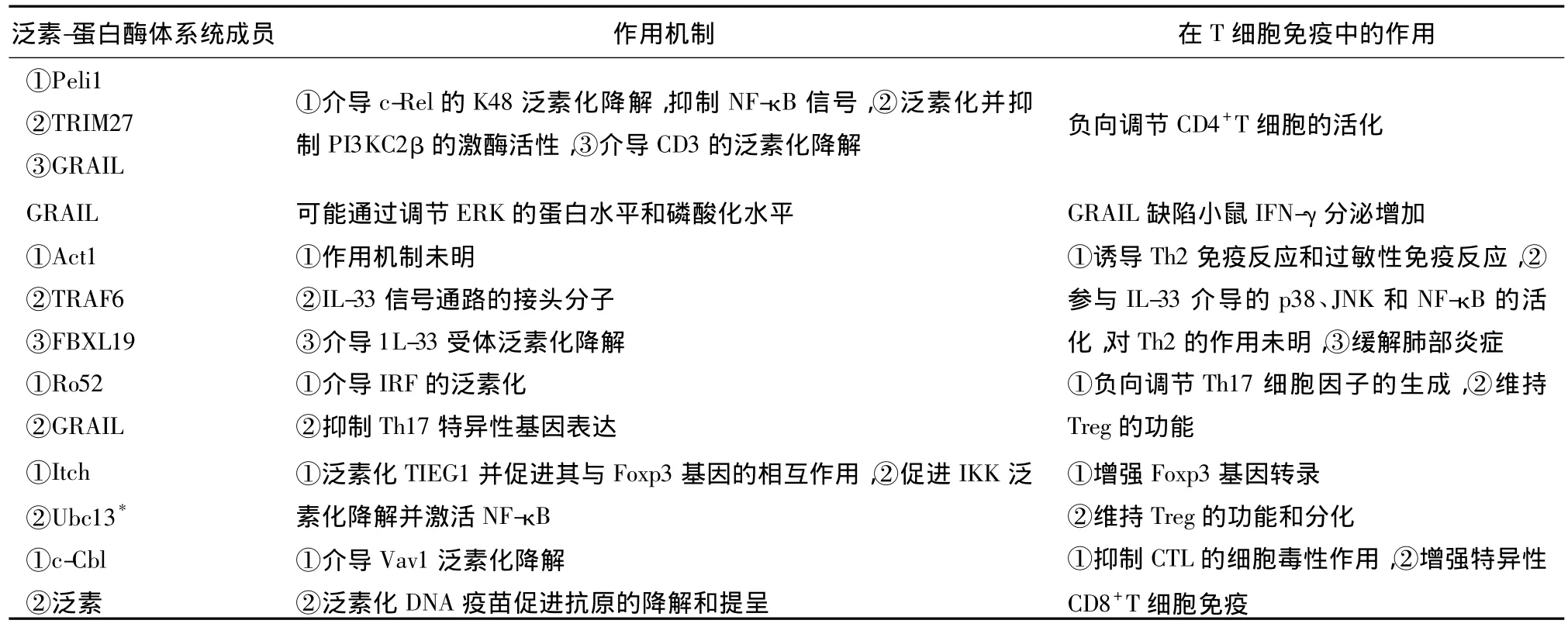
表1 泛素-蛋白酶體系統在T細胞免疫中的作用及其機制Tab.1 The effect and mechnism of the ubiquitin-proteasome system in T cell immunity
3 泛素-蛋白酶體系統在哮喘發病機制中的作用(見表2)
3.1 過敏性哮喘 少數易感人群在接觸過敏原后發生過敏或哮喘反應。Srivastava等[20]發現 E3 TRIM27負向調節肥大細胞的FcεRⅠ活化及其介導的過敏反應。Oh等[21]發現與野生型小鼠相比,Cblb缺陷小鼠受過敏原激發后,氣道和肺組織的中性粒細胞、嗜酸性粒細胞浸潤和黏膜增生更加嚴重,表現出Th1/Th2混合型免疫反應,但是Treg亞群無明顯改變。Li等[22]發現在卵清蛋白致敏和激發的小鼠模型中,E3 Arkadia通過介導轉化生長因子β(Transforming growth factorβ,TGF-β)信號通路負向調節因子Smad7、SnoN和Ski的泛素化降解,增強TGF-β信號轉導,促進氣道重塑。
3.2 HDAC2和激素抵抗性哮喘 糖皮質激素主要通過招募HDAC2至活化的炎癥基因發揮其抗炎作用,激素抵抗性哮喘和抽煙哮喘患者體內HDAC2顯著下降,恢復HDAC2的活性和表達水平是抑制激素抵抗和炎癥反應的重要途徑[23]。Adenuga等[24]發現巨噬細胞、肺上皮細胞接觸香煙煙霧提取物(Cigarette smoke extract,CSE)后,引起 HDAC2 的泛素化降解增加。Meja等[25]發現姜黃素和MG132均可抑制CSE誘導的HDAC2的泛素化降解。以上研究表明,抑制HDAC2的泛素化可能逆轉哮喘患者的激素抵抗。

表2 泛素-蛋白酶體系統在哮喘中的作用及其機制Tab.2 The effect and mechnism of the ubiquitinproteasome system in asthm a
3.3 RSV和兒童型哮喘 對于部分無特應性體質和家族史的兒童型哮喘患者,反復喘息發作與急性呼吸道病毒感染有關,如呼吸道合胞病毒(Respiratory syncytial virus,RSV)和腺病毒。Tan等[3]發現 RSV非結構蛋白-1(Nonstructural protein-1,NS-1)對支氣管上皮細胞組蛋白H2BD的泛素化修飾導致HOX基因(調控支氣管發育)的異常表達,有可能是RSV感染后肺發育異常和哮喘發生的機制之一。
3.3 NOD2 胞內蛋白核苷酸結合寡聚化結構域2(Nucleotide binding and oligomerization domain 2,NOD2)與胞壁酰二肽(Muramyl dipeptide,MDP)結合可后激活NF-κB,下游信號分子的泛素化是該通路活化的重要一步。E3 TRAF4、Itch和去泛素化酶A20可負向調節 NOD2信號。由于過度活化的NOD2參與過敏性疾病和哮喘的發生,因此上述E3是否參與哮喘發病值得我們關注[26]。
4 泛素-蛋白酶體系統抑制劑
Hirose等[27]發現在抗原激發前對哮喘小鼠鼻內應用IκB泛素化抑制劑GS143可抑制抗原誘導的氣道嗜酸性粒細胞浸潤、嗜酸性粒細胞趨化因子和Th2細胞因子表達。Moutzouris等[28]發現使用蛋白酶體抑制劑MG-132預處理的人類氣道平滑肌細胞受TNF-α激發后,氣道重塑抑制因子MAPK磷酸酶-1(MAPK phosphatase-1,MKP-1)泛素化降解下降,多種參與哮喘的細胞因子、趨化因子的分泌減少。但是,Wegmann等[29]運用慢性哮喘小鼠模型發現硼替佐米短期(一周)治療可降低支氣管肺泡灌洗液的嗜酸性粒細胞數,長期(六周)治療顯著降低慢性實驗性哮喘小鼠的抗OVA IgE血清滴度。但是,無論是短期還是長期治療都不能有效降低漿細胞數、抗OVA IgG1血清滴度、過敏性氣道炎癥或消除氣道高反應性。
5 總結和展望
上述研究表明E3在T細胞免疫中的重要作用,鑒于哮喘發病機制中存在的 Th1/Th2失衡、Treg/Th17失衡以及CD8+T細胞的參與,E3對T細胞調控作用對哮喘發病的影響很值得我們進一步的探討。上述研究只是關于一小部分E3對T細胞及哮喘的作用且沒有深入探究E3作用的具體分子,由于E3種類繁多、作用廣泛,研究其他E3及其特異靶蛋白有利于闡明哮喘的發病機制并做特異干預。盡管IκB泛素化抑制劑和蛋白酶體抑制劑可緩解哮喘模型小鼠的過敏性炎癥,但是效果并不顯著,極可能是其特異性不高。未來,在研究哮喘發病的關鍵信號通路和相關E3的基礎上,根據相關E3的特異底物結合域,設計出“假底物”干擾信號轉導或許可以為哮喘的治療提供啟示。
1 Kim H M,Yu Y,Cheng Y.Structure characterization of the26Sproteasome[J].Biochim Biophys Acta,2011;1809(2):67-79.
2 Kravtsova-lvantsiv Y,Ciechanover A.Non-canonical ubiquitin-based signals for proteasomal degradation[J].J Cell Sci,2012;125(Pt 3):539-548.
3 Tan Y R,Peng D,Chen CM etal.Nonstructural protein-1 of respiratory syncytial virus regulates HOX gene expression through interacting with histone[J].Mol Biol Rep,2013;40(1):675-679.
4 MetzgerM B,Hristova V A,Weissman A M.HECT and RING finger families of E3 ubiquitin ligasesata glance[J].JCell Sci,2012;125(Pt3):531-537.
5 de Bie P,Ciechanover A.Ubiquitination of E3 ligases:selfregulation of the ubiquitin system via proteolytic and non-proteolytic mechanisms[J].Cell Death Differ,2011;18(9):1393-402.
6 Clague M J,Coulson JM,Urbe S.Cellular functions of the DUBs[J].JCell Sci,2012;125(Pt2):277-286.
7 Chang M,Jin W,Chang JH et al.Peli1 negatively regulates T-cell activation and prevents autoimmunity[J].Nat Immunol,2012;12(10):1002-1009.
8 Cai X,Srivastava S,Sun Y et al.Tripartitemotif containing protein 27 negatively regulates CD4 T cells by ubiquitinating and inhibiting the class II PI3K-C2β[J].Proc Natl Acad Sci USA,2011;108(50):20072-20077.
9 Nurieva R I,Zheng S,Jin W et al.The E3 ubiquitin ligase GRAIL regulates T cell tolerance and regulatory T cell function by mediating T cell receptor-CD3 degradation[J].Immunity,2010;32(5):670-680.
10 CuiG,Qin X,Zhang Y etal.Berberine differentiallymodulates the activities of ERK,p38 MAPK,and JNK to suppress Th17 and Th1 T cell differentiation in type 1 diabetic mice[J].J Biol Chem,2009;284(41):28420-28429.
11 KriegelM A,Rathinam C,Flavell R A.E3 ubiquitin ligase GRAIL controls primary T cell activation and oral tolerance[J].Proc Natl Acad Sci USA,2009;106(39):16770-16775.
12 Swaidani S,Bulek K,Kang Z et al.T cell-derived Act1 is necessary for IL-25-mediated Th2 responses and allergic airway inflammation[J].J Immunol,2011;187(6):3155-3164.
13 Funakoshi-Tago M,Tago K,Hayakawa M etal.TRAF6 is a critical signal transducer in IL-33 signaling pathway[J].Cell Signal,2008;20(9):1679-1686.
14 Zhao J,Wei J,Mialki R K et al.F-box protein FBXL19-mediated ubiquitination and degradation of the receptor for IL-33 limits pulmonary inflammation[J].Nat Immunol,2012;13(7):651-658.
15 Espinosa A,Dardalhon V,Brauner S et al.Loss of the lupus autoantigen Ro52/Trim21 induces tissue inflammation and systemic autoimmunity by disregulating the IL-23-Th17 pathway[J].J Exp Med,2009;206(8):1661-1671.
16 Venuprasad K,Huang H,Harada Y et al.The E3 ubiquitin ligase Itch regulates expression of transcription factor Foxp3 and airway inflammation by enhancing the function of transcription factor TIEG1[J].Nat Immuol,2008;9(3):245-253.
17 Chang JH,Xiao Y,Hu H et al.Ubc13 maintains the suppressive function of regulatory T cellsand prevents their conversion into effector-like T cells[J].Nat Immunol,2012;13(5):481-490.
18 Hansen A K,Regner M,Bonefeld CM et al.TCR down-regulation boosts T-cell-mediated cytotoxicity and protection against poxvirus infections[J].Eur J Immunol,2011;41(7):1948-1957.
19 Hosoi A,Takeda Y,Sakuta K et al.Dendritic cell vaccine with mRNA targeted to the proteasome by polyubiquitination[J].Biochem Biophys Res Commun,2008;371(2):242-246.
20 Srivastava S,Cai X,Li Z et al.Phosphatidylinositol-3-kinase C2beta and TRIM27 function to positively and negatively regulate IgE receptor activation ofmast cells[J].Mol Cell Biol,2012;32(15):3132-3139.
21 Oh SY,Park JU,Zheng T et al.Cbl-b regulates airway mucosal tolerance to aeroallergen[J].Clin Exp Allergy,2011;41(3):434-442.
22 Li X Z,Feng JT,Hu C P et al.Effects of Arkadia on airway remodeling through enhancing TGF-beta signaling in allergic rats[J].Lab Invest,2010;90(7):997-1003.
23 Barnes P J.Targeting the epigenome in the treatment of asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2009;6(8):693-696.
24 Adenuga D,Yao H,March T H et al.Histone deacetylase 2 is phosphorylated,ubiquitinated,and degraded by cigarette smoke[J].Am JRespir Cell Mol Biol,2009;40(4):464-473.
25 Meja K K,Rajendrasozhan S,Adenuga S etal.Curcumin restores corticosteroid function in monocytes exposed to oxidants by maintaining HDAC2[J].Am JRespir Cell Mol Biol,2008;39(3):312-323.
26 Tigno-Aranjuez J T, Abbott D W. Ubiquitination and phosphorylation in the regulation of NOD2 signaling and NOD2-mediated disease[J].Biochim Biophys Acta,2012;1823(11):2022-2028.
27 Hirose K,Wakashin H,OkiM et al.GS143,an IkappaB ubiquitination inhibitor,inhibits allergic airway inflammation in mice[J].Biochem Biophys Res Commun,2008;374(3):507-511.
28 Moutzouris JP,Che W,Ransay E E et al.Proteasomal inhibition upregulates the endogenous MAPK deactivator MKP-1 in human airway smooth muscle:mechanism of action and effect on cytokine secretion[J].Biochim Biophys Acta,2010;1803(3):416-423.
29 Wegmann M,Lunding L,Orinska Z et al.Long-Term Bortezomib Treatment Reduces Allergen-Specific IgE but Fails to Ameliorate Chronic Asthma in Mice[J].Int Arch Allergy Immunol,2012;158(1):43-53.