丙戊酸鈉薄膜衣片的制備及穩定性研究
胡崇茂 陳佩英 胡曉曉 高 磊
(北京英茂藥業有限公司,北京 101407)
丙戊酸鈉薄膜衣片的制備及穩定性研究
胡崇茂 陳佩英 胡曉曉 高 磊
(北京英茂藥業有限公司,北京 101407)
目的 研究丙戊酸鈉薄膜衣片的制備方法。方法 分別用全水型和醇溶型薄膜包衣預混劑對該素片進行包衣,與該品種同規格糖衣片同時進行穩定性考察比較。結果 用全水型和醇溶型薄膜包衣預混劑對該產品素片進行包衣后,當增重達到(3.5±0.3)%時,本品6個月時的水分含量分別為6.3%、6.6%,糖衣片為8.9%,其他項目比糖衣片也顯出一定的優勢,且均符合規定。結論 按該工藝生產的丙戊酸鈉薄膜衣片符合質量標準要求,工藝穩定可靠,適合大生產需要。
丙戊酸鈉片;薄膜衣;制備;穩定性
為提高丙戊酸鈉片的抗吸濕性能和掩蓋其不良味道,同時考慮到其糖衣片的局限性和薄膜包衣的優勢[2],我們在實驗中將該片改成薄膜衣片。丙茂酸鈉片是中國藥典2010年二部中收載的化學藥片劑[1],屬于抗癲癇藥類別,為糖衣片。規格為0.1g和0.2g。丙戊酸鈉原料為白色結晶性粉末或顆粒;味微澀;有強吸濕性,在水中極易溶解,在甲醇或乙醇中易溶,在丙酮中幾乎不溶。實驗表明,將丙戊酸鈉糖衣片改成薄膜衣片是可行的,適用于大生產操作,而且能達到防吸濕、掩味等效果。
試驗中分別采用全水型薄膜包衣預混劑和醇溶型薄膜包衣預混劑,用量為素片重量的3%~4%(W/W)。分別用純化水和80%乙醇(W/W)作溶劑配成固含量為13%(W/V)的包衣液。
1 儀器與試藥
962型色差儀(美國愛色麗);JM-180型膠體磨(鄭州玉祥機械設備有限公司);YD-1片劑硬度測試儀(天津市富蘭斯電子科貿有限公司);CSD-1型脆碎度測試儀(天津市富蘭斯電子科貿有限公司);BG-10型高效包衣機(南京天塔機械設備有限公司);BJ-ZN崩解時限儀(天津市富蘭斯電子科貿有限公司);WD-A藥物穩定性檢查儀(天津市富蘭斯電子科貿有限公司);SH10A型水分快速測定儀(上海精密科學儀器有限公司);101-3ASB電熱恒溫干燥箱(北京科偉永興儀器有限公司);FA1104N電子天平(上海精密科學儀器有限公司)。
全水型薄膜包衣預混劑(北京英茂藥業有限公司生產,批號121035);醇溶型薄膜包衣預混劑(北京英茂藥業有限公司生產,批號121019);丙戊酸鈉素片和其糖衣片(W藥業有限公司按中國藥典2010年版二部生產提供,批號為121015)。
2 方法與結果
2.1 素片的制備及其質量
取粉碎過100目的原料,加入預膠化淀粉、微晶纖維素等輔料,用沸騰制料法制粒,控制顆粒水分為3.5%~5.5%,整粒,加入硬脂酸鎂、二氧化硅、滑石粉適量,混勻,檢驗,合格后壓成1000片。
經檢驗:本批素片呈淺弧型,表面平整光潔,平均片重0.21g,硬度6.3kg,脆碎度0.10%,符合薄膜包衣操作對所包素片的基本要求。
2.2 薄膜包衣操作工藝方法
2.2.1 薄膜包衣液的制備
2.2.1.1 全水型包衣液的配制
各物料用量計算:按每鍋投入素片量7kg、增重3.2%、固含量14%計算,需薄膜包衣預混劑干粉為0.224kg,純化水1.376kg。
配制:稱取計算量的純化水,置于配料罐內,開啟攪拌,將稱好的薄膜包衣預混劑干粉緩緩加到溶劑旋渦上,并在3~5min內加完,攪拌45min后,在膠體磨中將包衣液進行勻化,再轉移進配料罐內,繼續慢速攪拌,待用。即得全水型包衣液。
2.2.1.2 醇溶型包衣液的配制
各物料用量計算:按每鍋投入素片量7kg、增重3.8%、固含量16%計算,需薄膜包衣預混劑干粉為0.266kg,85%(W/W)濃度的乙醇溶液1.3965kg。
配制:稱取95%(W/W)濃度的乙醇溶液1.2495kg,置配料罐內,再加入純化水0.147kg,攪勻,配成85%(W/W)濃度的乙醇溶液,作為溶劑。開啟攪拌槳,按上述操作即得。
2.2.2 包衣操作方法與過程
2.2.2.1 全水型包衣
將制備的符合薄膜包衣要求的素片7kg投入高效包衣機內,調節噴槍,使噴槍霧柱中心線垂直于片床,霧距為22~28cm,鍋轉速2~3r/ min,先對素片進行預熱,待片床溫度達到30~40℃時,開啟噴霧,控制流量40g/min,出風溫度55~60℃、鍋轉速7r/min、噴槍霧化壓力0.40~0.60MPa,注意保持噴霧與干燥處于動態平衡狀態,防止粘片、噴霧干燥現象發生,40min后包衣液噴完。
2.2.2.2 醇溶型包衣
將制備的符合薄膜包衣要求的素片7kg投入高效包衣機內,調節噴槍,使噴槍霧柱中心線垂直于片床,霧距為22~28cm,鍋轉速2~3r/ min,先對素片進行預熱,待片床溫度達到30~40℃時,開啟噴霧,控制流量42g/min,出風溫度55~60℃、鍋轉速6r/min、噴槍霧化壓力0.40~0.60MPa,注意保持噴霧與干燥處于動態平衡狀態,防止粘片、噴霧干燥現象發生,40min后包衣液噴完。
2.2.3 兩種薄膜衣片的質量情況
對上述兩種片子進行包衣增重檢測和外觀質量檢查,結果:全水型包衣片增重為3.1%,醇溶型包衣片增重為3.6%;全水型薄膜包衣片的表面色澤均勻、光潔細膩,衣層牢固致密,無開裂、掉皮、雜色點等缺陷,硬度7.1kg;醇溶性薄膜包衣片的表面略顯粗糙,其他均與前者相似。
2.3 兩種薄膜衣片的穩定性試驗
2.3.1 穩定性試驗方法
參照中國藥典2010年版二部中關于穩定性試驗的相關內容[3],模擬市售包裝,分別將兩種薄膜衣片用鋁塑泡罩包裝成鋁塑板,置藥物穩定性檢查儀內,按加速試驗要求,在溫度40℃±2℃,相對濕度75% ±5%條件下放置6個月。分別于0、1、2、3、6個月取樣,按穩定性重點考察項目檢驗,水分測定方法見中國藥典2010年版一部附錄Ⅸ H第二法[4]。結果如下表所示。
2.3.2 實驗結果
見表1~3。
表1 丙戊酸鈉片(全水型包衣液)加速試驗結果表[(),n=3]
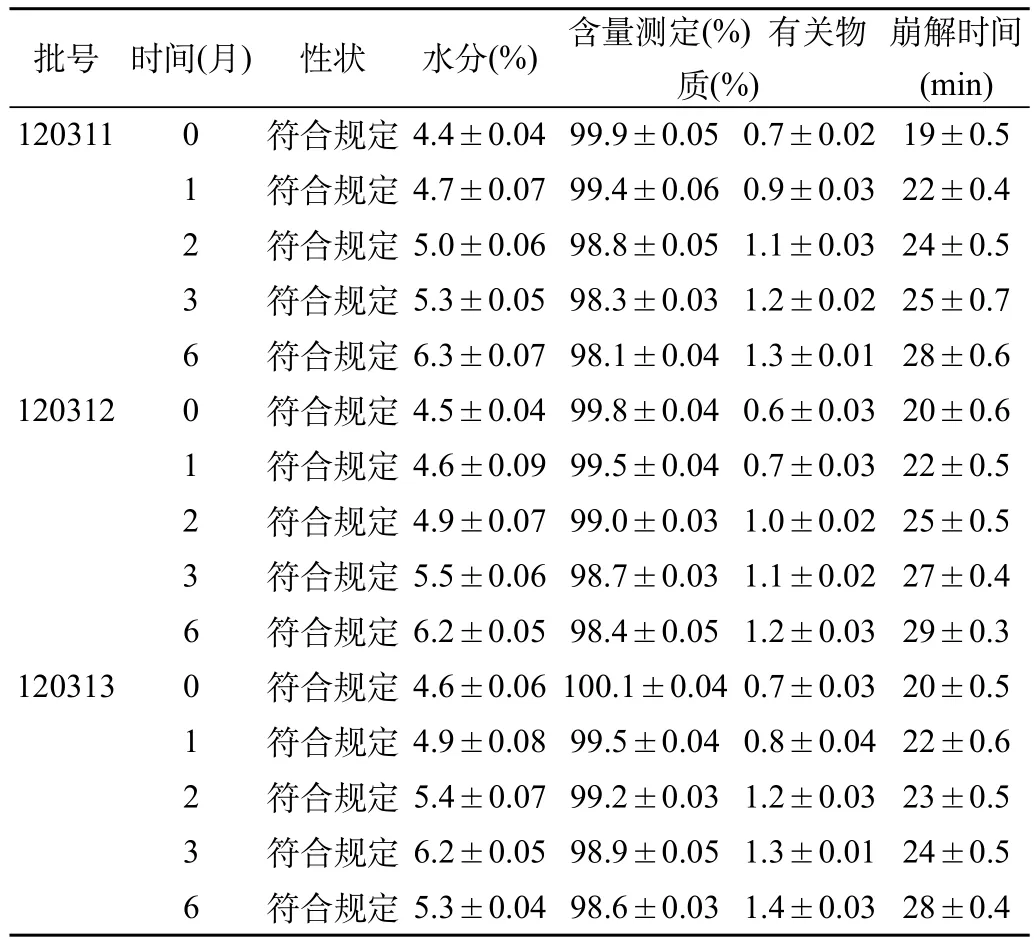
表1 丙戊酸鈉片(全水型包衣液)加速試驗結果表[(),n=3]
崩解時間(min) 1203110符合規定4.4±0.0499.9±0.050.7±0.0219±0.5 1符合規定4.7±0.0799.4±0.060.9±0.0322±0.4 2符合規定5.0±0.0698.8±0.051.1±0.0324±0.5 3符合規定5.3±0.0598.3±0.031.2±0.0225±0.7 6符合規定6.3±0.0798.1±0.041.3±0.0128±0.6 1203120符合規定4.5±0.0499.8±0.040.6±0.0320±0.6 1符合規定4.6±0.0999.5±0.040.7±0.0322±0.5 2符合規定4.9±0.0799.0±0.031.0±0.0225±0.5 3符合規定5.5±0.0698.7±0.031.1±0.0227±0.4 6符合規定6.2±0.0598.4±0.051.2±0.0329±0.3 1203130符合規定4.6±0.06100.1±0.040.7±0.0320±0.5 1符合規定4.9±0.0899.5±0.040.8±0.0422±0.6 2符合規定5.4±0.0799.2±0.031.2±0.0323±0.5 3符合規定6.2±0.0598.9±0.051.3±0.0124±0.5 6符合規定5.3±0.0498.6±0.031.4±0.0328±0.4批號時間(月)性狀水分(%)含量測定(%) 有關物質(%)
表2 丙戊酸鈉片(醇溶性包衣液)加速試驗結果表[(),n=3]
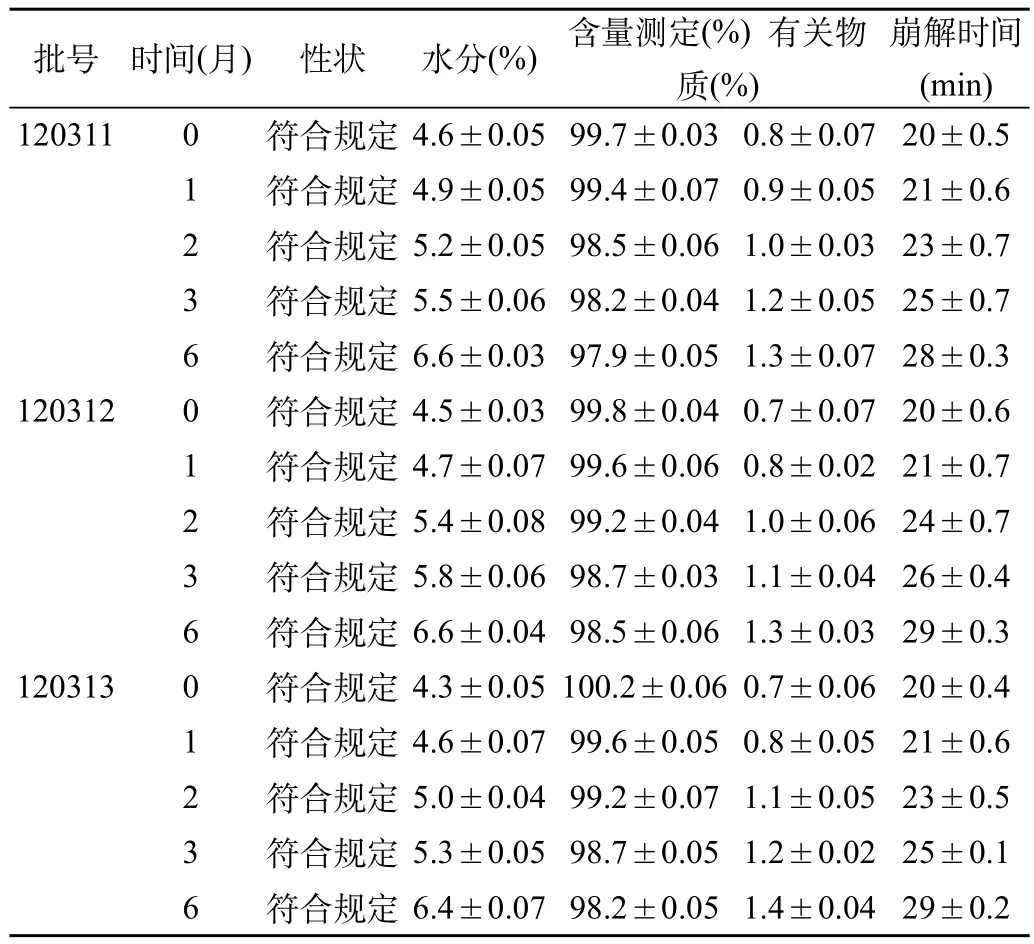
表2 丙戊酸鈉片(醇溶性包衣液)加速試驗結果表[(),n=3]
崩解時間(min) 1203110符合規定4.6±0.0599.7±0.030.8±0.0720±0.5 1符合規定4.9±0.0599.4±0.070.9±0.0521±0.6 2符合規定5.2±0.0598.5±0.061.0±0.0323±0.7 3符合規定5.5±0.0698.2±0.041.2±0.0525±0.7 6符合規定6.6±0.0397.9±0.051.3±0.0728±0.3 1203120符合規定4.5±0.0399.8±0.040.7±0.0720±0.6 1符合規定4.7±0.0799.6±0.060.8±0.0221±0.7 2符合規定5.4±0.0899.2±0.041.0±0.0624±0.7 3符合規定5.8±0.0698.7±0.031.1±0.0426±0.4 6符合規定6.6±0.0498.5±0.061.3±0.0329±0.3 1203130符合規定4.3±0.05100.2±0.060.7±0.0620±0.4 1符合規定4.6±0.0799.6±0.050.8±0.0521±0.6 2符合規定5.0±0.0499.2±0.071.1±0.0523±0.5 3符合規定5.3±0.0598.7±0.051.2±0.0225±0.1 6符合規定6.4±0.0798.2±0.051.4±0.0429±0.2批號時間(月)性狀水分(%)含量測定(%) 有關物質(%)
表3 丙戊酸鈉片(糖衣片)加速試驗結果表[(),n=3]
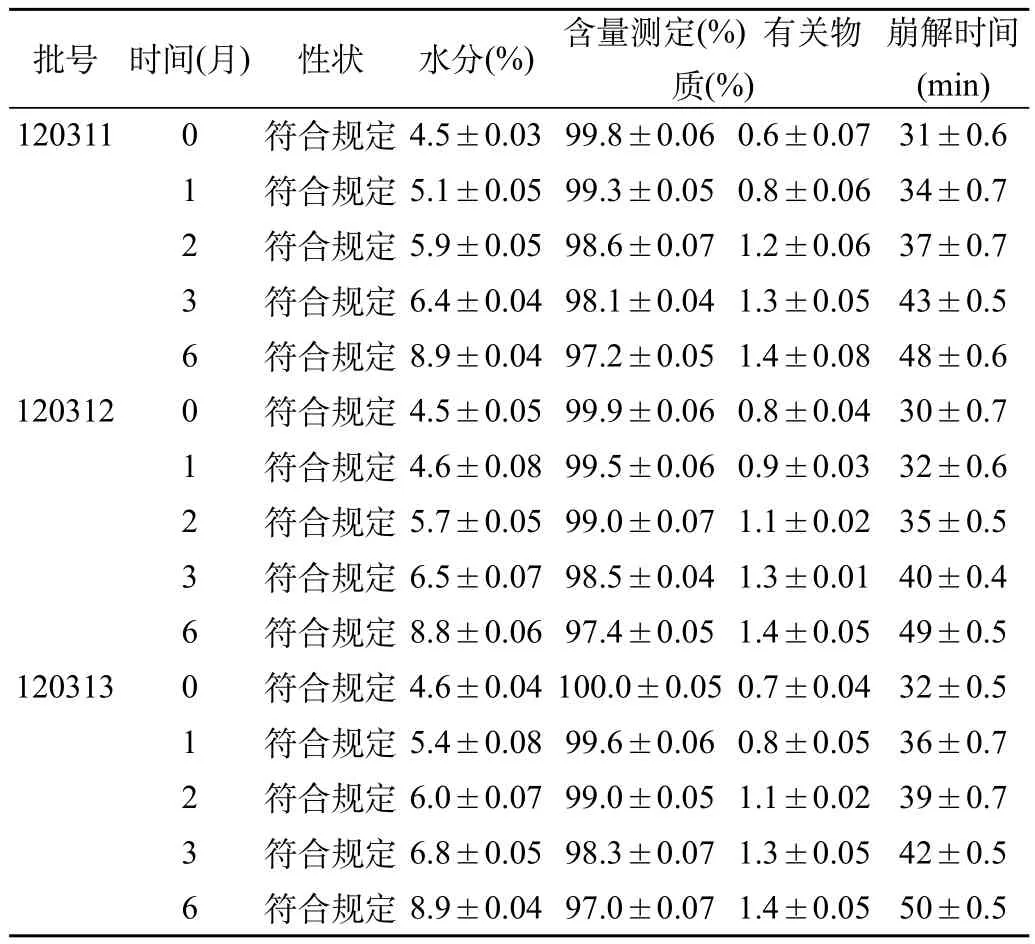
表3 丙戊酸鈉片(糖衣片)加速試驗結果表[(),n=3]
崩解時間(min) 1203110符合規定4.5±0.0399.8±0.060.6±0.0731±0.6 1符合規定5.1±0.0599.3±0.050.8±0.0634±0.7 2符合規定5.9±0.0598.6±0.071.2±0.0637±0.7 3符合規定6.4±0.0498.1±0.041.3±0.0543±0.5 6符合規定8.9±0.0497.2±0.051.4±0.0848±0.6 1203120符合規定4.5±0.0599.9±0.060.8±0.0430±0.7 1符合規定4.6±0.0899.5±0.060.9±0.0332±0.6 2符合規定5.7±0.0599.0±0.071.1±0.0235±0.5 3符合規定6.5±0.0798.5±0.041.3±0.0140±0.4 6符合規定8.8±0.0697.4±0.051.4±0.0549±0.5 1203130符合規定4.6±0.04100.0±0.050.7±0.0432±0.5 1符合規定5.4±0.0899.6±0.060.8±0.0536±0.7 2符合規定6.0±0.0799.0±0.051.1±0.0239±0.7 3符合規定6.8±0.0598.3±0.071.3±0.0542±0.5 6符合規定8.9±0.0497.0±0.071.4±0.0550±0.5批號時間(月)性狀水分(%)含量測定(%) 有關物質(%)
3 討 論
3.1 糖衣片加速6個月時,性狀項雖然也符合規定,但片子表面與0d相比,明顯發暗,并失去光澤,可能是因為吸濕等原因而引起。
3.2 通過對三種藥片穩定性試驗對比研究表明,北京英茂藥業研制的全水型薄膜包衣預混劑和醇溶型薄膜包衣預混劑完全可以替代糖包衣,對丙戊酸鈉片進行薄膜包衣顯示出較多的優越性;全水型薄膜包衣預混劑以水為溶劑雖然價格便宜,操作安全,不需防爆,但本品吸濕性強,且主藥成分易溶于水,包衣時要保證足夠的干燥溫度和空氣量,采用較低的噴霧速度,水性系統中盡可能增大固體含量至12%(W/W)以上,以降低含水量[5]。
3.3 薄膜包衣對素片的質量要求:能否對某種素片進行薄膜包衣,以及包衣后片子的質量,在很大程度上依賴于素片質量。因此薄膜包衣預混劑的配方一般是按照素片特性和質量狀況“量身定做”的。合適的外形是薄膜包衣所必需的,如淺弧型素片不存在容易脫落的鋒利的邊角,在包衣過程中不會磨損,翻滾均勻,能保持良好的包衣效果;此外,對化學藥片劑來說,硬度一般宜在4~10kg/mm2、脆碎度宜不超過0.8%。
[1] 國家藥典委員會.中華人民共和國藥典(二部)[M].北京:化學工業出版社,2010:92.
[2] 龐鳳華,鄭捷,熊志玲.水性薄膜包衣技術在骨仙片生產的工藝研究[J].國際醫藥衛生導報,2005,11(4):86-88.
[3] 國家藥典委員會.中華人民共和國藥典(二部)[M].北京:化學工業出版社,2010:附錄200.
[4] 國家藥典委員會.中華人民共和國藥典(一部)[M].北京:化學工業出版社,2010:附錄52.
[5] 鄭俊民.片劑包衣的工藝和原理[M].北京:中國醫藥科技出版社,2000:402.
Study on the Stability of Sodium Valproate and Film Preparation
HU Chong-mao, CHEN Pei-ying, HU Xiao-xiao, GAO Lei
(Beijing Yingmao Pharmaceutical Company Limited, Beijing 101407, China)
Objective Study on Preparation of sodium valproate film-coated tablets. Methods With full water and alcohol soluble film coating premix is coated on the core, and the varieties of the same specifications sugar-coated tablets and stability comparison. Results With the water and alcohol soluble film coating premix is coated on the tablet core, when the weight reached 3.5%±0.3%, the moisture content of the product at 6 months were 6.3%, 6.6%, sugar-coated tablets for 8.9%, other than sugar coated tablets also shows some advantages, which are in line with the provisions. Conclusions According to valproate film-coated tablets produced by this technology to meet the required quality standards, the technology is stable and reliable, and suitable for the industrial production needs.
Sodium valproate tablets; Thin film; Preparation; Stability
R94
B
1671-8194(2013)26-0065-03

