中藥I號方對阿爾茲海默病的多靶位治療作用
梁 良,劉 羽,曹子青,楊亞軍,朱 華,黃 瀾,盛樹力,秦 川,鄧 巍
(1.北京協和醫學院 中國醫學科學院醫學實驗動物研究所病理室,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021;2.山西省曲沃縣西街本草中藥研究所,山西 曲沃 043400)
阿爾茲海默病由 Alois Alzheimer在1906年首先報道[1],它是老年人中最常見的癡呆類型,是一種與年齡相關的神經退行性疾病,是發達國家引起老年人死亡的重要原因之一[2],其病理表現有細胞外老年斑沉積,細胞內神經纖維纏結、突觸丟失、神經元炎癥和神經元凋亡[3]。臨床表現主要為認知下降和記憶損傷[4]。關于阿爾茲海默病的發病機制雖有很多假說,如淀粉樣蛋白級聯假說、Tau蛋白假說和膽堿能假說等,但發病機制仍不是很清楚。
目前還沒有能夠減慢或者停止阿爾茲海默病進展的藥物,美國FDA批準的5種藥物只能暫時緩解癥狀而且在病人中效果也不一致[5]。現在對阿爾茲海默病的治療研究有抗淀粉樣蛋白和神經元保護方法[6]。
本實驗室以前的研究發現,中藥I號方(PN-1)顯著提高給藥模型鼠的空間記憶力;能夠減少給藥模型鼠腦內老年斑沉積并能夠降低腦內Aβ水平,提高突觸可塑性相關分子的表達水平[7]。中藥復方成分復雜,很有可能有若干個活性成分,通過多靶位起治療作用,而現在臨床上應用的藥物只有一個作用靶點,多靶位治療有可能比單靶位療效更好。本實驗利用KinexTMAntibody Microarray這種高通量抗體芯片技術,篩選出給藥組與空白組模型鼠的差異表達蛋白,然后利用 Ingenuity Pathway Analysis(IPA)這種生物信息學方法并結合文獻,從中找到與阿爾茲海默病相關的蛋白,揭示中藥的多靶位治療作用,為阿爾茲海默病的治療提供新的有效藥物。
1 材料與方法
1.1 中藥
中藥I號方由35味中藥組成,其粉劑用蒸餾水煮沸30 min,3次,將上清液合并調整至生藥濃度為1 g/mL,用時稀釋至0.1 g/mL。本實驗中的給藥濃度均折合生藥質量進行計算。
1.2 實驗動物
實驗中所用到的阿爾茲海默病小鼠模型為APP/PS1雙轉基因模型,是我所自己構建的,模型以C57BL/6J小鼠為背景,為含有人APP瑞典突變和人PS1敲除了第九個外顯子而造成突變的雙轉基因小鼠。實驗在中國醫學科學院醫學實驗動物研究所病理室進行【SYSK(京)2011-0022】。
1.3 分組及給藥
SPF級3月齡的APP/PS1雙轉基因小鼠,分為給藥模型組和空白對照組,其中給藥模型組為8只,雄性,每天灌胃給予2.4 g/kg中藥水提物,相當于臨床用藥的36倍;空白對照組4只,雄性,給予等體積雙蒸水灌胃。給藥時間持續3個月。
1.4 腦蛋白提取及KinexTMAntibody Microarray分析
給藥結束后每組隨機取出三只分離出海馬后按下面過程提取蛋白:
1)每250 mg濕重的切碎的組織使用1 mL蛋白裂解液(北京博肽健諾威生物技術有限公司提供);
2)用冰冷PBS沖洗組織3次以去除血污染物;
3)勻漿機冰上搗碎組織,每次15 s,搗碎3次;
4)用超聲波探針粉碎核 DNA,粉碎次,每次10 s,每兩次之間隔 10~15 s,在此過程中,樣品須始終保留于冰上;
5)用臺式離心機上的最高速度 (14,000 r/min),4℃離心樣品,30 min;
6)將上清液部分轉移到1.5 mL離心管;
8)使用BCA法測定樣品蛋白濃度,分裝至少100 μg 用于分析;
然后利用 KinexTMAntibody Microarray(北京博肽健諾威生物技術有限公司提供)分析差異表達蛋白,這種高通量抗體芯片技術能夠方便有效的幫助研究者發現有意義的結果,能夠分析蛋白表達、蛋白間的相互作用和蛋白的磷酸化。
1.5 利用Ingenuity Pathway Analysis(IPA)分析與阿爾茲海默病相關的蛋白分子
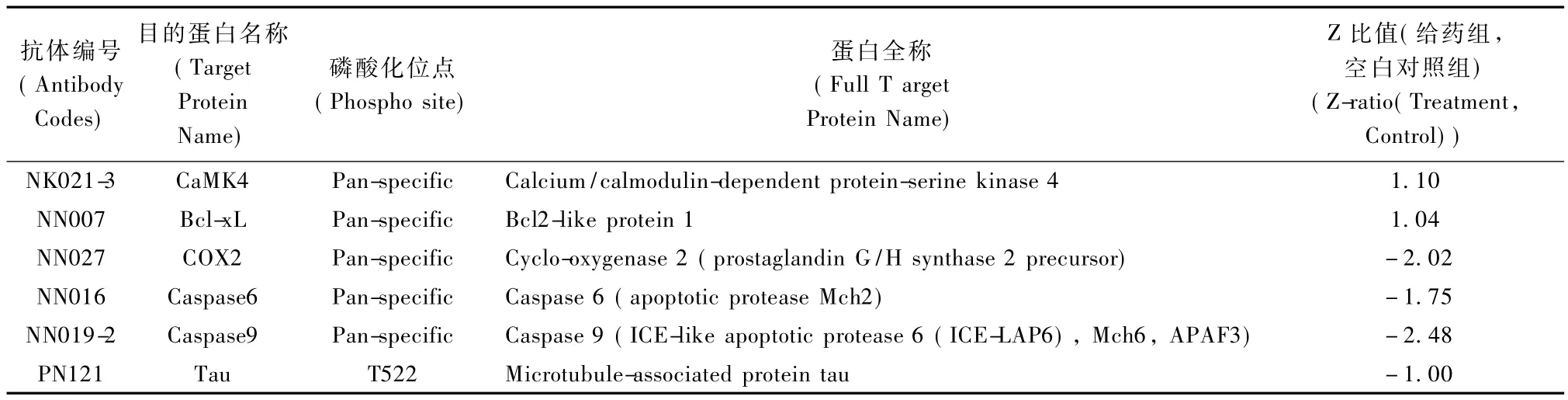
表1 阿爾茲海默病相關蛋白Tab.1 Proteins associated with Alzheimer’s disease
IPA是一種基于網頁的分析軟件。它能幫助研究者從多水平了解生物體,分析來自各種平臺的數據,使研究者深入理解分子和化學物質間的相互關系、細胞表型和疾病過程。將來自 KinexTMAntibody Microarray分析的數據結果提交給IPA,并結合查閱文獻,分析與阿爾茲海默病相關的分子。
2 結果
將KinexTMAntibody Microarray分析后的結果,用Ingenuity Pathway Analysis(IPA)并結合文獻分析后,得到與阿爾茲海默病相關的蛋白見表1。
3 討論
阿爾茲海默病是老年人中最常見的癡呆類型,到目前為止仍然沒有有效的治療方法,最終導致病人的死亡。在美國,阿爾茲海默病是引起死亡的第六大原因,在65歲以上老年人的死亡原因中居于第五位。隨著人口的老齡化,美國的統計數據表明,到2050年,65歲以上的人口中患有阿爾茲海默病的人將達到11000000~16000000。給家庭和個人帶來了巨大的經濟和精神壓力。
到目前為止對阿爾茲海默病的治療美國FDA共批準了5種藥物,其中膽堿酯酶抑制劑類有四種tacrine,donepezil, rivastigmine 和 galantamine;NMDA受體拮抗劑有 Memantine[8]。但是這5種藥物均不能延緩或者是停止疾病的進展,而且在病人中的效果也不一致[5]。除了以上5種 FDA批準的藥物之外還有正在研究中的抗淀粉樣蛋白方法、他丁類、抗炎類以及Caspase抑制劑類等多種藥物[6]。可見現在臨床上應用的以及正在研究的藥物都是針對阿爾茲海默病的一個靶點而設計的。這可能正是現有藥物效果不好的原因,本中藥復方由35味中藥組成,成分復雜,運用 KinexTMAntibody Microarray這種新技術發現這種中藥復方能夠抑制神經元凋亡、抑制炎癥、抑制 tau蛋白的過度磷酸化,提高記憶力。
中藥I號方(PN-1)具有抗tau蛋白過度磷酸化的作用。在給藥組,Tau蛋白T522磷酸化水平低于空白對照組。阿爾茲海默病病人腦Tau蛋白的磷酸化水平是正常人腦中的3~4倍,這些高度磷酸化的tau表現出了神經元毒性,不僅不能跟微管蛋白結合,也不能促進微管的組裝,反而抑制微管的組裝并破壞微管,在3×Tg阿爾茲海默病模型鼠中,同時減少可溶性淀粉樣蛋白和可溶性高磷酸化的tau能改善模型鼠的記憶力[9]。這表明降低 Tau蛋白的高度磷酸化可能為阿爾茲海默病的一個治療靶點。PN-1能抑制Tau蛋白的高度磷酸水平來改善阿爾茲海默病模型小鼠的病理生理學表現。
中藥I號方(PN-1)具有抗炎作用。在給藥組,COX2低于空白對照組。在阿爾茲海默病病人的腦中,炎癥瀑布升高,如激活小膠質細胞、促炎因子、急性期蛋白和補體蛋白,研究表明阿爾茲海默病病人腦中 COX2的水平是升高的[10]。在腦中,COX2是一種促炎因子[11]。動物實驗表明抑制 COX2能提高小鼠的記憶力[12]。這表明PN-1可以通過抑制炎癥反應來改善阿爾茲海默病模型小鼠的病理生理學表現。
中藥I號方(PN-1)具有抑制細胞凋亡的作用。在給藥組Caspase6和Caspase9低于空白對照組;而抗凋亡蛋白Bcl-xl,在給藥組高于空白對照組。阿爾茲海默病病人病理表現之一是神經元凋亡[3],神經元凋亡需要大量的caspase,到現在為止共有13類Caspase[13]。這表明 PN-1可能通過抑制細胞凋亡來改善阿爾茲海默病的病理生理學表現。
中藥 I號方(PN-1)具有提高記憶力的作用。在給藥組,CaMK4水平高于空白對照組。阿爾茲海默病病人的主要臨床表現是進行性記憶力下降。研究發現CaMK4是記憶形成的正調節因子,他水平的升高能提高老年鼠的記憶力[14]。這表明PN-1可能通過提高記憶力來改善阿爾茲海默病的病理生理學表現。
以往的實驗研究發現中藥I號方(PN-1)能夠減少給藥模型鼠腦內老年斑沉積,降低腦內Aβ水平,促進給藥模型鼠腦內突觸信號轉導蛋白水平的增加,提高給藥鼠的記憶力[7]。這表明中藥 I號方(PN-1)能通過多靶位改善阿爾茲海默病的病理生理表現,這為多靶位藥物的研發提供了基礎。
[1]Herrup,K.Reimagining Alzheimer's disease—an age-based hypothesis[J].The Journal of neuroscience,2010,30(50):16755-16762.
[2]Driscoll I,Troncoso J.Asymptomatic Alzheimer's disease:a prodrome or a state of resilience? [J].Curr Alzheimer Res,2011,8(4):330-335.
[3]MedeirosR, LaFerla FM. Astrocytes: conductors ofthe Alzheimer disease neuroinflammatory symphony [ J].Experimental neurology,2013,239:133-138.
[4]Price DL,Tanzi RE,Borchelt,DR.,et al.Alzheimer's disease:genetic studies and transgenic models[J].Annual review of genetics,1998,32:461-493.
[5]Alzheimer's Association.2012 Alzheimer's disease facts and figures[J].Alzheimer's dementia,2012,8(2):131-168.
[6]Singh S,Kushwah AS,Singh R,et al.Current therapeutic strategy in Alzheimer's disease[J].European review for medical and pharmacological sciences,201216(12):1651-1664.
[7]Zhi-Gang Yao,Ling Zhang,Liang Liang,et al.Cognitiveenhancing effects of PN-1,a traditional Chinese prescription,in anAlzheimer's disease mouse model:Investigation of possible mechanisms of action[J].Evidence-Based Complementary and Alternative Medicine,2013,Article ID 518421,12 pages.
[8]Van Marum RJ.Current and future therapy in Alzheimer's disease[J].FundamentalClinical Pharmacology,2008,22(3):265-274.
[9]Iqbal K,Liu F,Gong CX,et al.Tau in Alzheimer disease and related tauopathies[J].Current Alzheimer research,2010,7(8):656-664.
[10]Hull M,Lieb K,Fiebich,BL.Anti-inflammatory drugs:a hope for Alzheimer's disease? [J].Expert opinion on investigational drugs,2000,9(4):671-683.
[11]Minghetti L.Cyclooxygenase-2(COX-2)in inflammatory and degenerative brain diseases[J].Journal of neuropathology and experimental neurology,2004,63(9):901-910.
[12]Medeiros,R,Figueiredo CP,Pandolfo P,et al.The role of TNF-alphasignaling pathway on COX-2 upregulation and cognitive decline induced by beta-amyloid peptide[J].Behavioural brain research ,2010,209(1):165-173.
[13]Raina AK,Zhu X,Shimohama S,et al.Tipping the apoptotic balance in Alzheimer's disease:the abortosis concept[J].Cell biochemistry and biophysics,2003,39(3):249-255.
[14]Fukushima H,Maeda R,Suzui R,et al.Upregulation of calcium/calmodulin-dependent protein kinase IV improves memory formation and rescuesmemory loss with aging[J].The Journal of neuroscience,2008,28(40):9910-9919.

