熱帶淡水產油微藻的分離篩選與鑒定
郝宗娣 劉平懷 楊 勛 張 森
(海南大學熱帶作物種質資源保護與開發利用教育部重點實驗室, 海口570228)
化石燃料極大地促進了近代工業的發展, 其影響一直延續至今。然而, 化石燃料儲量有限, 并且已引發生態環境的破壞, 嚴重威脅人類的生存[1]。因此尋找可持續發展的環境友好型能源是當今社會亟待解決的問題。生物質能源具有環保和可再生性, 發展生物質能源被認為是全球能源危機的最理想途徑之一。生物柴油在能量密度、燃燒性能等方面同石化柴油相似性極高, 是石化柴油的最佳替代品。微藻是一類光合自養的低等植物, 是自然界中起源最早、分布最廣、種類和數量龐大的生物種質資源庫。在適當條件下, 很多微藻可積累大量的油脂, 其單位面積油產量可高達油料植物產量的數十倍[2]。另外微藻的生長周期短, 可使用工業廢水培養, 固定大量的 CO2, 這些優點無疑可用于解決當下溫室效應加劇、空氣及水體污染和石化能源危機等重大問題[3]。
獲得性能優越的產油能源微藻是從事基礎研究和規模化生產的關鍵, 其中微藻培養過程中生物量的積累量和油脂含量是體現產油能源微藻應用價值的兩個重要指標。一直以來, 富油藻種篩選方面的諸多研究仍然集中于一些藻種庫或實驗室保藏的現有藻種, 限制了在藻種資源方面的拓展。近年來國內外開始注重自然界中優勢顯著藻種的篩選, 如Thi,et al.[4]自泰國海域分離得到的一株微擬球藻(Nannochloropsissp.)油脂含量高達(44.8±1.7)%,Reda,et al.[5]自淡水河水體中分離出的一株斜生柵藻(Scenedesmus obliquus)的油脂含量高達(58±1.5)%。據估計,自然界中存在約 40000種微藻, 但被人類開發利用的數量不多[6]。因此, 繼續開發自然界的微藻資源, 從中篩選高產油微藻并利用其生產生物柴油, 可起到充分利用資源的作用, 具有良好的應用前景。
本研究自海南熱帶自然水體中分離出藻株, 利用一套高效的微藻篩選及產油性能評價的方法對其進行篩選,目的是獲得生長速度快、油脂產量高的藻株, 以期為微藻生物柴油的研究開發提供實驗基礎。
1 材料與方法
1.1 藻種的分離純化
野外水樣采自海口市河流、水庫、小池塘等水體, 浮游微藻采用浮游生物網拖采, 底棲微藻采用刀片輕輕刮取水體中的石塊、樹枝、腐葉等物體表面。采集到的水樣用裝有已滅菌培養基的透明塑料瓶保存, 帶回實驗室待處理。
水樣中微藻的分離純化使用平板涂布法[7]: 配制BG11液體培養基, 加入 15—20 g/L的瓊脂粉加熱融化,制作平板。吸取少量的水樣接種于固體平板上, 置于光照培養箱中培養 2—3周待藻落長出后, 用接種環挑出單藻落接種于24孔板中進行純化培養10d后鏡檢, 將純種藻株轉入試管中培養并保種[8]。
1.2 富油微藻的篩選
初篩使用尼羅紅染色法進行: 取純化后的藻液100 μL置于96孔板中, 加入50 μL的尼羅紅染液(尼羅紅-DMSO,10 μg/mL), 漩渦震蕩混合后于黑暗中孵育 10min, 利用熒光倒置顯微鏡進行觀察[3]。選出黃色熒光較強的藻株,以進行復篩。復篩時微藻的生長、產油性能的評價試驗采用φ8 cm的玻璃柱狀光生物反應器培養, 培養基選用BG11。接種密度在A6800.08, 單側日光燈24h連續光照, 光強約為40 μmol/(m2·s), 通入無菌壓縮空氣, 培養溫度為(28±2)℃。
1.3 生長參數測定
在培養期間, 每天取樣在顯微鏡下觀察其變化, 以保證藻液的純度; 隔日采用 TU-1810紫外-可見分光光度計測定藻液的A680; 培養結束時, 取20 mL藻液, 使用已烘干稱重的濾膜抽濾, 80℃烘干后測定總重, 計算生物量。干重測定重復三次, 取平均值。
1.4 粗脂含量測定
培養結束后, 收集藻液離心(8000 r/min, 15min), 藻泥收集于保鮮盒中真空冷凍干燥后稍加研磨獲得藻粉。粗脂提取步驟參照許瑾等[8]等的方法。實驗重復3次, 取平均值。
1.5 富油微藻的脂肪酸成分分析
皂化: 取50 mg粗脂置于螺口玻璃瓶中, 加入5 mL的2%硫酸甲醇溶液, 充入氮氣后封閉, 100℃烘箱中加熱1h, 冷卻至室溫。甲酯化: 加入5 mL 5%的三氟化硼甲醇溶液, 80℃加熱30min冷卻至室溫后加入3 mL蒸餾水和2 mL正己烷, 漩渦震蕩后靜置分層, 取上層置于2 mL的微量離心管中, 封口待測。
GC-MS色譜條件[9]: 石英毛細管柱 HP-FFAP (30 m×0.25 mm, 0.25 m), 程序升溫: 從160℃開始, 以6℃/min升到250℃, 保持5min; 載氣為 He, 柱流量1.0 mL/min,進樣口溫度 250℃, 分流比 50∶1。質譜條件: EI 源; 電離電壓70 eV, 離子源溫度230℃, 掃描范圍10—500 amu,進樣量 1.0 μL。
1.6 富油微藻的分子鑒定
取處于對數生長期的藻液離心后棄去上清, 藻泥置于微量離心管中, 使用PlantGen DNA Kit (北京康為世紀生物科技有限公司)按照說明書提取并純化藻株基因組DNA。
PCR擴增: 藻株1C4參考文獻[5]的方法擴增LSU序列, 引物序列為: Forward 5′-AGCGGAGGAAAAGAAAC TA-3′; Reverse 5′-TACTAGAAGGTTCGATTAGTC-3′; 藻株11B7參考文獻[10]的方法擴增其ITS1、5.8S rDNA及ITS2 全序列, 引物序列為: Forward 5′-GAAGTCGTAACAA GGTTTCC-3′; Reverse 5′-TCCTGGTTAGTTTCTTTTCC-3′。PCR 反應體積為 25 μL, 包括 DNA 模板 1 μL, TaKaRaTaq酶 0.2 μL (1U), 引物(濃度為 10 μmol/L)各 1 μL、dNTP(濃度為 2.5 mmol/L)2 μL、10×buffer (Mg2+Plus)2.5 μL,ddH2O 17.3 μL。擴增反應在Takara-TP600型PCR儀上進行, PCR擴增產物以0.8%瓊脂糖凝膠電泳檢測, 進一步純化后送至上海生工生物工程技術服務有限公司測序, 所獲得的基因序列在 NCBI 服務器上 (http://www.ncbi.nih.gov) 用BLAST 進行同源檢測。
進化樹的構建: 根據同源檢測結果, 從NCBI上下載相關的序列, 應用 ClustalX1.83 軟件進行多序列比對;通過MEGA5以鄰接法(Neighbor-Joining Method, NJ)構建系統發育樹。
2 結果
2.1 水樣采集及微藻分離
于海口周邊采集淡水水樣約60份, 經涂布分離法初步得到藻種 300株, 通過細胞形態及尼羅紅染色的情況從中初步篩選出15株具有產油潛力的藻株, 進行復篩。
2.2 藻株的復篩及產油潛力評價
對通過初篩后的藻株進行復篩(表 1), 可見, 有些微藻的油脂含量較高, 但生物量不高, 如 10C7, 油脂含量高達45.09%, 但生物量僅有0.67 g/L; 反之, 一些生物量較高的藻含油量卻比較低, 如10F6, 生物量高達1.58 g/L,但油脂含量僅為 18.02%。因此, 應該綜合生物量和油脂含量來考察藻株產油性能, 該指標稱為總脂收獲量, 即微藻總脂含量與生物量的乘積, 表示實際收獲的油脂量。復篩過程中總脂收獲量超過0.45 g/L的藻株有1C4、2H4、1H8、11B7, 它們分別高達0.66、0.49、0.45和0.59 g/L。
2.3 富油微藻的脂肪酸成分分析
1C4、2H4、1H8、11B7四種富油微藻的脂肪酸成分及其相對含量(表2)。
目前的高速柴油機燃料的十六烷值約為 40—56,大多數的柴油機可采用的十六烷值 40—45。棕櫚酸(C16:0)甲酯、棕櫚油酸(C16:1)甲酯、硬脂酸(C18:0)甲酯和油酸(C18:1)甲酯的十六烷值分別為 85.9、51.0—59.59、101和56.55—59.3[11], 均高于國內及國際上主要國家現行的生物柴油標準十六烷值(>45—51)[12]。由表3可知, 4種富油微藻中以上4種脂肪酸含量達到了43.52%—77.56%, 其中以1H8最高。在4株富油微藻中, 總脂收獲量最大的 1C4, 但其脂肪酸的總體不飽和程度較高(二烯酸和三烯酸的含量超過了總脂的46%)。適量的不飽和脂肪酸會增加生物柴油低溫下的流動性, 但過量又會降低生物柴油的穩定性[13], 因此選擇該藻作為生物柴油來源時, 需加入抗氧化劑以提升其抗氧化性能。另外11B7和1H8的總脂收獲量雖次于1C4, 但二者脂肪酸不飽和程度低(C18:1的含量均遠遠高于1C4), 因此抗氧化性能更好。值得注意的是, 2H4中還含有一定量的 EPA(二十碳五烯酸), 在生產生物柴油的同時還可開發高價值副產物。

表1 15株微藻的收獲時干重與總脂收獲量比較Tab.1 Biomass concentration, lipid content and lipid yield of 15 microalgal strains

表2 四種富油微藻的脂肪酸成分Tab.2 Fatty acid composition of several microalgal strains
2.4 兩株富油微藻的鑒定
富油微藻1C4和11B7的基因組DNA經提取純化后,PCR分別得到 1C4的 LSU片段和 11B7的 ITS1、5.8S rDNA、ITS2的部分片段, 其大小分別約為 850和 1500 bp。經BLAST分析結果表明, 1C4的LSU片段DNA序列分別同 EU410621.1Chlamydomonas reinhardtii、DQ373067.1C.incerta的部分片段相似度高達 98%和99%, 11B7的ITS1、5.8S rDNA及ITS2序列片段同GQ 375101.1Hariotina reticulata、JN703736.1pectinatus的部分片段相似度高達97%和91%。綜合序列比對、系統進化樹(圖1、圖2)、二者顯微形態(圖3)等結果, 初步確定1C4和11B7分別屬于衣藻屬和空星藻屬。
3 討論
3.1 富油微藻的篩選
在自然界中存在大量性能優越的微藻可作為生物柴油、餌料或高價值活性成分的來源。如雨生紅球藻可積累較高含量的蝦青素, 硅藻中富含多不飽和脂肪酸, 螺旋藻中富含藻膽蛋白[14]等。在能源危機的推動下, 目前各國大力發展的生物柴油已成為國際上發展最快、應用最廣的環保型可再生能源。微藻作為生物柴油的一種理想來源,重點是選擇一種合適的藻種作為生物柴油原材料[15]。本試驗最終篩選出4株富油微藻, 總脂收獲量均在0.45 g/L以上, 具有較高的產油潛力。

圖1 藻株1C4系統發育樹Fig.1 Phylogenetic tree of strain 1C4
目前, 微藻油脂的生產中存在較多限制, 這就導致了目前微藻生物柴油成本偏高。如何降低生產成本, 實現其商業化運作是解決微藻生物柴油產業化的重要問題。提高藻種油脂收獲量或生產高價值副產物是降低微藻生物柴油成本較為理想的途徑。本文自熱帶淡水水體中分離出約 300株微藻并通過尼羅紅染色法初篩, 再以初篩所得15株具有產油潛力的藻株作為研究對象, 設置相同的培養條件, 比較它們的生長狀況及最終油脂收獲量, 篩選具有高效產油潛力的藻株。最終得到4株生長狀況較好并且含油量在25%以上的藻種, 通過對其中1C4和11B7兩株油脂收獲量高于0.5 g/L的藻種進行分子鑒定, 初步確定二者分別屬衣藻屬和空星藻屬。在培養過程中, 筆者還觀察到11B7培養后期易沉降, 可充分利用這一點對其進行采收, 大大減少設備投入和能源消耗, 從而進一步降低微藻生物柴油的生產成本。
3.2 微藻的鑒定
傳統的微藻鑒定方法主要依賴于光學顯微鏡, 即在顯微鏡下對微藻形態結構的觀察和一些藻體所固有的生理生化特性。但是由于微藻細胞微小, 加之近緣種之間的形態差異非常不明顯, 即使在顯微鏡下也很難確定其準確的分類地位[16]。近年來興起的分子生物學方法通過選擇有代表性的序列片段作為分類標準來區分不同生物、同種生物種內株系之間的遺傳差異, 具有操作容易、結果可靠等優點, 被廣泛用于赤潮藻類及其他微藻的鑒定和系統進化研究中[17]。核糖體RNA(rRNA)基因片段是在微生物的分子鑒定中常用的序列[18,19], 其中小亞基 rRNA(Small subunit rRNA, SSU rRNA)基因序列比大亞基rRNA(Large subunit, LSU rRNA)基因序列更為保守, 因此更適于分析親緣關系較遠的藻株, 相應地, LSU rRNA基因序列就更適用于分析親緣關系較近的藻株, 如同屬的不同株系。此外還有線粒體DNA(mitochondria DNA)序列、質體DNA(plastid DNA, rbcL)序列、ITS(Internal Transcribed Sequences)序列及微衛星DNA(microsatellite DNA)序列等也可用于分子鑒定。本實驗分別擴增出1C4的LSU序列及11B7的ITS1、5.8S rDNA及ITS2序列并在NCBI服務器上進行BLAST比對分析, 同時結合二者細胞形態對其進行鑒定, 具有較高的準確度和可信度。
4 結論
在自然界中微藻種質資源豐富, 其中以綠藻最易分離獲得, 并能夠快速生長。油脂含量測定及脂肪酸GC-MS分析結果顯示本研究中所分離的富油綠藻中脂肪酸成分也富含適宜作為生物柴油來源的脂肪酸。基因片段序列BLAST分析、系統進化樹構建并結合細胞形態分析兩株高產油微藻, 初步確定二者分別屬衣藻屬和空星藻屬。其中11B7培養后期易沉降, 因此可實現低成本采收。對于二者產油生理與生化機制、生長及產油條件的優化有待進一步研究, 以期微藻生物柴油產業化奠定良好的基礎。
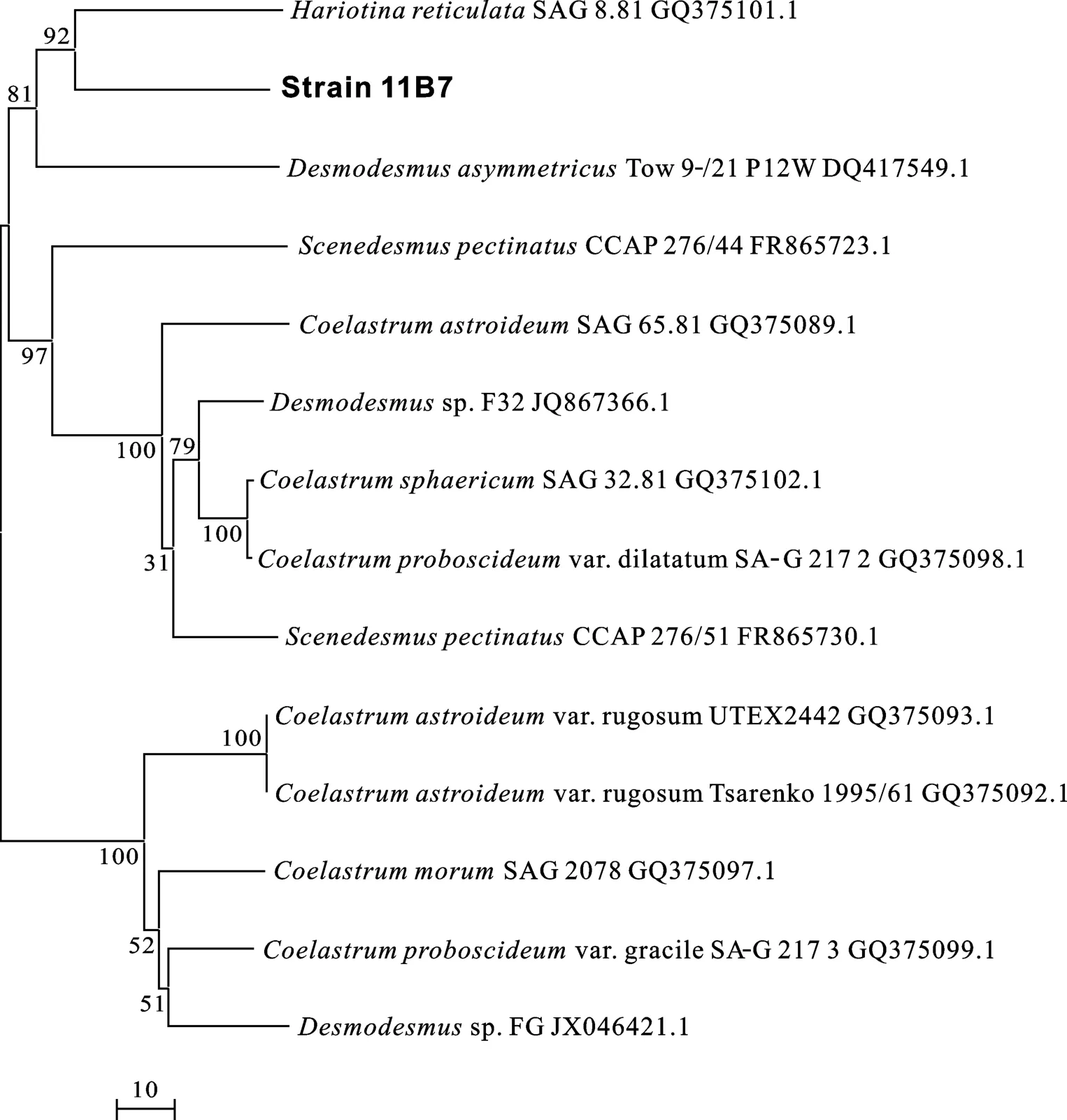
圖2 藻株11B7系統進化樹Fig.2 Phylogenetic tree of strain 11B7

圖3 1C4(A) 和11B7的顯微照片(400×)Fig.3 Microscopic photo of 1C4 (A) and 11B7(B)
[1] Brennan L, Owende P.Biofuels from microalgae—A review of technologies for production, processing, and extractions of biofuels and co-products [J].Renewable and Sustainable Energy Reviews, 2010, 14(2): 557—577
[2] Xu J, Xu X D, Fang X T,et al.Screening and lipid analyses of high oleaginousChlorellaspecies [J].Acta Hydrobiologica Sinica, 2012, 36(3): 426—432 [徐進, 徐旭東, 方仙桃, 等.高產油小球藻的篩選及其油脂分析.水生生物學報, 2012, 36(3): 426—432]
[3] Rodolf i L, Zittelli G C, Bassi N,et al.Microalgae for oil:strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnology and Bioengineering, 2009, 102(1): 100—112
[4] Thi T Y D, Sivaloganathan B, Obbard J P.Screening of marine microalgae for biodiesel feedstock [J].Biomass and Bioenergy, 2011, 35(7): 2534—2544
[5] Abou-Shanab R A I, Hwang J H, Cho Y,et al.Characterization of microalgal species isolated from fresh water bodies as a potential source for biodiesel production [J].Applied Energy, 2011, 88(10): 3300—3306
[6] He G Q, Deng Z P, Tao L,et al.Screen and fermentation optimization of microalgaes with high lipid productivity [J].Journal of Agricultural Biotechnology, 2010, 18(6): 1046—1053 [賀國強, 鄧志平, 陶麗, 等.高油脂產率微藻的篩選及發酵條件的優化.農業生物技術學報, 2010, 18(6):1046—1053]
[7] Robert A.Andersen.Algae Culturing Techniques [M].Elsevier Academic Press.USA.2005, 92—94.
[8] Xu J, Zhang C W, Li A F,et al.Isolation and selection of freshwater microalgae for oil production in south China [J].Renewable Energy Resources, 2011, 29(1): 66—71 [許瑾,張成武, 李愛芬, 等.華南地區淡水產油微藻藻株的分離與篩選.可再生能源, 2011, 29(1): 66—71]
[9] Wang C N, Liu P H, Liang Z Y,et al.Optimization of oil Extraction fromGonocaryum lobbianum(Merr.) Kurz fruit and analysis of its fatty acids [J].Fine Chemicals, 2011,28(9): 861—865, 908 [汪春牛, 劉平懷, 梁振益, 等.瓊欖果實油提取工藝優化及其脂肪酸成分分析.精細化工,2011, 28(9): 861—865, 908]
[10] Timmins M, Thomas-Hall S R, Darling A,et al.Phylogenetic and molecular analysis of hydrogen-producing green algae [J].Journal of Experimental Botany, 2009, 60(6): 1691—1702
[11] Knothe G.“Designer” biodiesel: optimizing fatty ester composition to improve fuel properties [J].Energy and Fuels,2008, 22: 1358—1364
[12] Luo W, Yuan Z H, Liao C P.Biodiesel standard and quality assessment [J].Renewable Energy, 2006, 128(4): 33—37 [羅文, 袁振宏, 廖翠萍.生物柴油標準及質量評價.可再生能源, 2006, 128(4): 33—37]
[13] Li X B, Xu X D, Kong R Q.Studies on the production of oil and polyunsaturated fatty acidsinfive species of Nannochloropsis [J].Acta Hydrobiologica Sinica, 2010, 34(5):893—897 [李秀波, 徐旭東, 孔任秋.五種微綠球藻產油和產多不飽和脂肪酸的研究.水生生物學報, 2010, 34(5):893—897]
[14] Grima E M, Belarbi E H, Acién Fernández F G,et al.Recovery of microalgal biomass and metabolites: process options and economics [J].Biotechnology Advances, 2003, 20(7-8):491—515
[15] Zheng H L, Zhang Q, Ma X C,et al.Research progress on biodiesel-producing microalgae cultivation [J].China Biotechnology, 2009, 29(3): 110—116 [鄭洪立, 張齊, 馬小琛,等.產生物柴油微藻培養研究進展.中國生物工程雜志,2009, 29(3): 110—116]
[16] Shen X.Preliminary study on the isolation and identification of marine microalgae [D].Thesis for Master of Science,Ocean University of China.2011 [沈雄.海洋微藻的分離及鑒定方法的初步研究.碩士學位論文, 中國海洋大學, 青島.2011]
[17] Zheng J B, Zhang F Y, Ma L B,et al.PCR identification of two alien invasive species of red tide algae [J].Marine Fisheries, 2009, 31(3): 325—329 [鄭俊斌, 張鳳英, 馬凌波, 等.兩種常見外來入侵赤潮藻的 PCR鑒定.海洋漁業, 2009,31(3): 325—329]
[18] Mutanda T, Ramesh D, Karthikeyan S,et al.Bioprospecting for hyper-lipid producing microalgal strains for sustainable biofuel production [J].Bioresource Technology, 2011, 102(1):57—70
[19] Rasoul-Amini S, Ghasemi Y, Morowvat M H,et al.PCR amplif i cation of 18S rRNA, single cell protein production and fatty acid evaluation of some naturally isolated microalgae [J].Food Chemistry, 2009, 116(1): 129—136

