中國淡水綠藻綱新記錄屬——麥可屬(Mychonastes)
李艷暉 胡明明 沈銀武 劉永定 李敦海 李根保
(1.中國科學院水生生物研究所, 武漢 430072; 2.中國科學院大學, 北京 100049)
超微浮游植物(Picophytoplankton, <3 μm)廣泛分布于各種類型和不同營養水平的湖泊中, 是水體的重要初級生產者[1,2], 包括超微藍藻(Picocyanobacteria)和超微真核藻(Eukaryotic picoalgae)。
一般來說, 典型的真核超微浮游生物的特征為:細胞球狀, 形態簡單, 以似親孢子或二分裂營無性生殖[3]。由于其細胞較小, 形態特征簡單, 使用普通光學顯微鏡甚至電子顯微鏡觀察也很難鑒定到綱水平[4], 因此常被描述為“Small coccoid 或Chlorellalike cells; little round green balls”(LRGT)或Nannochloris-like algae”[1,2], 導致了對這類藻進行分類學描述和鑒定上的困難, 同時也人為降低了其在自然水體中的多樣性。
目前, 國外已報道的常見淡水真核超微藻種類主要有:Choricystis minor(Skuja) Fott[5—8]、Pseudodictyosphaerium jurisii(Hindák) Hindák[9]、Mychonastes homosphaera(Skuja) Kakina & Pun?ochá?ová[10,11]、Nannochloropsis limneticaKrienit, Hepperle, Stich &Weiler[4,12], 歐洲、北美、以色列等都有超微浮游植物分離、形態學、超微結構和系統發育方面的報道。我國尚未有關于淡水超微真核浮游植物的分布和多樣性方面的研究, 最新的藻類分類學資料《中國淡水藻類—系統、分類及生態》[13]中也沒有關于超微真核藻屬和種的描述。作者于2006年自滇池分離獲得 2株單種真核超微藻, 對其進行了形態學、細胞超微結構特征觀察, 同時結合 18S rRNA基因序列構建系統發育樹確定其分類學地位, 填補我國淡水真核超微浮游植物分類學研究方面的空白。
1 材料與方法
1.1 藻株的分離與培養
取一定體積新鮮采集的水樣預過 Whatman GF/C玻璃纖維濾膜或Whatman 2.0 μm孔徑的聚碳酸酯膜, 取過濾水樣(或原水樣)劃平板或鋪平板接種于含 1%瓊脂的 BG11[14]或 BBM[15]固體培養基,用封口膜封好后將其倒置于光照培養箱內, 于20—30 μmol photons/(m2?s)、光暗周期 12h∶12h、溫度(25±1)℃條件下培養, 待平板上長出可見藻落,挑取單藻落進行鏡檢, 進一步分離純化目的藻落,挑單藻落至BG11液體培養基, 于相同條件下培養。獲得藻株 DC-10和 DC-11 (分別于 2006年 7月和2006年10月分離自滇池水樣)。
1.2 形態學和細胞超微結構觀察
取培養至指數生長階段的藻細胞進行光鏡及電鏡的樣品制備。分別用生物顯微鏡(Nikon ECLIPSE E600)、掃描電鏡(荷蘭FEI公司的Quanta 200)和透射電鏡(日本JEOL公司的JEM-1230)觀察。
1.3 藻細胞基因組DNA提取
方法參照《精編分子生物學實驗指南》(第四版)[16]。取適量體積指數生長期的藻液, 于 20℃,12000 r/min離心5min收集藻細胞并用無菌水洗滌3次, 加 567 μL的 TE緩沖液[100 mmol/L Tris-HCl(pH 8.0), 20 mmol/L Na2EDTA]反復吹打使藻細胞重懸浮, 加 30 μL 10%的 SDS和 3 μL 20 mg/mL的蛋白酶K, 混勻, 37℃溫育1h, 期間不斷輕輕搖動; 加100 μL 5 mol/L的 NaCl, 充分混勻后加入 80 μL 10%的 CTAB/NaCl溶液, 混勻, 于 65℃溫育 30min; 加等體積的酚∶氯仿∶異戊醇(25∶24∶1), 混勻, 于20℃, 10000 r/min離心10min, 小心吸取上清至新管中,加等體積氯仿/異戊醇(24/1), 混勻, 20℃, 10000 r/min離心 10min, 重復 1次; 轉移上清至新管中, 加 0.6倍體積的冰冷異丙醇沉淀DNA, 于4℃, 12000 r/min,10min離心收集DNA沉淀; 70%乙醇清洗2次后加50—100 μL 無菌水溶解 DNA, –20℃保存。
1.4 藻株18S rRNA基因序列分析18S rRNA基因擴增
使用真核生物通用18S rRNA基因引物對 18F(5′-ACCTGGTTGATCCTGCCAG-3′)和 18R (5′-TGA TCCTTCT/CGCAGGTTCAC-3′) (Moon-van der Staay,2001)[17]擴增藻株18S rRNA基因片段, 引物由上海英駿合成。PCR反應體系為 20 μL, 包括: 10×PCR緩沖液[200 mmol/L (NH4)2SO4, 750 mmol/L Tris-HCl (pH 8.8), 0.1% TWEEN 20], 1.5 mmol/L MgCl2,dNTP 200 μmol/L, 引物各 0.15 μmol/L, 1 μL 模板DNA, 0.2 UTaqDNA聚合酶(Fermentas), 加水補足至20 μL。反應條件為: 94℃預變性5min; 94℃ 60s,58℃ 60s, 72℃, 90s, 循環29次; 72℃延伸 10min。PCR擴增產物用1.2%瓊脂糖凝膠電泳檢測, 擴增片段大小在1800 bp左右。
PCR產物的回收、純化與克隆 擴增的PCR產物使用 OMEGA (USA)試劑盒回收純化, 連接至pMD 18-T vector (Takara, Japan), 轉化大腸桿菌E.coliDH 5α感受態細胞, 使用引物對18F/18R進行陽性克隆檢驗, 對重組質粒進行測序, 由上海Invitrogen生命技術有限公司完成測序。
藻株系統發育分析 使用軟件 Clustal X(1.83)進行多序列比對; MEGA 4.0采用鄰接法(NJ)和最大簡約法(MP)構建系統樹, 自展率(Bootstrap)進行1000次重復, 獲得一致系統樹。用于構建系統進化樹的藻株及其GenBank信息(表1)。藻株DC-10和DC-11在GenBank中的登錄號分別為: JF834168和JF834169。

表1 用于構建系統進化樹的藻株及其GenBank信息Tab.1 Strains used for phylogenetic tree construction and their GenBank information
2 結果
2.1 形態學特征分析
藻株 DC-10(圖 1a)和 DC-11均為單細胞, 細胞球形, 直徑 1.5—4 μm, 在光鏡下觀察細胞壁平滑,多見母細胞包被2個似親孢子進行繁殖。
2.2 藻株DC-10的細胞超微結構觀察
在掃描電鏡下觀察藻株 DC-10, 細胞球形, 不同于普通光學顯微鏡下觀察到的平滑細胞壁, 細胞壁表面具有不規則的肋網(圖1b)。
藻株 DC-10的超薄切片觀察結果(圖 1c-f): 細胞壁2層, 外層寬20—25 nm, 為三層結構, 表現為暗–明–暗三層。每個細胞具備一套簡單的細胞器,主要包括: 1個細胞核, 1個線粒體和1個葉綠體。葉綠體周生, 杯狀, 占據細胞大部分體積, 不具蛋白核; 類囊體一般2—6層平行堆疊, 淀粉粒散布在其中, 但數量不多且并沒有在每個細胞中都觀察到。細胞核常位于葉綠體凹面對面, 線粒體則常位于細胞核和葉綠體之間, 脊數目較少, 三者占據了細胞的絕大部分體積, 在細胞質中分布著數量眾多的核糖體(圖 1c-e)。
DC-10營似親孢子的無性繁殖方式, 如圖1c顯示的是由母細胞壁包被2個大小相同、具相同細胞器的似親孢子。似親孢子母細胞的外層細胞壁具典型的TL–層(Trilaminar Layer)結構, 2個暗層之間為透明電子層。
2.3 藻株DC-10、DC-11的18S rRNA基因序列分析

圖1 藻株DC-10顯微鏡照片Fig.1 Micrographs of green alga strain DC1-10

圖2 采用鄰接法(NJ)基于部分18S rRNA基因序列構建的系統進化樹Fig.2 Phylogenetic tree (neigh bor-joining) inferred from partial 18S rRNA gene sequences
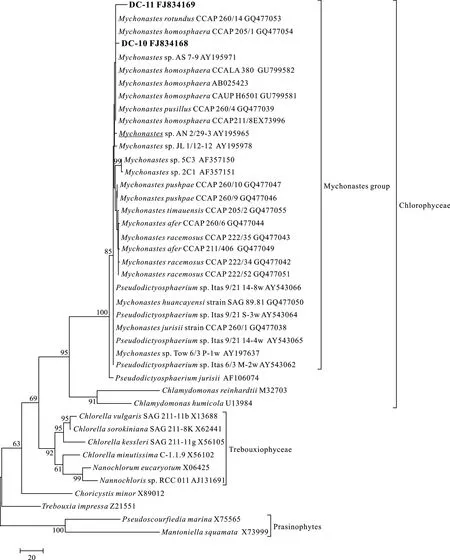
圖3 采用最大簡約法(MP)基于部分18S rRNA基因序列構建的系統進化樹Fig.3 Phylogenetic tree (Maximum parsimony) inferred from partial 18S rRNA gene sequences
使用真核生物通用引物對 18F/18R擴增藻株DC-10和 DC-11的 18S rRNA基因片段長度約為1800 bp, 同Mychonastes homosphaera(X73996和AB025423)相似性為99%, 在構建的18S rRNA系統發育樹(圖2、圖3)中, DC-10和 DC-11同MychonasteshomosphaeraCCAP211/8E(X73996)、M.Homosphaera(AB025423)、M.homosphaeraCCAP 205 等Mychonastes(Simpson & van Valkenburg)屬的其他藻株以 85%的 bootstrap值組成麥可群, 為單起源,同Pseudodictyosphaerium jurisii以100%的bootstrap值分成 2個獨立的進化枝, 均屬于綠藻綱(Chlorophyceae), 同小球藻屬(ChlorellaBeijerinck)、Choricystis(Skuja) Fott等淡水中常見的真核超微藻屬種類所在的特波藻綱(Trebouxiophyceae)進化枝相鄰。
2.4 麥可屬(Mychonastes Simpson et Van Valkenburg)
該屬特征同小球藻屬類似, 但不具蛋白核。細胞球形、卵形或橢圓形, 細胞壁厚, 2層, 外層細胞壁表面具肋網; 單生或多個細胞聚集成群; 葉綠體1—4個, 周生, 盤狀或杯狀, 常有淀粉粒; 通過似親孢子生殖; 不具動孢子; 細胞核1個, 營養細胞中其大小有差異; 線粒體1個[10,22]。
藻株DC-10的細胞大小、形狀、葉綠體形態、細胞壁結構及似親孢子繁殖方式同麥可屬M.homosphaera基本相同[10]。在構建的18S rRNA基因系統發育樹中, DC-10和DC-11位于麥可屬群進化枝上, 屬于綠藻綱。但由于選取的18S rRNA基因序列保守性高, 突變頻率低, 在構建的進化樹中不能進一步確定其種水平。因此我們將DC-10和DC-11歸為麥可屬種類, 為我國首次報道的淡水超微真核藻。
3 討論
麥可屬由Simpson和Van Valkenburg于1978年首次描述, 其模式種為M.ruminatesSimpson & Van Valkenburg, 分離自美國馬里蘭州切薩皮克灣。隨后原先為小球藻屬的C.homosphaeraSkuja和C.zofingiensisD?nz被劃分至麥可屬, 分別重新命名為M.homosphaera和M.zofingiensis(D?nz) Kalina &Pun?ochá?ová[10,11]。M.homosphaera同M.ruminates形態相似, 只是生境不同,M.homosphaera分離自淡水, 而M.ruminates分離自半咸水。M.zofingiensis的細胞大小、葉綠體形狀和似親孢子數目不同于M.homosphaera, 細胞大小約 2倍于后者, 葉綠體幾個或多數, 形成的似親孢子數目可達64個[10]。
同M.homosphaera不同之處在于, 在DC-10中我們觀察到的似親孢子的數目多為 2個, 偶見母細胞包被 4個似親孢子, 這可能與使用的培養基不同或是處于不同的生長階段有關。另外, 同分離自以色列Kinneret湖的藻株相比, DC-10細胞壁上的肋網要密集一些。
麥可屬呈世界性分布, 生境廣泛, 包括溪流和大型靜止水體[11], 在肯尼亞Baringo湖和Victoria湖,瑞典Erken湖, 德國Stechlin湖, 印度Gandhi湖[11],以色列Kinneret湖[10], 瑞士Hagel湖、Lucerne湖和Alpnach湖[8], 美國北達科他州 Arrowwood國家野生動植物保護區內淺水湖[18]都有分布。
分子系統學研究表明綠藻門似親孢子類球狀綠藻具有很多分類單元, Friedl基于18S rDNA序列分析, 將這類藻歸為 2個不同的綱, 分別是特波藻綱(Trebouxiophyceae)和綠藻綱(Chlorophyceae)[19]。根據Huss,et al.基于生物化學、生理學、超微結構和分子生物學研究的結果, 小球藻類群(Chlorellataxa)分屬于特波藻綱和綠藻綱, 其中M.homosphaera屬于綠藻綱。小球藻(C.vulgarisBeijerinck)、凱氏小球藻(C.kessleriFott & Nováková)、C.lobophoraAndreyeva和C.sorokinianaShih.& Krauss 4種屬于小球藻屬(ChlorellaBeijerinck), 屬特波藻綱, 其特征是葡萄糖胺為細胞壁主要成分, 具淀粉鞘且被 2層類囊體嵌入的蛋白核[9,20]。小球藻為小球藻屬的模式種, 其細胞壁薄, 不含孢粉類物質, 外層細胞壁不具暗–明–暗三層結構[7]。《中國淡水藻類—系統、分類及生態》[13]中小球藻屬有 3個種, 分別為小球藻, 橢圓小球藻(C.ellipsoideaGerneck)和蛋白核小球藻(C.pyrenoidosaChick), 《中國淡水藻志(第八卷)—綠藻門, 綠球藻目》[21]中小球藻屬包括 5種,除小球藻和橢圓小球藻外, 還有凱氏小球藻、喜糖小球藻(C.sacharophila(Krueger) Migula)和埃氏小球藻(C.emersoniiShihira & Krauss)。在Huss,et al.構建的小球藻類 18S rRNA基因系統發育樹中, 喜糖小球藻、橢圓小球藻、C.luleoviridisChodat和C.mirabilisAndreyeva各以很高的bootstrap值(>88%)聚在一起, 說明它們之間親緣關系很近, 同小球藻屬均屬于特波藻綱[20]。可通過觀察藻細胞大小和是否含蛋白核來區分小球藻屬和麥可屬種類, 小球藻屬的4種藻細胞均不小于3 μm, 不屬于超微浮游植物范疇, 具蛋白核, 而麥可屬不具蛋白核。
另外常混淆的小型球狀類藻還有Nannochloris(Naumann), 根據 Naumann對Nannochloris屬模式種N.bacillaris(Naumann)的原始描述, 它通過二分裂方式繁殖, 屬于絲藻目(Ulotrichales)[7], 而麥可屬則以似親孢子方式繁殖。
偽網球藻屬(PseudodictyosphaeriumHindák)同麥可屬均隸屬于綠藻綱, 該屬的基本特征為: 單細胞或群體, 細胞直徑 2—10 μm, 葉綠體周生, 杯狀或帶狀, 不具蛋白核, 具一套簡單的細胞器, 其細胞超微結構同麥可屬類似。分布于河流、湖泊和小型水體如池塘中, 德國Stechlin湖[9]和美國明尼蘇達州 Itasca湖[3]都有其分離報道。其中,P.jurisii(Hindák) Hindák 最初被描述為Dactylosphaerium jurisiiHindák, 后根據其不具蛋白核和動孢子將其劃分至偽網球藻屬(Pseudodictyosphaerium), 是一種常見的超微綠藻, 但細胞通常以群體形式存在, 由殘存的母細胞壁連接在一起, 使用墨汁負染色法很容易觀察到細胞包被在透明的無特殊結構的膠被中,但是在野外或是室內培養條件下, 群體很容易完全解聚[9,11], 因此增加了鑒定小型、球形或橢圓形類綠藻的困難。
球狀類超微綠藻由于其細胞小, 形態學特征相同而很難對其進行正確分類, 應結合電鏡和分子生物學方法方能更準確地確定其分類學地位。我國有關淡水超微真核藻的分離培養、形態學、生理生態學、多樣性及分子系統關系研究起步較國外晚, 因此有待于進一步擴大研究調查范圍, 分離培養獲得更多的超微浮游植物材料, 以完善我國的淡水超微浮游植物的分類學資料。
致謝:
衷心感謝魏印心先生、胡鴻鈞先生及劉其芳老師給予本文的指導和幫助。感謝云南大理洱海湖泊研究中心的衛志宏、孟良和大理州環境監測站工作人員在洱海樣品采集過程中的幫助和支持。
[1] Callieri C, Stockner J G.Freshwater autotrophic picoplankton: a review [J].Journal of Limnology, 2002, 61(1): 1—14
[2] Stockner J G, Antia N J.Algal picoplankton from marine and freshwater ecosystems: a multidisciplinary perspective [J].Canadian Journal of Fisheries and Aquatic Sciences, 1986,43: 2472—2503
[3] Fawley M W, Fawley K P, Owen H A.Diversity and ecology of small coccoid green algae from Lake Itasca, Minnesota,USA, includingMeyeralla planktonica, gen.etsp.nov.[J].Phycologia, 2005, 44(1): 35—48
[4] Krienitz L, Hepperle D, Stich H B,et al.Nannochloropsis limnetica(Eustigmatophyceae), a new species of picoplankton from freshwater [J].Phycologia, 2000, 39(3): 219—227
[5] Krienitz L, Huss V A R, Hümmer C.PicoplanktonicChoricystisspecies (Chlorococcales, Chlorophyta) and problems surrounding the morphologically similar ‘Nannochloris-like algae’ [J].Phycologia, 1996, 35(4): 332—341
[6] Belykh O I, Semenova E A, Kuznedelov K D,et al.A eukaryotic alga from picoplankton of Lake Baikal: morphology,ultrastructure and rDNA sequence data [J].Hydrobiologia,2000, 435: 83—90
[7] Hepperle D, Krienitz L.Systematics and ecology of Chlorophyte picoplankton in German inland waters along a nutrient gradient [J].International Review of Hydrobiology, 2001,86(3): 269—284
[8] Hepperle D, Schlegel I.Molecular diversity of eukaryotic picoalgae from three lakes in Switzerland [J].International Review of Hydrobiology, 2002, 87(1): 1—10
[9] Krienitz L, Takeda H, Hepperle D.Ultrastructure, cell wall composition, and phylogenetic position ofPseudodictyosphaerium jurisii(Chlorococcales, Chlorophyta) including a comparison with other picoplanktonic green algae [J].Phycologia, 1999, 38(2): 100—107
[10] Hanagata N, Malinsky-Rushansky N, Dubinsky Z.Eukaryotic picoplankton,Mychonastes homosphaera(Chlorophyceae, Chlorophyta) in Lake Kinneret, Israel [J].Phycological Research, 1999, 47: 263—269
[11] Krienitz K, Bock C, Dadheech P K,et al.Taxonomic reassessment of the genusMychonastes(Chlorophyceae,Chlorophyta) including the description of eight new species[J].Phycologia, 2011, 50(1): 89—106
[12] Fietz S, Bleiβ W, Hepperle D,et al.First record ofNannochloropsis limnetica(Eustigmatophyceae) in the autotrophic picoplankton from Lake Baikal [J].Journal of Phycology, 2005, 41: 780—790
[13] Hu H J, Wei Y X.The Freshwater Algae of China Systematics, Taxonomy and Ecology [M].Beijing: Science Press.2006, 209—903 [胡鴻鈞, 魏印心.中國淡水藻類—系統、分類及生態.北京: 科學出版社.2006, 209—903]
[14] Rippka R, Deruelles J, Waterbury J B,et al.Generic assignments, strain histories and properties of pure cultures of cyanobacteria [J].Journal of General Microbiology, 1979,111(1): 1—61
[15] Nichols H W, Bold H C.Trichosarcina polymorphagen.etsp.nov.[J].Journal of Phycology, 1965, 1(1): 34—38
[16] Ausubel F M, Brent R, Kingston R E,et al.Short Protocols in Molecular Biology [M] (4th ed.) John Wiley & Sons, Inc.,Publishers.2000, 55—56 [F.M.奧斯伯, R.布倫特, R.E.金斯頓.精編分子生物學實驗指南(第四版).北京: 科學出版社.2000, 55—56]
[17] Moon-van der Staay S Y, De Wachter R, Vaulot D.Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity [J].Nature, 2001, 409: 607—610
[18] Phillips K A, Fawley M W.Diversity of coccoid algae in shallow lakes during winter [J].Phycologia, 2000, 39(6):498—506
[19] Friedl T.Inferring taxonomic positions and testing genus level assignments in coccoid green lichen algae: a phylogenetic analysis of 18S ribosomal RNA sequences fromDictyochloropsis reticulataand from members of the genusMyrmecia(Chlorophyta, Trebouxiophyceae cl.nov.) [J].Journal of Phycology, 1995, 31: 632—639
[20] Huss V A R, Frank C, Hartmann E C,et al.Biochemical taxonomy and molecular phylogeny of the genusChlorellasensu lato (Chlorophyta) [J].Journal of Phycology, 1999, 35:587—598
[21] Bi L J, Hu Z Y.Flora Algarum Sinicarum Aquae Dulcis.Tomus VIII.Chlorophyta.Chlorococcales [M].Beijing: Science Press.2005, 30—32 [畢列爵, 胡征宇.中國淡水藻志第八卷 綠藻門 綠球藻目.北京: 科學出版社.2005, 30—32]
[22] Simpson P D, Van Valkenburg S D.The ultrastructure ofMychonastes ruminatesgen.etsp.nov., a new member of the Chlorophyceae isolated from brackish water [J].European Journal of Phycology, 1978, 13: 117—130

