鈣離子濃度對兩種蕨類植物光合作用的影響
羅緒強,王世杰,張桂玲,王程媛,楊鴻雁,廖昕榮
1. 貴州師范學院地理與旅游學院,貴州 貴陽550018;2. 中國科學院地球化學研究所環境地球化學國家重點實驗室, 貴州 貴陽550002;
3. 貴陽學院化學與材料工程學院, 貴州 貴陽550005
鈣素是植物生長發育所必需的礦質營養元素,在植物體內發揮著重要的生理功能[1-2]。但是,植物體內較高的Ca2+濃度會影響植物的光合作用和生長速率,嚴重的還會破壞細胞器而致植物死亡[3-4]。另外,細胞質中過多的游離態Ca2+可與PO43-形成沉淀,干擾與磷代謝有關的生理過程,抑制呼吸作用,或因妨礙正常的信號傳導而影響植物生長[5-6],這可能是許多植物在土壤高Ca2+地區難以正常生長的原因之一。
石灰土作為喀斯特地區分布最廣的非地帶性土壤,是其下伏碳酸鹽巖風化的產物。由于對母巖的繼承性,土壤Ca2+含量普遍較高。據報道,同為常綠落葉闊葉混交林下,石灰土Ca2+濃度是酸性土的3倍以上[7]。喀斯特地區石灰土的高鈣含量已成為影響該區植物生理特征及植物多樣性最重要的環境因素之一[8]。
本文分別選取石灰土專屬種柳葉蕨(Cyrtogonellum Ching)和酸性土專屬種薄葉雙蓋蕨(Diplazium pinfaense Ching) 2種蕨類植物為研究對象,模擬石灰土高Ca2+濃度的環境特征,用具有不同Ca2+濃度梯度的營養液對2種蕨類植物進行培養,根據其凈光合速率、蒸騰作用、氣孔導度、胞間CO2濃度等光合指標特性,探討鈣離子脅迫對兩種蕨類植物光合作用的影響,并比較分析了柳葉蕨和薄葉雙蓋蕨對土壤高Ca2+環境的生理響應特征。以期為喀斯特喜鈣植物適生機制的理解及退化生態系統植被恢復的物種選擇提供基礎數據和理論支持。
1 材料與方法
1.1 材料來源
實驗樣品材料石灰土專屬種柳葉蕨 (Cyrtogonellum Ching)和酸性土專屬種薄葉雙蓋蕨(Diplazium pinfaense Ching)為野外(貴州茂蘭國家級自然保護區)采集植物孢子,室內培養成株。
1.2 材料培養與處理
實驗于室溫室內進行。采用60目石英砂作為培養基,霍格蘭氏(Hoagland’s)營養液配加阿農(Arnon)微量元素混合液作為母液,通過改變配加硝酸鈣調節和配置不同營養液Ca2+濃度,配成Ca2+濃度分別為4、30、100、200 mmol·L-1的4種營養液,其中4 mmol·L-1的Ca2+濃度用以模擬酸性土中交換態鈣含量,100 mmol·L-1用以模擬石灰土中交換態鈣平均含量,并用0.1 mol·L-1的鹽酸及氫氧化鈉溶液將營養液pH值控制在6~6.5。于溫度23~27 ℃,濕度70%、光照強度15( ± 5 ) μmol·m-2·s-1條件下砂培2種植物。每種營養液設置4次重復,于室內測定植株的各項光合作用指標參數。
1.3 測定指標及方法
采用美國LI-COR公司生產的LI-6400i便攜式光合儀,對不同Ca2+濃度培養液培養的兩種蕨類植物進行凈光合速率( Pn, μmol·m-2·s-1)、蒸騰速率 ( Tr, mmol·m-2·s-1)、氣孔導度( Gs, mol·m-2·s-1)、胞間CO2濃度( Ci, μmol·mol-1)等光合作用參數的測定。測定時間為09:00~18:00,每小時測定1次。每次測定2片葉,每片葉記錄5組數據,取平均值。
1.4 數據處理
采用SPSS、Origin等軟件對實驗數據進行統計分析和制圖。
2 結果與分析
2.1 Ca2+濃度對2種蕨類植物凈光合速率的影響
2.1.1 不同Ca2+濃度對2種蕨類植物凈光合速率 Pn的影響
由表1可見,當Ca2+濃度低于100 mmol·L-1時,柳葉蕨的Pn略高于薄葉雙蓋蕨的Pn,而當Ca2+濃度為200 mmol·L-1時,薄葉雙蓋蕨的Pn高于柳葉蕨的Pn。同時,隨Ca2+濃度升高,柳葉蕨的Pn減小,而薄葉雙蓋蕨的Pn整體上呈先增大后減小趨勢。
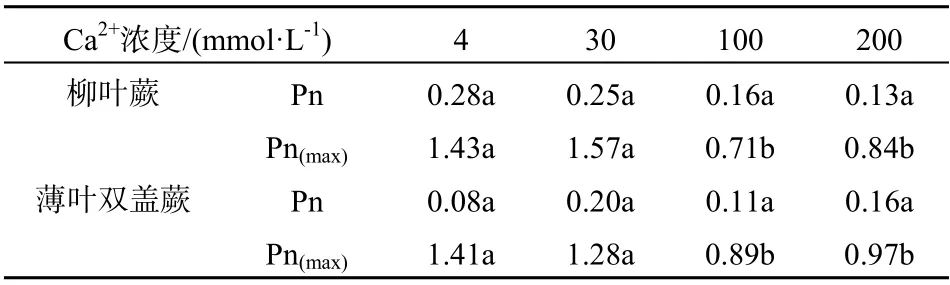
表1 不同Ca2+濃度下2種蕨類植物日間 凈光合速率均值(μmol·m-2·s-1 ) Table 1 The net photosynthetic rate ( μmol·m-2·s-1 ) of the two ferns’ leaves under different calcium concentration in medium level
4個濃度梯度上,兩植物全日最大凈光合速率Pn(max)均出現在正午12:00。從表1可知,柳葉蕨在Ca2+濃度為30 mmol·L-1時的日Pn(max)達到最高值,為1.57 μmol·m-2·s-1,說明其在Ca2+濃度為30 mmol·L-1時有最佳的生長狀態。薄葉雙蓋蕨在Ca2+濃度為4 mmol·L-1時的日Pn(max)值最高,為1.41 μmol·m-2·s-1,顯示薄葉雙蓋蕨在低Ca2+濃度(4 mmol·L-1)時有最佳的生長狀態,該濃度與通常情況下酸性土中交換態鈣濃度基本一致[9]。
2.1.2 2種蕨類植物凈光合速率( Pn )與胞間CO2濃度( Ci )的日變化關系
植物胞間CO2濃度作為光合作用的底物,其濃度能夠在一定程度上反映光合作用的強度。由圖1可見,柳葉蕨和薄葉雙蓋蕨葉片Pn與Ci均呈顯著中度負相關關系(P<0.01),其相關系數分別為-0.712和-0.804。顯示二者光合作用降低均受到一定的非氣孔限制,凈光合速率的降低可能是由葉肉細胞光合活性下降引起的[10]。
2.2 不同Ca2+濃度下2種蕨類植物的其他生理參數特征
2.2.1 蒸騰速率( Tr )日變化

圖1 2種植物凈光合速率( Pn )日變化與胞間CO2 濃度( Ci )日變化關系圖 Fig. 1 The relationship between diurnal variations of net photosynthetic rate ( Pn ) and intercellular CO2 concentration ( Ci ) of the two ferns’ leave
蒸騰作用是植物吸收和運輸水分的主要動力,在維持植物各部分水分飽和,保持細胞組織形態,促進礦質元素及無機鹽類在體內的運輸和分布,降低葉片溫度等方面均具有重要生理意義[11]。
從圖2可見,當Ca2+濃度為30 mmol·L-1時,柳葉蕨的Tr與薄葉雙蓋蕨的Tr基本相近,其余濃度梯度上二者差異顯著(P< 0.001),前者僅為后者的1/2左右。Ca2+濃度為4 mmol·L-1時,柳葉蕨(圖2A) Tr日變化曲線呈輕微的“雙峰”態,“峰”分別出現在13:00時和17:00時,“谷”出現于15:00時;30 mmol·L-1時,其Tr日變化曲線有明顯的“峰”,出現在13:00時,“谷”出現在14:00時,這與午后14:00時左右氣溫和光照強度為1 d中最大有關;隨Ca2+濃度升高,其Tr日變化曲線由“雙峰”變為“單峰”,且強度明顯減弱。薄葉雙蓋蕨(圖2B)在Ca2+濃度較低時(4mmol·L-1)的Tr隨時間變化趨勢最為明顯,在12:00時和17:00時出現“峰”,而“谷”期出現于13:00時,與柳葉蕨略有差異,這應與物種自身遺傳性有關;與柳葉蕨類似,薄葉雙蓋蕨隨 Ca2+脅迫程度的加劇,蒸騰作用強度亦降低,不同的是,Ca2+濃度較高時,薄葉雙蓋蕨的Tr隨時間(外界氣溫)變化的規律性減弱。說明薄葉雙蓋蕨可能只在Ca2+濃度較低時才可以敏銳應對1 d之中光照強度和溫度的變化。

圖2 不同Ca2+濃度下2種植物蒸騰速率( Tr )的日變化 Fig. 2 Diurnal variations of transpiration rate ( Tr ) of the two ferns’ leaves at different calcium concentration level
2.2.2 蒸騰速率( Tr )、氣孔導度( Gs )的組間差異情況
氣孔是CO2進入和水蒸汽逸出植物體的通道,植物通過調節氣孔開閉程度對光合作用和蒸騰作用這兩個相互耦合的過程進行調控[12-13],進而影響到植物的生長發育。一般說來,植物的 Tr 與 Gs 呈線性正相關,遭遇環境脅迫時,氣孔表現為關閉,即氣孔導度降低,蒸騰強度減弱[14-15]。
實驗表明,柳葉蕨和薄葉雙蓋蕨兩種植物的Tr與Gs在不同Ca2+濃度間均具有極顯著差異(P< 0.001 ),經多重比較檢驗后可以歸為如表2所示的3個系列。相對于薄葉雙蓋蕨,不同 Ca2+濃度梯度下柳葉蕨的 Tr 和 Gs 均處于較低水平,該現象的產生可能是柳葉蕨的遺傳因素造成的。兩植物在Ca2+濃度為4 mmol·L-1時均有最大的Tr和Gs,所不同的是,柳葉蕨Tr和Gs驟然降低的拐點在Ca2+濃度為100 mmol·L-1時,而薄葉雙蓋蕨出現在Ca2+濃度為30 mmol·L-1時。在Ca2+濃度為100 mmol·L-1和200 mmol·L-1時,柳葉蕨的Gs值分別為Ca2+濃度為4 mmol·L-1時的23.53%和35.29%;當Ca2+濃度為30 mmol·L-1和100 mmol·L-1時,薄葉雙蓋蕨的Gs值分別為Ca2+濃度為4 mmol·L-1時的28.38% 和48.65%。由此可見,隨Ca2+脅迫程度的加劇,柳葉蕨的Gs波動相對較小。在Tr方面亦有近似的變化趨勢。從而反映了柳葉蕨的氣孔開合和蒸騰作用過程對Ca2+濃度變化有較優的適應性,保證了其對外界環境變化的積極響應,這很有可能是其能在有高Ca2+濃度的石灰土地區得以生存的原因之一。
由表2還可以看出,薄葉雙蓋蕨在Ca2+濃度大于100 mmol·L-1時的蒸騰速率及氣孔導度遠高于在Ca2+濃度為30 mmol·L-1時的蒸騰速率及氣孔導度,這一方面可能是因為較高的Ca2+濃度破壞了薄葉雙蓋蕨的氣孔結構,使其不能及時調節氣孔開合[3],另一方面可能是因為脅迫出現時,薄葉雙蓋蕨僅關閉了相對小部分的氣孔,通過強的蒸騰作用吸收更多的水分進入體內以降低體內Ca2+濃度。

表2 2種蕨類植物蒸騰速率均值(Tr, mmol·m-2·s-1) 與氣孔導度均值(Gs, mol·m-2·s-1) Table 2 Transpiration rate ( Tr, mmol·m-2·s-1 ) and stomatal conductivity ( Gs, mol·m-2·s-1 ) in medium level of the two ferns’ leave under different calcium concentration level
3 討論及結論
3.1 討論
Ca2+濃度從30 mmol·L-1增加到100 mmol·L-1,2種植物的凈光合速率( Pn )均陡然下降,其中柳葉蕨下降了35.48%,薄葉雙蓋蕨下降了42.71%,顯示當受Ca2+脅迫時,柳葉蕨光合速率降低相對緩慢,這時高光合有利于應對鈣脅迫。在更高Ca2+濃度 ( 200 mmol.L-1) 控制下,薄葉雙蓋蕨的 Pn 略高于柳葉蕨的 Pn,這可能是由于薄葉雙蓋蕨受 Ca2+脅迫加劇,到了必須通過加快提高代謝速率以降低體內 Ca2+濃度的程度,而使作為植物最基礎代謝過程的光合作用被瞬時增強所致[3-6,16]。但在該濃度下,柳葉蕨并無此特征表現,這一過程進一步說明了柳葉蕨較薄葉雙蓋蕨更利于在高鈣環境中生存,柳葉蕨具有相對更高的耐鈣能力。
土壤中的Ca2+可通過植物根部的Ca2+通道直接進入根系表皮細胞及根毛[17-18],并在Ca2+-ATPase的協助下進入木質部[16]。雖然“Ca2+的吸收同步于水分的吸收”這一觀點一直備受爭議[19],但蒸騰作用的增強既有助于植物對Ca2+的吸收,又有利于Ca2+依靠蒸騰拉力在植物體內運移和積累已被實驗證明[20]。因此,植物適應高鈣環境應該涉及到植株對Ca2+的吸收、轉運、積累等各個環節。薄葉雙蓋蕨在高Ca2+濃度環境中保持較高的光合作用強度,為加快代謝速率降低體內Ca2+提供了可利用的能量;而同樣條件下,柳葉蕨通過關閉大部分氣孔、降低蒸騰作用強度等行為,在減少水分散失的同時亦限制了過量Ca2+進入植株地上部分,這與前人的相關研究結論基本一致[4]。另外,在較高Ca2+濃度時,柳葉蕨仍能使其蒸騰作用對氣溫變化進行較敏銳的積極響應,也為其能在Ca2+含量較高的石灰土地區生存提供了條件。
不同Ca2+濃度控制下,2種植物的葉片凈光合速率 ( Pn )始終與胞間CO2濃度 ( Ci ) 呈顯著負相關 (P< 0.01 ),從而認為,柳葉蕨和薄葉雙蓋蕨在 Ca2+濃度控制下發生的凈光合速率降低的行為很有可能是由非氣孔限制因素引起的[21]。同時,隨 Ca2+脅迫加劇,柳葉蕨的 Pn 與 Tr 均降低,說明由 Ca2+濃度升高引起的柳葉蕨 Pn 降低可能與其葉片受熱害、葉肉細胞羧化酶活性降低有關[22];當 Ca2+濃度大于 30 mmol·L-1時,薄葉雙蓋蕨的 Pn 降低,但 Tr 略有上升,說明薄葉雙蓋蕨Pn降低除了與其葉片葉肉細胞羧化能力有關外,還可能與過量 Ca2+引起葉片葉綠素含量降低等因素有關[23-24]。
3.2 結論
實驗設計Ca2+營養液4個濃度梯度上,柳葉蕨和薄葉雙蓋蕨的日 Pn(max)最高值對應的Ca2+濃度分別為30 mmol·L-1和4 mmol·L-1。當 Ca2+濃度為 30 mmol·L-1時,柳葉蕨的 Tr 與薄葉雙蓋蕨的 Tr基本相近,其余濃度梯度上二者差異顯著 (P< 0.001 )。柳葉蕨和薄葉雙蓋蕨的葉片Pn與Ci 均呈顯著負相關關系 (P< 0.01 )。不同Ca2+濃度梯度下柳葉蕨相對于薄葉雙蓋蕨的Tr和Gs均處于較低水平,2種植物的Tr與Gs在不同Ca2+濃度間均具有極顯著差異 (P< 0.001 )。
從植物光合作用特征的角度考慮,柳葉蕨能夠在高鈣環境的石灰土上正常生存的原因在于:鈣離子脅迫發生時,柳葉蕨能保持相對穩定的光合速率及蒸騰速率變化趨勢;脅迫持續期間,在保證生存的前提下控制其光合速率及蒸騰速率處于較低的水平,以相對保守的姿態度過脅迫。
[1] LIANG W J, WANG M L, AI X Z. The role of calcium in regulating photosynthesis and related physiologicalindexes of cucumber seedlings under low light intensity and suboptimal temperature stress[J]. Scientia Horticulturae, 2009, 123: 34-38.
[2] 李強, 曹建華, 余龍江, 等. 干旱脅迫過程中外源鈣對忍冬光合生理的影響[J]. 生態環境學報, 2010, 19(10): 2291-2296.
[3] 李青云, 葛會波, 胡淑明, 等. 鈉鹽和鈣鹽脅迫對草莓光合作用的影響[J]. 西北植物學報, 2006, 26(8): 1713-1717.
[4] 姬飛騰, 李楠, 鄧馨. 喀斯特地區植物鈣含量特征與高鈣適應方式分析[J]. 植物生態學報, 2009, 33(5): 926-935.
[5] WHITE P J, BROADLEY M R. Calcium in plants[J]. Annals of Botany, 2003, 92: 487-511.
[6] HIRSCHI K D. The calcium conundrum, both versatile nutrient and specific signal[J]. Plant Physiology, 2004, 136: 2438-2442.
[7] 曹建華, 袁道先, 潘根興. 巖溶生態系統中的土壤[J]. 地球科學進展, 2003, 18(1): 37-44.
[8] 謝麗萍, 王世杰, 肖德安. 喀斯特小流域植被—土壤土壤系統鈣協變關系研究[J]. 地球與環境, 2007, 35(1): 26-32.
[9] 安德艷, 艾復清. 銅仁地區植煙土壤類型及肥力分析[J]. 貴州農業科學, 2010, 38(6): 126-129.
[10] 許大全. 光合作用氣孔限制分析中的一些問題[J]. 植物生理學通訊, 1997, 33(4): 241-244.
[11] MARKS C O, LECHOWICZ M J. The ecological and functional correlates of nocturnal transpiration[J]. Tree Physiology, 2007, 27: 577-584.
[12] TUZET A, PERRIER A, LEUNING R. A coupled model of stomatal conductance, photosynthesis and transpiration[J]. Plant, Cell and Environment, 2003, 26: 1097-1116.
[13] 王建林, 林榮芳, 于貴瑞, 等. 光和CO2作用下C3和C4作物氣孔導度—光合速率耦合關系的差異[J]. 華北農學報, 2008, 23(1): 71-75.
[14] MIYASHITA K, TANAKAMARU S, MAITANI T, et al. Recovery responses of photosynthesis, transpiration, and stomatal conductance in kidney bean following drought stress[J]. Environmental and Experimental Botany, 2005, 53: 205-214.
[15] 廖巖, 陳桂珠. 三種紅樹植物對鹽脅迫的生理適應[J]. 生態學報, 2007, 27(6): 2208-2214.
[16] WHITE P J. The pathways of calcium movement to the xylem[J]. Journal of Experimental Botany, 2001, 52: 891-899.
[17] DAVENPORT R, TESTER M. A weakly voltagedependent,non-selective cation channel mediates toxic sodium influx in wheat[J]. Plant Physiology, 2000, 122: 823-834.
[18] WHITE P J. Calcium channels in higher plants[J]. Biochimiea et Biophysica Acta, 2000, 1465: 171-189.
[19] ATKINSON C J, RUIZ L P, MANSFIELD T A. Calcium in xylem sap and the regulation of its delivery to the shoot[J]. Experimental Botany, 1992, 43: 1315-1324.
[20] GIUSEPPE M, BARTOLOMEO D, CRISTOS X. Significance of fruit transpiration on calcium nutrition in developing apricot fruit[J]. Plant Nutr. Soil Sci, 2010, 173: 618-622.
[21] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Ann Rev Plant Physiol, 1982, 33: 317-345 .
[22] 郭衛東, 鄭建樹, 張真真, 等. 短暫低溫對佛手光合生理的影響[J]. 生態學報, 2009, 29(5): 2286-2293.
[23] CANDANA N, TARHANB L. Effects of Calcium, Stress on Contents of Chlorophyll and Carotenoid, LPO Levels, and Antioxidant Enzyme Activities in Mentha[J]. Journal of Plant Nutrition, 2005, 28:127-139.
[24] 鄒文桐, 熊德中. 土壤交換性鈣水平對烤煙若干生理代謝的影響[J]. 安徽農業大學學報, 2010, 37(2): 369-373.

